肺炎嗜衣原體Cpn0425重組蛋白的克隆與表達及抗原性研究*
肖光文,劉良專,徐 磊,謝小平,3,吳移謀
肺炎嗜衣原體(Chlamydophilapneumoniae,Cpn)除引起呼吸道疾病外,還與一些其他疾病如結節性紅斑、Guillian-Barré綜合征、結節病、反應性關節炎[1]以及慢性動脈粥樣硬化[2-3]等疾病有關。Cpn致病機制的研究多年來一直是衣原體研究的熱點之一。
有研究證實,在Cpn中存在獨立的能分泌毒力因子的細胞器[4]——III型分泌系統(Type III se-cretion system,T3SS)。T3SS由30~40kbp基因編碼,以毒力島的形式存在于細菌的質粒或染色體上,其主要作用是通過接觸依賴性轉運機制將效應蛋白轉入宿主細胞(真核細胞)中,從而影響宿主細胞的正常新陳代謝及其功能[5]。
Robert等用非線性pH3-10的預制金條進行二維電泳證實了Cpn0425存在于Cpn蛋白簇中。其基因由588個堿基構成,分子量大約為21.3kD,目前功能不明。許多研究者認為編碼T3SS效應蛋白的基因通常位于其伴侶蛋白的附近[6],Cpn0425位于編碼T3SS的基因族內,因此將其預測為CpnT3SS的一個效應蛋白。本研究主要通過從Gen-Bank中得到Cpn0425編碼基因的堿基序列,對照pGEX6p-2載體上的多克隆酶切位點,設計一對特異性擴增引物。對該蛋白進行體外的克隆表達及純化,為CpnT3SS效應蛋白的篩選與鑒定及其致病作用的研究奠定基礎。
1 材料與方法
1.1 菌株、重組質粒和細胞株 pGEX6p-2質粒,E.coliBL21菌株:均為南華大學病原生物學研究所保存。
1.2 工具酶、分子量標準、試劑盒 Tag酶、T4連接酶、BamHⅠ、NotⅠ限制性內切酶購自美國Promega公司;次高分子量蛋白Marker購自北京MBI公司;1kbp和100bp DNA分子量標準購自美國MBI公司;AxyPrep PCR試劑盒購自Axygen公司;GST純化樹脂購自默克Novagen。
1.3Cpn0425基因的擴增Cpn0425基因全長序列通過互聯網從GenBank獲得,對照pQE30載體上的多克隆酶切位點,采用Primer Premier 5.0軟件設計Cpn0425基因的特異性擴增引物。分別在上游引物(P1)和下游引物(P2)中引入BamHⅠ酶切位點核苷酸G▼GATCC和NotI酶切位點核苷酸GC▼G G CCGC,同時加上保護性堿基。引物由武漢Invitrogen公司合成,上游引物:5′-CGC G▼GATCCATG AAT AAA AAG CCC AAG AAA AC-3′(下劃線為BamHⅠ酶切位點),下游引物:5′-TTTTCCTTTT GC▼G G CCGC TTA CTC AGC GCC TTT AAC CAT -3′(下劃線為NotⅠ酶切位點),以CpnAR-39標準株的基因組DNA為模板。用PyrbestTMDNA高保真聚合酶(TaKa-Ra公司產品)進行PCR。PCR反應體系:10×buffer(含 MgCl2)5μL、2.5mmol/LdNTP 4μL、50fmol/L 引物各0.5μL、PyrbestTMDNA polymerase(5U)0.25μL、DNA模板1μL,加水至總體積為50μL。擴增參數:混勻后點離,94℃預變性5min后,進入94℃變性30s,52℃退火45s,72℃延伸60s的循環,共計30次,末次循環后72℃延伸10min,終止反應。
1.4 pGEX6p-2/Cpn0425原核表達載體的構建采用Axygen公司的AxyPrep PCR試劑盒對PCR產物進行純化,將純化的PCR產物(Cpn0425基因)與克隆載體pGEX6p-2在T4DNA連接酶的作用下,16℃連接過夜,克隆重組體pGEX6p-2/Cpn0425轉入感受態E.coliBL21,增菌后,氨芐青霉素和藍白斑篩選陽性克隆,提取重組體質粒,PCR及BamHⅠ和NotⅠ(美國Promega公司)雙酶切鑒定重組情況。
1.5 核苷酸序列測定 將連接成功的陽性克隆pGEX6p-2/Cpn0425菌液(E.coliBL21)送上海生工進行目的基因測序,序列測定結果與GenBank上發表的CpnAR-39Cpn0425序列進行Blast比較,以判斷目的片段是否連接成功。
1.6Cpn0425在E.coli中的誘導表達及鑒定 取重組質粒pGEX6p-2/Cpn0425E.coliBL21轉化菌10μL,將菌液加到LB固體培養基(含氨節青霉素)上,用接種環劃平板,37℃培養14h,挑取1個陽性菌落,加入2mL含氨芐青霉素的LB液體培養基中,37℃水浴振蕩培養過夜;次日以1∶50的比例接種于5mL含氨芐青霉素的LB液體培養基,重組菌培養至OD值為0.6左右時,向培養物中加入IPTG至終濃度為0.2mmol/L,30℃分別誘導表達4h;取1.0mL菌液13 000r/min離心30s,收集菌體沉淀,分別用100μL 2×SDS凝膠加樣緩沖液重懸,然后100℃水浴中加熱5min,13 000r/min離心5min,留上清作SDS-PAGE分析。
1.7Cpn0425純化 按照上述條件進行大規模誘導表達,10 000r/min離心20min收獲菌體沉淀。PBS洗滌沉淀,重懸于PBS中(每克濕菌體加8mL PBS),并加入溶菌酶至4.0g/L;室溫孵育2h,超聲裂菌(10s/次,間歇10s;共計30次)。10 000r/min離心20min分別收集上清和沉淀。取超聲裂菌上清,采用默克Novagen的GST純化樹脂按說明純化pGEX6P-2/Cpn0425重組表達產物 GSTCpn0425,分別收集過柱液以及各段洗滌、洗脫液,取樣進行SDS-PAGE電泳分析。合并洗脫液,用tris8.0將目的蛋白透析2~3次,換蒸餾水透析1~2次,再回收透析袋里的液體。
1.8Cpn0425蛋白的鑒定 純化產物經SDS-PAGE電泳后轉印硝酸纖維素膜,用TBST 1:200稀釋的鼠抗CpnAR-39多克隆抗體為一抗,1∶5 000稀釋的HRP標記的兔抗小鼠IgG為二抗進行Western-Blot鑒定,鑒定其抗原性。
2 結 果
2.1 pGEX6p-2/Cpn0425的 PCR 擴增 將 PCR擴增產物于1.0%瓊脂糖凝膠電泳,結果顯示,在約590bp左右位置可見一條清晰的特異性條帶(圖1),與預期片段大小(588bp)相符。
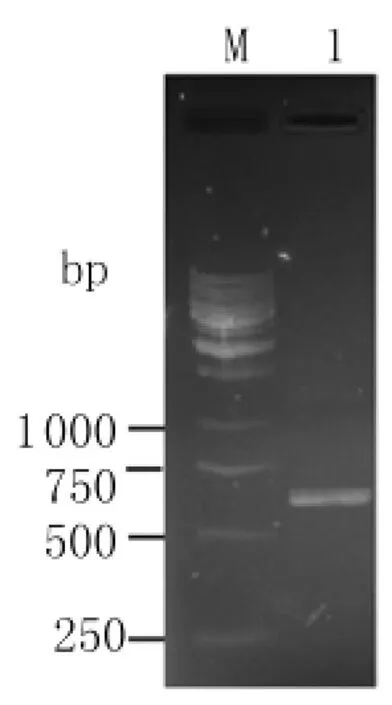
圖1 pGEX6p-2/Cpn0425質粒PCR鑒定Fig.1 PCR analysis of pGEX6p-2/Cpn0425plasmidM:DNA marker;1:PCR product of PGEX6p-2/Cpn0425
2.2 pGEX6p-2/Cpn0425原核表達載體的構建及鑒定 構建的pGEX6p-2/Cpn0425重組質粒經BamHⅠ和NotⅠ雙酶切,結果經1%瓊脂糖凝膠電泳分析可見,酶切后出現了兩個片段,大片段接近4 900bp,小片段約590bp左右與預期值(588bp)相符(圖2);初步證明Cpn0425目的基因成功地嵌入pGEX6p-2載體中。

圖2 pGEX6p-2/Cpn0425質粒的雙酶切鑒定Fig.2 Restriction enzyme digest analysis of pGEX6p-2/Cpn0425plasmid1:PGEX6p/Cpn0425plasmid digested by BamHI and XhoⅠ;2:PGEX6p/Cpn0425recombinant plasmid;M:15 000bp DNA marker
2.3 核苷酸序列分析Blast分析 將重組質粒進行序列測定,BLAST軟件對測序結果與GenBank上登錄的編碼序列進行比對,結果表明擴增的Cpn0425目的基因序列與登錄號為gi 15617929上基因完全一致,無堿基突變,且密碼子讀碼框架正確。
pGEX6p-2/Cpn0425重組質粒的誘導表達與純化及其鑒定 將pGEX6p-2/Cpn0425重組質粒轉化至E.coliBl21表達宿主菌進行誘導表達。SDSPAGE結果顯示:誘導菌在Mr約為50kDa處有明顯條帶,與預期的分子量相符。GST-Cpn0425重組蛋白上GST融合蛋白純化柱,12%SDS-PAGE分析發現,緩沖液Ⅰ,Ⅱ,III洗脫下少量目的蛋白,洗脫液在相應位置最終收集得到純化融合蛋白,其Mr約為50kDa。融合蛋白下可見一些條帶,考慮為融合蛋白降解產物形成,見圖3。

圖3 GST-Cpn0425純化的SDS-PAGE結果Fig.3 SDS-PAGE of purified GST-Cpn0425M:Protein marker;1:Precipitation of broken induced Bl21with pGEX6p-2/Cpn0425;2:Supernatant of broken induced Bl21with pGEX6p-2/Cpn0425;3:Flow-through;4-6:Washes;7-9:Eluates(Purified GST-Cpn0425)
2.4 GST-Cpn0425重組蛋白的 Western blot鑒定以鼠抗CpnAR-39多克隆抗體為一抗,Western blot檢測誘導表達的GST-Cpn0425,結果表明在Mr約為50kDa處出現了明顯的特異性反應條帶,而未誘導的菌體無特異性條帶出現,見圖4。
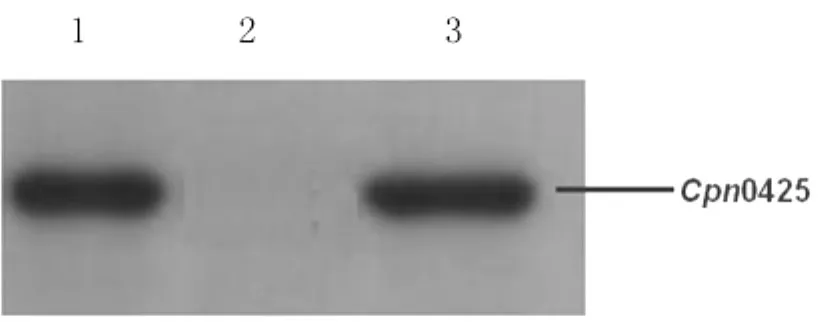
圖4 GST-Cpn0425的免疫印跡鑒定Fig.4 Western blot analysis of the GST-Cpn0425recombinant protein1:Induced Bl21with pGEX6p-2/Cpn0425;2:Noninduced Bl21with pGEX6p-2/Cpn0425;3:Purified GST-Cpn0425recombinant protein
3 討 論
本研究選擇的pGEX6p-2表達載體,是經pBR322質粒改造而來的一種原核表達載體,采用乳糖操縱子調控模式,啟動子是Ptac,使mRNA轉錄水平提高,可以誘導外源基因在宿主菌中高效表達。它含有供目的基因插入的多克隆位點,并攜帶氨芐青霉素β-內酰胺酶抗性基因,有利于轉化宿主菌后篩選陽性克隆;同時含有GST的編碼序列,可使表達的外源重組蛋白融合入一個相對分子質量約26×103的GST純化標簽,該標簽對表達蛋白的有效純化和保持蛋白質的天然生物學活性作用重大。對GST融合蛋白采用默克Novagen的GST純化樹脂進行純化,GST純化填料的專一性非常高,只對GST及其融合蛋白具有吸附活性,有利于提高目標蛋白的純度;同時利用GST與GSH的親和作用來純化蛋白,只有GST天然蛋白才具有該親和特性,因此得到的純化蛋白能夠保持其天然的生物學活性。本研究中我們選擇pGEX6p-2作為原核表達載體,高效表達了GST融合蛋白,有效純化的GST融合蛋白不但純度高而且具有天然生物學活性,為后續實驗的準確性奠定良好的基礎。
本研究選擇的表達菌E.coliBL21是常用的表達菌株,一般配合以強表達載體pGEX載體來進行目的基因的強表達。由于BL21菌株缺失Lon和OmpT蛋白酶產物,這可以降低宿主細胞內蛋白酶降解的影響。此外還可以幫助提高完整可溶性蛋白的產率。為高效表達可溶性GST融合蛋白提供良好條件。
用PCR法從CpnAR-39基因組模板中擴增出目的片段,經測序證實與基因庫登陸的核苷酸序列一致,將目的基因亞克隆到原核表達載體構建了表達重組體pGEX6p-2/Cpn0425,并成功轉化至E.coliBL21。重組蛋白可以充分結合在默克Novagen的GST純化樹脂柱上,經純化得到高純度的目的蛋白。本研究還對重組融合蛋白進行了透析處理,蛋白透析可降低谷光甘肽(GST)的濃度,因而進一步優化了本研究的條件。此外,蛋白免疫印跡進一步分析了表達的重組蛋白及純化蛋白的免疫特性,重組蛋白能與鼠抗CpnAR-39多克隆抗體發生反應,說明了目的蛋白能在大腸桿菌中表達,并具有很好的抗原性。
目前CpnT3SS效應蛋白的相關研究已成為國內外研究的熱點,其效應蛋白的鑒定及致病作用的研究已經取得了一些成果,支持性的證據[4]包括與其它細菌T3SS效應蛋白有相似的直接序列或二級結構;與其它T3SS同源體接合或共沉淀;T3SS介導的分泌物的論證或目的效應蛋白通過一個替代宿主細菌T3SS分泌 。有資料表明,效應蛋白包含多種毒性效應,包括細胞骨架的改變、破壞信號轉導途徑和抑制凋亡活性以及干擾宿主轉錄調節等[7]。Cpn0425是一個目前尚未知功能的蛋白,其基因位于T3SS伴侶蛋白附近。研究其生物學作用及其在致病過程中的作用對了解其是否和Cpn致病有關及篩選、鑒定其是否屬于CpnT3SS效應蛋白奠定基礎。
[1]Grayston JT.Chlamydiapneumoniaeand atherosclerosis[J].Clin Infect Dis,2005,40(8):1131-1132.DOI:10.1086/428739
[2]Campbell LA,Kuo CC.Chlamydiapneumoniae--an infectious risk factor for atherosclerosis[J].Nat Med Microbiol,2004,2(1):23-32.DOI:10.1038/nrmicro796
[3]Vardhan H,Dutta R,Vats V,et al.Persistently elevated level of IL-8inChlamydiatrachomatisinfected HeLa 229cells is dependent on intracellular available iron[J].Mediators Inflamm,2009,2009:417658.DOI:10.1155/2009/417658
[4]Liu LZ,Wu YM.Research progress on the effector proteins ofChlamydiatype III secretion system[J].Chin J Zoonoses,2009,25(4):376-378.(in Chinese)劉良專,吳移謀.衣原體III型分泌系統效應蛋白研究進展[J].中國人獸共患病學報,2009,25(4):376-378.
[5]Flynn JL,Bloom BR.Role of T1and T2cytokines in the response toMycobacteriumtuberculosis[J].Ann N Y Acad Sci,1996,795:137-146.DOI:10.1111/j.1749-6632.1996.tb52662.x
[6]Muller N,Sattelmacher F,Lugert R,et al.Characterization and intracellular localization of putativeChlamydiapneumoniaeeffector proteins[J].Med Microbiol Immunol,2008,197(4):387-396.DOI:10.1007/s00430-008-0097-y
[7]Mota LJ,Cornelis GR.The bacterial injection kit:typeⅢsecretion systems[J].Ann Med,2005,37(4):234-249.DOI:10.1080/07853890510037329

