煙草葉片蛋白質組雙向電泳實驗體系的建立
王紹美,羅成剛,劉貫山,馮全福,蘇振剛,陳雅瓊,蔣彩虹,孫玉合
(煙草行業煙草遺傳育種重點實驗室,中國農業科學院煙草研究所,青島 266101)
蛋白質組學是后基因組時代功能基因組學研究的新興學科和熱點領域。隨著各種新研究技術漸趨成熟,蛋白質組的概念于1994年被提出[1-2],它是從整體、動態、網絡的水平上對蛋白質進行研究,研究蛋白質組是研究認識復雜生命活動的要求。
蛋白質組學的發展是隨著蛋白質研究技術的發展而發展的。雙向電泳技術是蛋白質組學研究的核心技術之一。它先后利用蛋白質等電點和分子量的不同在兩個方向上分離蛋白質復雜組分,因分辨率和靈敏度較高,是復雜蛋白組分檢測和分析強有力的一種生化技術。目前應用的雙向凝膠電泳體系是以 1975年 O’Farrell首創的技術方案體系[3]為基礎,不斷改進應用中出現的問題建立起來的[4-5]。該體系克服了載體兩性電解質陰極漂移等缺點,建立起非常穩定的pH梯度,使雙向凝膠電泳結果的重復性和分辨率顯著提高[6]。
雙向電泳技術最初主要適于分析動物組織和微生物細胞全蛋白組分。隨著蛋白質組學研究技術的發展和不斷完善[7],近年來,植物蛋白質組學研究相繼借鑒動物蛋白質組學研究方法,改進措施減少實驗中的干擾因素展開研究。如擬南芥[8]等模式植物中已廣泛展開;在水稻[9-10]、大豆[11-12]、小麥[13-14]、玉米[15-16]等重要農作物的抗性、品質等方面的蛋白質組研究也取得了一定進展,先后見諸報道。關于煙草蛋白質組學研究可見的英文報道有:Duby 等[17]、Goulet等[18]開展了基礎研究;Pineda等[19]、Razavizadeh等[20]等開展了逆境脅迫研究;Kaida等[21]、Chivasa等[22]和 Millar等[23]開展了代謝調控研究;在國內開展的煙草蛋白質組學研究很少。本實驗的目的在于建立不同發育時期煙草葉片蛋白質組研究適用的雙向電泳實驗體系,為進一步開展煙草葉片蛋白質組學研究提供參考體系。
1 材料與方法
1.1 實驗材料
本實驗選用中國煙草遺傳育種研究(北方)中心保存的干旱敏感型栽培煙草品種中煙100[24-25]和感黑脛病栽培煙草品種小黃金 1025[26]作為實驗品種,2010年9月種植于中國農業科學院煙草研究所煙草種質資源樓三樓溫室。中煙100移栽于裝有相同質地、重量營養土的同一規格白色塑料花盆中,旺長后期取樣;小黃金1025假植后長到5片左右真葉取樣。兩個品種各選取6株長相一致的煙株摘取同一部位煙葉,用鋁薄紙分別包裝、標記、裝入小布袋,迅速投入液氮罐中保存備用。
1.2 蛋白質樣品制備與定量
1.2.1 中煙100旺長后期葉片蛋白質樣品制備與定量 蛋白質的提取參照 Damerval等、Tsugita等及Giavalisco等[27-29]等所記述的TCA/丙酮法稍加改進,提取旺長后期煙草葉片總蛋白質。
稱取1 g液氮保存的鮮煙葉樣品,按煙葉重量的10%加入PVP,加液氮充分研磨成粉末,轉入2 mL離心管。
處理1(除雜質1次):加入1.5 mL -20 ℃預冷丙酮,輕輕搖勻,冰浴,沉淀1 h,14 000 r/min 4 ℃離心30 min,棄上清;
處理2(除雜質2次):將處理1的沉淀重懸于1.5 mL預冷丙酮,重復處理1的操作一次。
沉淀用1.5 mL含10% TCA和1% DTT的丙酮懸浮,混勻,置于-20 ℃冰箱沉淀過夜;14 000 r/min 4 ℃離心30 min,棄上清;加入含0.07% DTT和1 mmol/L PMSF的預冷丙酮1.5 mL,輕搖懸浮之,冰浴,沉淀30 min,12 000 r/min 4 ℃離心30 min,棄上清;加入90%丙酮,12 000 r/min 4 ℃離心30 min,棄上清,重復同樣操作,洗滌沉淀一次;室溫晾干沉淀。在沉淀中加入250 μL裂解液[8 mol/L尿素,2 mol/L硫脲,0.5%(w/v)CHAPS,2%(w/v)兩性電解質,1%DTT,1 mmol/L PMSF],并加入 50 μg/mL DNase I,12 000 r/min 4 ℃離心30 min,取上清用bradford法測定總蛋白質濃度[30],-80 ℃保存準備雙向電泳分離蛋白質。
1.2.2 小黃金 1025苗期葉片蛋白質樣品制備與定量 蛋白質的提取參照Giavalisco等[29]和Suxia cui等[10]的蛋白質分級抽提法,并結合 Hurkman等[31]的蛋白質酚抽提法和丙酮洗滌蛋白質沉淀,稍加改進,提取苗期煙葉總蛋白質。
取4~5 g液氮中保存的苗期煙葉樣品置于研缽中,加液氮研磨至泛白的粉末;將新配制的抽提buffer I [抽提緩沖液Ⅰ儲液4 mL(50 mmol/L pH 7.8的 Tris-HCl、10 %甘油、1 mmol/L EDTANa2混溶于100 ml MilliQ H2O,4 ℃保存)、10 mg/mL PMSF 69.6 μL 和 2% β-巰基乙醇 4 μL]加入研缽,充分研磨后,轉入10 mL離心管,輕搖幾下,置4 ℃冰箱30 min;取出于4 ℃,14 000 r/min離心30 min,上清轉入新的15 mL離心管4 ℃保存之;沉淀中加入新配制的抽提 buffer Ⅱ [抽提緩沖液Ⅱ儲液2 mL(100 mmol/L pH 7.1的磷酸緩沖液、10%甘油、0.2 mol/L KCl、2 mmol/L MgSO4·7H2O、1 mmol/L EDTANa2溶于 100 mL MilliQ H2O,4 ℃保存)、2%(w/v)CHAPS 40 mg、10 mg/mL PMSF 34.8 μL、2% β-巰基乙醇 2 μL]懸起沉淀,輕輕混勻,靜置幾分鐘,置4 ℃冰箱30 min后取出,按加入抽提buffer Ⅱ的體積為2 mL計算,直接加入7 mol/L尿素,2 mol/L硫脲,30 mmol/L DTT,室溫輕輕搖勻30 min;在18 ℃,14 000 r/min,離心30 min,上清混入抽提buffer I抽提得到4 ℃保存的上清中;混合后的上清液4 ℃,14 000 r/min離心30 min,上清轉入新的離心管內,并加同上清液等體積的Tris飽和酚,室溫搖床混勻30 min,在4 ℃,14 000 r/min離心30 min,取下層酚相轉移入新的50 mL離心管中,并加入5倍體積-20 ℃保存的0.1 mol/L乙酸胺(溶于甲醇),輕輕混勻,置于4 ℃冰箱靜置過夜;第2天在4 ℃,8000 r/min離心30 min,棄上清,用-20 ℃預冷的冰丙酮2~3 mL(含 150 μL 13 mmol/L DTT)洗滌沉淀,4 ℃,8000 r/min離心15 min,重復洗滌沉淀一次并離心棄上清;去蓋,封口膜包口,膜上扎若干小孔,于-40 ℃冷凍干燥成蛋白質凍干粉,轉入2 mL離心管用封口膜密封,-80 ℃保存備雙向電泳使用。
1.3 蛋白質雙向電泳及凝膠掃描圖像分析
1.3.1 中煙100旺長后期葉片總蛋白質樣品分離及凝膠掃描圖像分析 采用的雙向電泳技術是在O’Farrell技術方法[3]的基礎上稍加改進。
用Bio-Rad的17 cm IPG預制膠條、MultiphorⅡ進行等電聚焦。樣品定量后吸取含1 mg總蛋白的樣品溶液,用溶脹buffer(8 mol/L尿素,2 mol/L硫脲,0.5%CHAPS,0.52%兩性電解質,0.02%溴酚藍,1% DTT)稀釋至 170 μL,將溶脹 buffer泡脹好的預制膠條膠面朝上放入聚焦槽,固定上樣杯,加入蛋白質上樣溶液進行等電聚焦(表1)。

表1 等電聚焦程序Table 1 Running condition of isoelectric focusing (IEF)
等電聚焦結束,膠條立即置于水化盤中平衡兩次:在膠條平衡緩沖液母液(50 mmol/L Tris-HCl pH 8.8,6 mol/L尿素,30%甘油,2%SDS,0.02%溴酚藍,MilliQ H2O)中加入終濃度2% DTT制成平衡緩沖液 I,水平振蕩 15 min,用 MilliQ H2O沖洗膠條;轉入由膠條平衡緩沖液母液和終濃度為2.5% IAA制成的平衡緩沖液II,水平振蕩15 min,MilliQ H2O沖洗膠條,進行第二向電泳。
平衡后的膠條置于12% SDS-PAGE膠上端,marker放置凝膠一端,用0.5%的瓊脂糖封膠,使用Bio-Rad公司的Protean Ⅱ Xi cell電泳系統,電泳儀設置:第1步,15 mA/膠,恒流電泳15 min;第2步,250 V,恒壓電泳,待溴酚藍指示劑達到底部邊緣時停止電泳。
電泳結束后,采用膠體考馬斯亮蘭G-250染色法[32]進行凝膠染色。先用蒸餾水漂洗 3次,5 min/次,加入染色液(10%硫酸銨、10%磷酸、0.12% G250、20%甲醇)過夜,用脫色固定液(3%冰醋酸溶液、12%的無水乙醇和 MilliQ H2O)脫色多次至背景變成透明,蛋白質點變得圓潤,最后換成MilliQ H2O洗滌30 min。
凝膠脫色完全后,用美國UMAX公司生產的PowerLook 2100XL圖像掃描儀掃描獲取.tif格式的凝膠圖像:圖像與原膠尺寸大小一致、透射模式、300 dpi分辨率。凝膠圖像用PDQuest軟件進行處理、比對分析,生成比對結果報告。通過比對結果報告篩選我們需要的目標差異蛋白質。
1.3.2 小黃金 1025苗期葉片總蛋白質樣品分離及凝膠掃描圖像分析 參照Huang等[33]的蛋白質樣品再水化方法。稱取-80 ℃保存的蛋白質干粉0.8、1.2、1.5、2.0 mg,分別置于2 mL離心管中,加入480 μL樣品水化液[7 mol/L尿素、2 mol/L硫脲、4%(w/v)CHAPS、2‰(w/v)溴芬藍、40 mmol/L DTT、0.5%(v/v)(pH 4-7)IPG buffer],室溫下充分溶解,10 000 r/min離心5 min去除未溶雜質,取上清液,以 BSA作為標準對照,用Peterson[34]、Cui等[10]的方法定量蛋白質。
參照Huang等[33]的方法進行等電聚焦。使用Amersham Phamacia Bintech公司的 24 cm(pH 4-7)線性IPG膠條,上樣體積為450 μL,水化盤過夜水化上樣,用GE公司的Ettan IPGphor 3進行等電聚焦,儀器運行設置為恒溫20 ℃(表2)。

表2 等電聚焦儀運行參數Table 2 IEF operation parameters
等電聚焦結束,取出膠條置于平衡管中立即平衡兩次:平衡緩沖液I含1%(w/v)的DTT;平衡緩沖液II含2.5%(w/v)的IAA外,其他步驟同1.3.1。
參照 Laemmli[35]方法制備 12.5%的第二向SDS-PAGE凝膠,平衡后的IPG膠條置于上端,用1×電極緩沖液配制0.7%的低熔點瓊脂糖(含痕量溴酚藍)封膠,用GE公司的Ettan DALTsix進行第二向電泳,運行設置恒溫15 ℃(表3)。

表3 第二向垂直板電泳運行參數Table 3 2 Vertical board electrophoresis operation parameters
電泳結束后,凝膠用MilliQ H2O漂洗5 min,加考馬斯亮藍 R-250染色液[0.1%(w/v)考馬斯亮藍R-250、45%甲醇、10%(v/v)冰乙酸]染色3 h;加脫色液[20%(v/v)乙醇、8%(v/v)冰乙酸]脫色,更換2~3次,至背景變白,蛋白質斑點清晰鮮明。
凝膠脫色完全后,用ImageScanner Ⅲ掃描儀及ImageScanner Labscan掃描軟件掃描圖像,設置256階灰度、300 dpi透射掃描,.mel或者.TIFF格式圖像,圖像尺寸與原膠一致。凝膠圖像用軟件ImageMaster 2D Platinum 7.0進行分析比對,生成結果報告,篩選目標差異蛋白質。
2 結 果
2.1 中煙100旺長后期葉片總蛋白質提取條件的初步優化
圖1用pH 3-10膠條對TCA/丙酮法提取煙葉總蛋白質進行雙向電泳預實驗。煙葉樣品液氮研磨后,a用預冷丙酮沉淀一次,雙向電泳圖譜豎條紋較濃,說明提取的總蛋白質中雜質較多;b用預冷丙酮沉淀兩次,雙向電泳圖譜豎條紋明顯減弱,背景較清晰。因此,TCA/丙酮法提取煙葉總蛋白質時,用預冷丙酮沉淀研磨后的樣品兩次,可更好的去除樣品中的色素、酚類和醌等次生代謝物,更適合旺長后期煙葉蛋白質雙向電泳分析。

圖1 液氮研磨后預冷丙酮沉淀的雙向電泳圖譜Fig.1 2-DE gel image of cold acetone precipitation after grinding leaves of zhongyan 100 with liquid nitrogen
2.2 中煙100旺長后期葉片總蛋白質分離第一向IPG膠條的篩選
圖2中,選擇pH 3-10、pH 3-10 NL、pH 4-7的17 cm IPG膠條,用優化的TCA/丙酮法提取總蛋白質樣品,上樣量相同,比較雙向電泳凝膠圖譜上得到清晰圓潤蛋白質點的數量。a膠圖清晰圓潤的蛋白質點集中分布在pH 4~pH 8,說明集中于這一區域的蛋白質種類和數量較多,但pH 6~pH 7分子量為66 KD左右的蛋白質沒有得到很好的分離,且pH<4和pH>8區域蛋白質點很少,輪廓不太清楚,有重疊;b膠圖清晰圓潤的蛋白質點分布在pH 4~pH 8的區域,點的數量比a大幅減少,而pH 6~pH 7分子量為66 KD左右的蛋白質得到了很好的分離,但pH<4和pH>8的蛋白質點沒有得到分離,聚集在一起;c膠圖清晰圓潤的蛋白質點分布在整張圖上,且在 a圖中處于 pH 6~pH 7分子量為66 KD左右沒有分離的蛋白質得到了很好的分離,整張圖的蛋白質點數量明顯高于前兩張膠圖。所以,pH 4-7的IPG膠條更適合 TCA/丙酮法提取的煙葉總蛋白質雙向電泳分離。
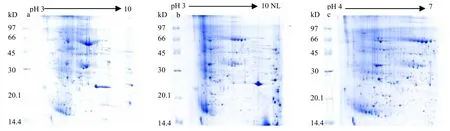
圖2 用3種pH膠條獲得的雙向電泳圖譜Fig.2 2-DE gel patterns with three immobilized pH gradient strip
2.3 小黃金1025苗期葉片蛋白質樣品不同上樣量的比較
分別稱取0.8、1.2、1.5、2.0 mg的小黃金1025總蛋白質干粉,選用pH 4-7的IPG膠條,4種蛋白質上樣量都獲得清晰的雙向凝膠電泳圖譜,經圖像掃描和比對分析,結果表明:在實驗條件一致的情況下,蛋白質上樣量不同導致凝膠圖譜上檢測出的蛋白質點數量有差異。4種不同上樣量檢測出的蛋白質點數量依次為:153、191、228、236個(圖3中a、b、c、d)。隨著蛋白質上樣量的增加檢測出的低豐度蛋白質數量也在增加,但是高豐度蛋白質的蛋白質點易發生重疊,所以在此實驗條件下,1.5 mg的總蛋白質上樣量適合蛋白質雙向電泳分離。
3 討 論
蛋白質組研究的開展不僅是生命科學研究進入后基因組時代的里程碑,也是后基因組時代生命科學研究的核心內容之一。中國煙草基因組計劃重大專項的實施,栽培煙草的兩個祖先種——絨毛狀煙草和林煙草全基因組序列圖譜的完成,成為煙草科學發展的一個重要里程碑,標志著煙草研究從此全面進入基因組時代。蛋白質組學技術將為研究煙草功能基因搭建一個良好平臺,可以為煙草基因組計劃重大專項的基因表達譜研究和分析提供良好的技術支撐。
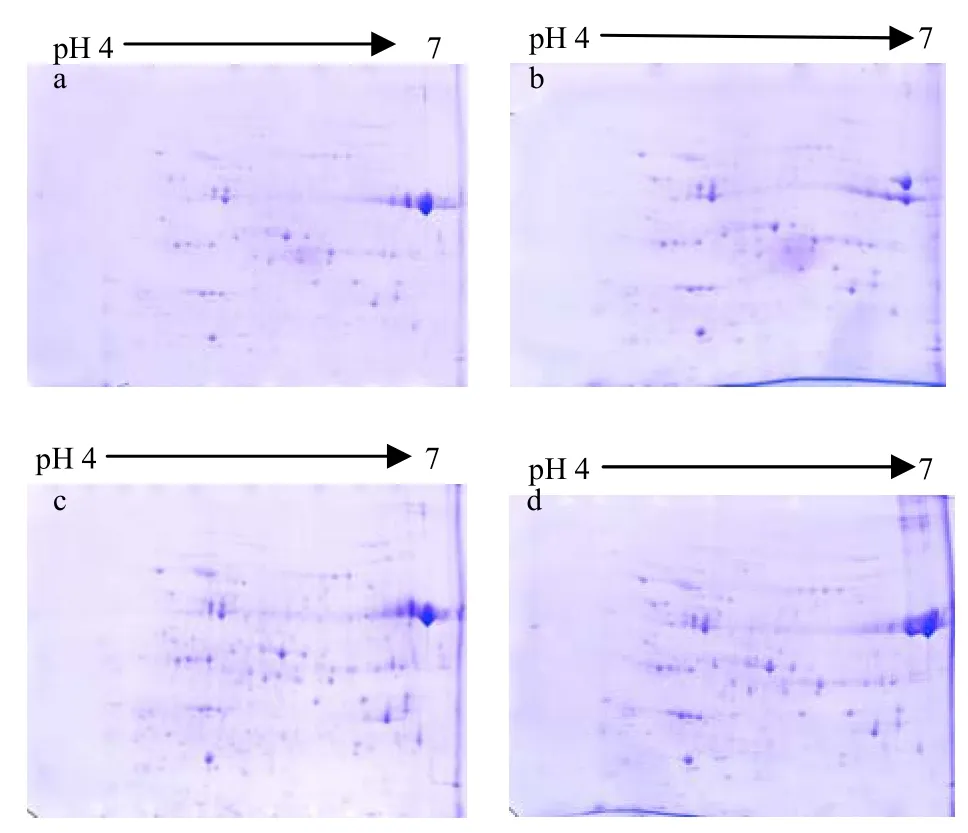
圖3 不同蛋白質上樣量的雙向凝膠電泳圖譜Fig.3 2-DE gel patterns with different protein quantities
目前,國內外煙草行業的蛋白質組學研究尚屬探索階段。煙草葉片中色素、酚類和醌等次生代謝物含量較高,在蛋白質樣品提取過程中去除不凈將影響雙向電泳圖譜的效果,因此蛋白質樣品制備成為雙向電泳是否成功的限制因素。通過本研究,旺長后期的煙草葉片蛋白質樣品用TCA-丙酮法提取,預冷丙酮沉淀兩次,選用Bio-Rad pH 4-7的17 cm IPG預制膠條,用Multiphor Ⅱ進行等電聚焦,上樣杯上樣,上樣量為1 mg,上樣體積為170 μL,可以得到重復性較好,蛋白質點清晰的雙向電泳圖譜;在此基礎上苗期煙草葉片總蛋白質樣品由蛋白質分級提取、酚抽提及丙酮洗滌相結合的方法獲得,選用Amersham Phamacia Bintech公司的24 cm pH 4-7線性IPG膠條,上樣量1.5 mg,上樣體積450 μL,水化盤過夜(12 h以上)水化上樣,同樣可得到重復性好,背景干凈,蛋白質點清晰的雙向電泳圖譜。
蛋白質樣品制備提取的方法很多,同一種提取方法對不同物種不同器官或組織的蛋白質樣品提取效果不同,不同的實驗室應針對自身的實驗需求及研究材料的特殊性,參考文獻中的方法通過大量試驗摸索雙向電泳最適合的條件[36-37]。本研究對煙草葉片蛋白質的提取僅嘗試了文獻中的兩種方法,并參考了文獻中的雙向電泳程序,下一步可以對煙草葉片嘗試其它蛋白質提取方法,并嘗試對雙向電泳程序在原有實驗的基礎上做進一步的優化,以建立起煙草葉片蛋白質組學研究的最佳實驗條件。
[1]Swinbanks D.Government backs proteome proposal[J].Nature, 1995, 378: 653.
[2]Wasinger V C, Cordwell S J, Cerpa-Poljak A, et al.Progress with gene-product mapping of the Mollicutes:Mycoplasma genitalium[J].Electrophoresis, 1995,16(7): 1090-1094.
[3]O’Farrell P H.High resolution two-dimensional electrophoresis of proteins[J].J Biol Chem., 1975, 250:4007-4021.
[4]Wildgruber R, Harder A, Obemater C.Towards high resolution: two-dimensional electrophoresis of saccharomyces cerevisiae proteins using overlapping narrow immobilized pH gradients[J].Electrophoresis,2000, 21: 2610-2616.
[5]G?rg A, Obermaier C, Boguth G, et al.The current state of two-dimensional electrophoresis with immobilized pH gradients[J].Electrophoresis, 2000, 21: 1037-1053.
[6]Chen Rong-Zhi, Weng Qing-Mei, Huang Zhen, et al.Analysis of resistance-related proteins in rice against brown planthopper by two-dimensional electrophoresis[J].Acta Botanica Sinica, 2002, 44(4):427-432.
[7]Huber L A.Is proteomics heading in the wrong direction?[J].Nature Reviews Molecular Cell Biology,2003, 4(1): 74-80.
[8]Rutschow H, Ytterberg A J, Friso G, et al.Quantitative proteomics of a chloroplast SRP54 sorting mutant and its genetic interactions with CLPC1 in Arabidopsis[J].Plant Physiol., 2008, 148: 156-175.
[9]Kim S T, Kim S G, Kang Y H, et al.Proteomics analysis of rice lesion mimic mutant (sp/1) reveals tightly localized probenazoleinduced protein (PBZ1) in cells undergoing programmed cell death[J].J Proteome Res., 2008, 7: 1750-1760.
[10]Cui S, Huang F, Wang J, et al.A proteomic analysis of cold stress responses in rice seedlings[J].Proteomics,2005, 5(12): 3162-3172.
[11]Natarajan S, Xu C, Caperna T J, et al.Comparison of protein solubilization methods suitable for proteomic analysis of soybean seed proteins[J].Anal Biochem.,2005, 342: 214-220.
[12]曾維英,楊守萍,蓋鈞鎰,等.大豆質核互作雄性不育系NJ CMS1A及其保持系的花藥差異蛋白質組學研究[J].中國農業科學,2007,40(12):2679-2687.
[13]Hajheidari M, Eivazi A, Buchanan BB, et al.Proteomics uncovers a role for redox in drought tolerance in wheat[J].J Proteome Res., 2007, 6(4): 1451-1460.
[14]陳蕊紅,葉景秀,張改生,等.小麥質核互作型雄性不育系及其保持系花藥差異蛋白質組學分析[J].生物化學與生物物理進展,2009,36(4):431-440.
[15]Chang W W, Huang L, Shen M, et al.Patterns of protein synthesis and tolerance of anoxia in root tips of maize seedlings acclimated to a low-oxygen environment,and identification of proteins by mass spectrometry[J].Plant Physiol., 2000, 122(2): 295-318.
[16]許珂,曹墨菊,朱英國,等.玉米C型細胞質雄性不育系 C48-2及其保持系線粒體差異蛋白分析[J].作物學報,2008,34(2):232-237.
[17]Duby G, Degand H, Faber A M, et al.The proteome complement of Nicotiana tabacum Bright-Yellow-2 culture cells[J].Proteomics, 2010, 10, 2545-2550.
[18]Goulet C, Goulet C, Goulet M C, et al.2-DE proteome maps for the leaf apoplast of Nicotiana benthamiana[J].Proteomics, 2010, 10, 2536-2544.
[19]Pineda M, Sajnani C, Baro′n M.Changes induced by the Pepper mild mottle tobamovirus on the chloroplastproteome of Nicotiana benthamiana[J].Photosynth Res., 2010, 103: 31-45.
[20]Razavizadeh R, Ehsanpour A A, Ahsan N, et al.Proteome analysis of tobacco leaves under salt stress[J].Peptides, 2009, 30: 1651-1659.
[21]Kaida R, Serada S, Norioka N, et al.Potential role for purple acid phosphatase in the dephosphorylation of wall proteins in tobacco cell[J].Plant Physiology, 2010,153(7): 603-610.
[22]Chivasa S, Simon W J, Murphy A M, et al.The effects of extracellular adenosine 5′-triphosphate on the tobacco proteome[J].Proteomics, 2010, 10: 235-244.
[23]Millar D J, Whitelegge J P, Bindschedler LV, et al.The cell wall and secretory proteome of a tobacco cell line synthesising secondary wall[J].Proteomics, 2009, 9:2355-2372.
[24]賈興華,王元英,佟道儒,等.烤煙新品種中煙100(CF965)的選育及其應用評價[J].中國煙草學報,2006,12(2):20-25.
[25]馬新蕾,房燕,王玉軍,等.十個烤煙品種的抗旱性鑒定[J].中國煙草學報,2005,11(5):26-30.
[26]中華人民共和國國家質量監督檢驗檢疫總局,中國國家標準化管理委員會.GB/T 23224—2008煙草品種抗病性鑒定[S].北京:中國標準出版社,2009.
[27]Damerval C, de Vienne D, Zivy M, et al.Technical improvements in two-dimensional electrophoresis increase the level of genetic variation detected in wheat-seeding proteins[J].Eletrophoresis, 1986, 7:52-54.
[28]Tsugita A, Kamo M, Kawakami T, et al.Two-dimensional electrophoresis of plant proteins and standardization of gel patterns[J].Eletrophoresis, 1996,17(5): 855-865.
[29]Giavalisco P, Nordhoff E, Lehrach H, et al.Extraction of proteins from plant tissues for two-dimensional electrophoresis analysis[J].Electrophoresis, 2003, 24:207-216.
[30]Bradford M M.A rapid and sensitive method for the quantitation of icrogram quantities of protein utilizing the principle of protein-dye binding[J].Anal Biochem.,1976, 72: 248-254.
[31]Hurkman W J, Tanaka C K.Solubilization of plant membrane proteins for analysis by two-dimensional gel electrophoresis[J].Plant Physiol., 1986, 81:802-806.
[32]Neuhoff V, Arold N, Taube D, et al.Improved staining of proteins in polyacrylamide gels including isoelectric focusing gels with clear background at nanogram sensitivity using Coomassie brilliant blue G-250 and R-250[J].Electrophoresis, 1988, 9: 255-262.
[33]Huang F, Parmryd I, Nilsson F, et al.Proteomics of Synechocystis sp.strain PCC 6803: identification of plasma membrane proteins[J].Mol Cell Proteomics,2002, 1(12): 956-966.
[34]Peterson G L.A simplification of the protein assay method of Lowry et al.which is more generally applicable[J].Anal Biochem., 1977, 83, 346-356.
[35]Laemmli U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature,1970, 227: 680-685.
[36]劉靜,潘映紅,徐琴,等.小麥葉片蛋白質組的2D-LC分離及Nano LC-MS/ MS分析[J].中國農業科學,2009,42(3):772-780.
[37]王明娟,季孔庶.珍珠黃楊葉片的蛋白質提取方法探討[J].基因組學與應用生物學,2009,28(1):105-108.

