海洋環境二氧化碳水合物生成的實驗研究①
肖 晨,劉 妮,陳偉軍,劉道平
(上海理工大學制冷技術研究所,上海 200093)
·工藝與設備·
海洋環境二氧化碳水合物生成的實驗研究①
肖 晨,劉 妮,陳偉軍,劉道平
(上海理工大學制冷技術研究所,上海 200093)
溫室氣體CO2的海洋封存是CO2處理的重要設想,對減緩全球氣候變化有著深遠的意義。CO2水合物在海洋環境中與在純水溶液中的生成條件有很大的不同。為了研究海洋環境中CO2水合物的生成特性,設計了一套CO2氣體水合物實驗裝置和一套實驗流程,利用這套實驗裝置模擬海洋深度500 m處海水環境,在海水—CO2體系中合成CO2水合物,探討了溫度、壓力和鹽度等對海洋環境中CO2水合物生成特性的影響。
CO2;水合物;海洋環境;鹽度
研究表明,近50年來的氣候變暖主要是人類使用化石燃料而排放大量的CO2等溫室氣體的增溫效應造成的。為了減緩全球氣候變化,1977年,MARCHETTI提出了CO2海洋封存設想,即將主要的化石能源消耗工廠 (主要是大型火電廠)排放的CO2收集起來,以不同形式 (氣體、液體、固體或水合物)傾廢到深海,讓其在高壓低溫條件下自動形成穩定的固體冰狀水合物,實現長期隔離地球化學循環,減少大氣CO2的積累,減低其在大氣中濃度常年增長的趨勢[1]。對海洋環境下CO2水合物基礎物性研究,尤其是海洋環境CO2水合物實驗室模擬研究非常必要。當今發達國家例如日本、美國、挪威、加拿大等已相繼開展海洋環境CO2水合物的研究工作,并已舉辦過多次國際研討會[2-3]。
國外對海洋環境CO2水合物的研究主要集中在以下幾個方面:CO2水合物作為影響CO2在深海中溶解擴散的過渡媒介[4];CO2在深海沉積層中的永久儲藏[5];深海 CO2水合物的形成與分解[6-7];二氧化碳深海傾廢的環境效應等[8-9]。目前國內對CO2水合物的研究包括:CO2水合物的生成與分解動力學[10-11]、CO2水合物生成特性及強化方法[12-16]、水合物法分離CO2技術[17]、CO2置換天然氣水合物[18]等方面,而對海洋環境CO2水合物的研究鮮見報道。
海洋表層環境是多變的,受到氣象條件、海流、地形等的影響,而深海中海水的性質變化很小。海水溫度隨深度增加而遞減,深度3000 m以下水溫幾乎不變。海水中含有豐富的鹽類物質,主要是氯化鈉和氯化鎂,鹽度變化范圍1%~4.1%,世界大洋的平均鹽度約為3.5%。目前海洋水合物實地研究難度很大,成本較高,因此我們想通過實驗室模擬手段模擬海水環境生成CO2水合物。實驗參照500 m左右深處的海水環境,選取實驗壓力為5 MPa,實驗溫度變化范圍為4~10℃,初始鹽度為平均鹽度3.5%。
本文設計了一套實驗裝置和相應的實驗流程,通過實驗模擬并研究了各種海洋環境,包括溫度、壓力、鹽度等對CO2水合物生成特性的影響,測定了鹽度3.5%海水中CO2水合物的相平衡條件。
1 實驗裝置和儀器
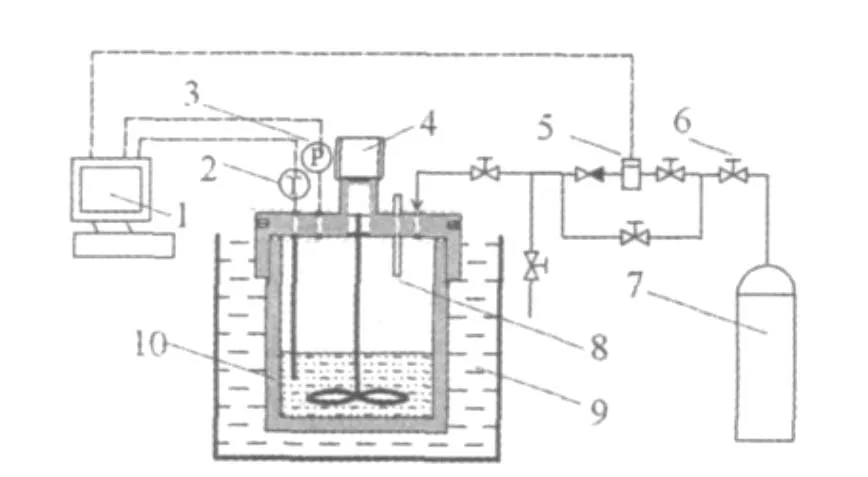
圖1 實驗裝置示意圖Fig.1 Experimental apparatus
本實驗裝置主要由供氣系統、高壓反應釜、恒溫水浴系統、數據采集系統及氣體管路等構成(如圖1)。高壓反應釜由不銹鋼加工而成,容積680 mL,最大工作壓力20 MPa;反應釜采用了磁力耦合式驅動裝置,釜內攪拌器的轉速由直流調速電機控制,轉速在0~1000 r/min內可調;反應釜內的溫度由鉑電阻溫度傳感器測量,精度為A級;壓力由擴散硅式壓力傳感器測量,量程為0~10 MPa,精度為0.3%;恒溫水浴系統包括2臺低溫精密恒溫槽,控制反應釜溫度,控溫范圍為-20~100℃,精度為±0.05℃;所用采集儀為Aglient 34970A型數據采集儀。本實驗選用美國優特公司生產的SALT6型鹽度計,量程:0.1% ~5%,分辨率:0.01%,精度: ±1%,溫度量程: -10.0~110.0℃。
實驗過程中涉及的主要材料:純度99.9%的CO2氣體、一次性蒸餾水、海水鹽、NaCl含量≥99.5%的氯化鈉分析純AR。
2 實驗過程
實驗均是在恒容條件下進行的,實驗用水為以蒸餾水和海水鹽配制的3.5%鹽度的人工海水,用水量為200 mL,全過程攪拌。實驗操作流程為: (1)用蒸餾水清洗反應釜2~3次并擦拭干凈,加入200 mL蒸餾水或配制好的鹽溶液,擰緊釜蓋; (2)將溫度傳感器、壓力傳感器和攪拌裝置正確安裝在反應釜上并連接到數據采集儀; (3)將反應釜置入設定溫度為20℃的恒溫水浴中,用真空泵將反應釜及管路抽真空,然后充入CO2氣體至0.5 MPa,放氣置換,重復兩次,對反應釜進行吹掃并檢查氣密性; (4)打開供氣系統閥門,緩慢地向反應釜內充入氣體,同時開啟磁力攪拌裝置(200 r/min),直至反應釜溫度穩定在20℃且釜內壓力恒定在設定壓力,關閉供氣閥門; (5)將反應釜迅速放入另一已達到反應設定溫度的恒溫水浴中,開始水合物的生成反應并記錄數據; (6)反應結束后保存數據,放掉反應釜內剩余氣體,打開反應釜進行相應處理。
3 結果和討論
3.1 溫度對CO2水合物生成的影響
圖2所示為實驗用水為初始鹽度3.5%的人工海水,初始壓力5 MPa,反應溫度分別為5、6、7和8℃下二氧化碳水合物生成過程中的壓力及溫度隨時間變化曲線。
圖2中,F、E、C三組實驗分別在22、34、147 min時刻出現溫度突升、壓力突升的現象,表明水合物的快速生成,而實驗R在反應過程中卻無此現象,且隨著設定溫度的升高,反應結束時系統的終了壓力依次升高,出現溫度突升現象的時間(誘導時間)越遲。圖2(a)中,F、E、C三組實驗均出現壓力突升現象,這是因為初始壓力為5 MPa,降溫時部分CO2氣體發生液化,當CO2分子開始快速生成水合物時,同時放出大量反應熱,溫度突升,導致液態CO2吸熱汽化,壓力也突升。實驗E在第130 min時刻出現明顯的第二次溫度上升現象,是由于液化的CO2已全部汽化和溶解于水中,之前的氣態CO2、液態CO2、水和水合物四相熱平衡狀態被打破,水合物反應熱釋放速率大于恒溫槽吸熱速率,溫度緩慢上升,氣態CO2的消耗沒有了補充,壓力持續下降。實驗C的此轉變過程不明顯是因為溫度過高,液化CO2的量較少,實驗F的轉變過程在22~28 min內,由于水合物生成速度很快,所以轉變過程時間很短。圖2表明,系統反應溫度越低,水合物成核和晶體增長的驅動力就越大,水合物成核的誘導時間就越短,晶核的增長速度也就越快,水合物開始生成需求的壓力越低,水合物生成速率越大,反應過程中消耗的CO2氣體越多,水合物的終了壓力越低。

圖2 溫度對CO2水合物生成的影響Fig.2 Effect of temperature on hydrate formation
實驗R未出現壓力曲線突變現象,這是由于在8℃條件下,實驗終了壓力4.24 MPa低于此海水環境下的CO2水合物的理論相平衡壓力,水合物生成的驅動力不夠,使得反應不能進行。
3.2 壓力對CO2水合物生成的影響
圖3所示為實驗用水為初始鹽度3.5%的人工海水,反應溫度7℃,初始壓力分別為4、4.5、5、5.25和5.5 MPa下水合物生成過程中的壓力及溫度隨時間變化曲線。
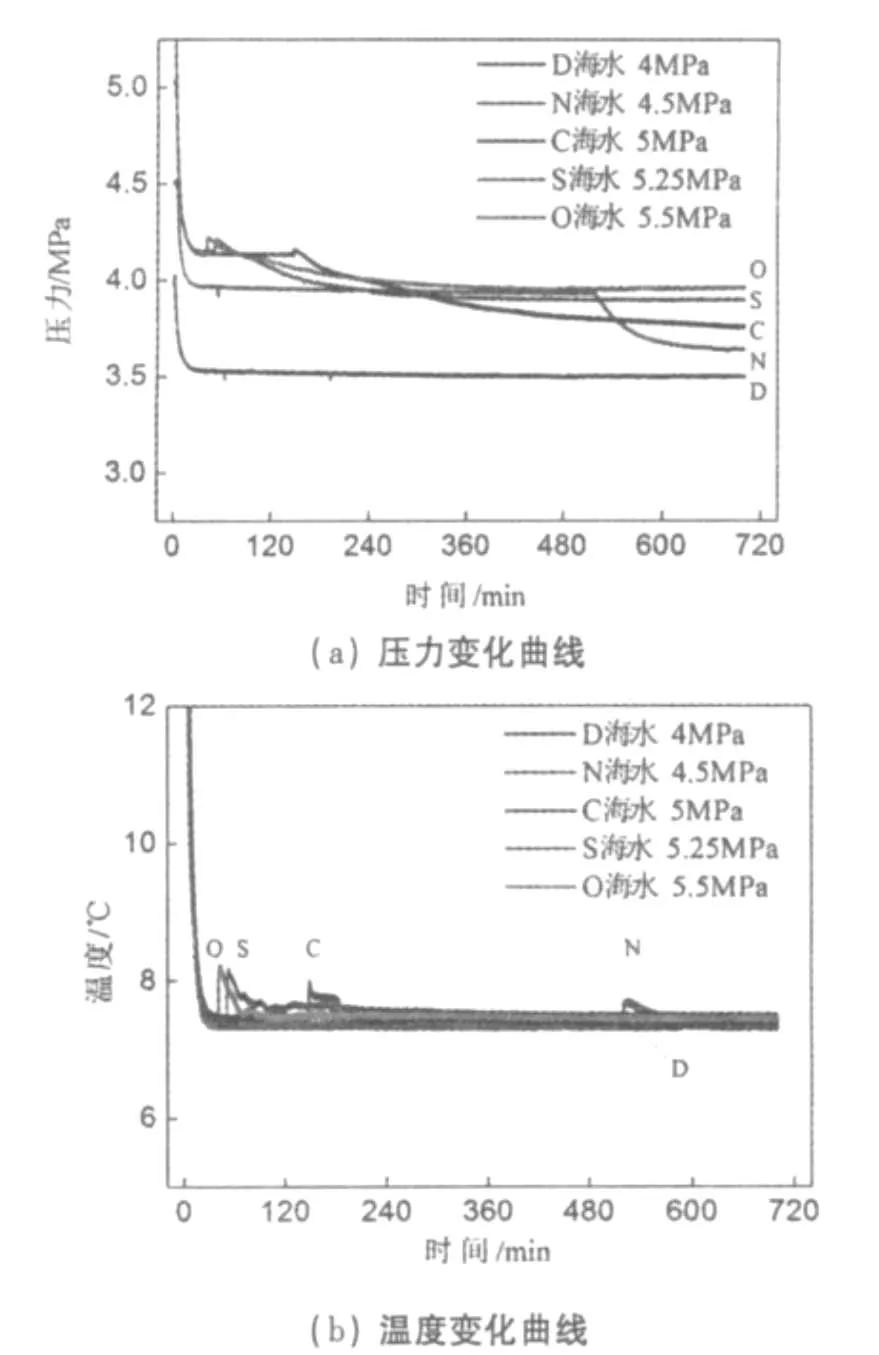
圖3 壓力對CO2水合物生成的影響Fig.3 Effect of pressure on hydrate formation
圖3中,實驗O、S、C和N的誘導時間分別為38、51、147和520 min。其中實驗O、S和C有部分CO2氣體發生液化,開始生成水合物時刻的壓力相同,均為4.17 MPa(7℃下CO2的臨界壓力),溫度、鹽度也相同,而誘導時間卻相差很多,原因在于初始壓力越高,液化的CO2量越多,而液態CO2的溶解度和擴散系數比氣態 CO2的大[19],有利于水合物晶核的形成,導致誘導時間變短;與O、S和C這三組實驗中曲線突變時溫度突升、壓力也突升的現象所不同的是,實驗N開始生成水合物時的壓力為3.98 MPa,低于7℃下CO2的臨界壓力,CO2未液化,溫度突升,壓力卻是突降的。由圖3(b)可以看出,實驗O、S和C溫度突升的幅度Δt分別為0.86、0.8、0.5℃,由于水合物的生成是一個放熱反應,且曲線突變前溫度相同,因此可以從Δt的大小直觀地看出水合物生成的量是依次遞減的。實驗D在整個過程中始終沒有出現溫度壓力曲線突變,此現象說明反應溫度為7℃,初始壓力4 MPa的條件下沒有水合物生成。
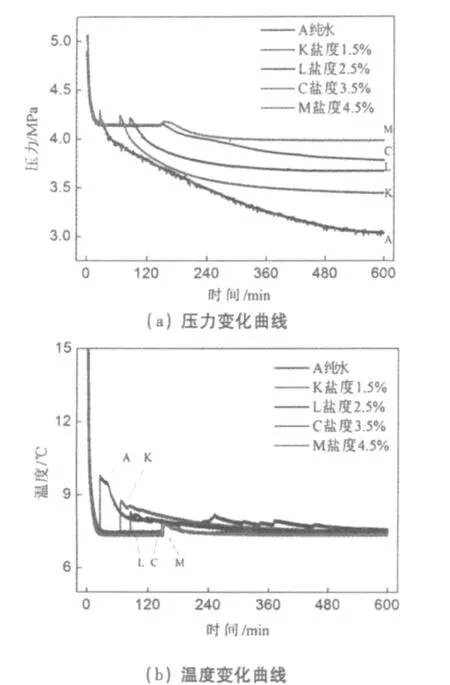
圖4 鹽度對CO2水合物生成的影響Fig.4 Effect of salinity on hydrate formation
實驗證明,一定溫度下初始壓力越大,CO2的溶解度越高,過飽和度越大,水合物生成的驅動力就越大,形成的水合物量也越多。在有液態CO2存在的水合物反應中,由于液態CO2的溶解度和擴散系數比氣態CO2的大,更有利于CO2水合物晶核的形成,縮短了誘導時間。此外,CO2水合物在相同溫度下的理論相平衡壓力是相同的,實驗反應終了壓力應當相同,而實驗O、S、C和N的反應結束終了壓力卻是依次降低的,這是因為水合物生成的量越多,消耗的水的量越多,剩余水的鹽度越高,導致CO2水合物的相平衡壓力越高 (參考本文3.3節),所以會有反應終了壓力依次降低的現象。
3.3 鹽度對CO2水合物生成的影響
鹽度是海水中含鹽量的標度。海水鹽度的定義為:“1千克海水中的溴和碘全部被當量的氯置換,而且所有的碳酸鹽都轉換成氧化物之后,其所含的無機鹽的克數。圖4所示為實驗初始壓力5 MPa,反應溫度7℃,實驗用水分別為純水、初始鹽度1.5%、2.5%、3.5%和4.5%的人工海水條件下二氧化碳水合物生成過程中的壓力及溫度隨時間變化曲線。由圖4可以看出,A、K、L、C和M五組實驗分別在25、66、85、146和150 min時刻出現壓力突升、溫度突升的現象,水合物成核的誘導時間越來越長,且圖4(b)顯示溫度升高的幅度Δt隨著初始鹽度的增加而減小,說明反應的劇烈程度依次減小,水合物生成速率依次減慢,水合物生成的量依次減小。這是基于海水中含有的 NaCl、MgCl2等鹽類物質屬于離子型化合物,而在離子型化合物溶解生成水合離子的過程中,由于離子電荷強電場作用對水分子產生一種相互作用力,破壞了水的簇團結構,這使得水分子形成晶格需要克服該作用力。因此,此時需要一定的額外能量才能滿足水合物生成的相平衡條件。
為了具體說明鹽度對CO2水合物生成的影響,隨后進行了一組CO2水合物相平衡實驗,運用圖形法[20]測定了CO2水合物在3.5%鹽度海水的相平衡。
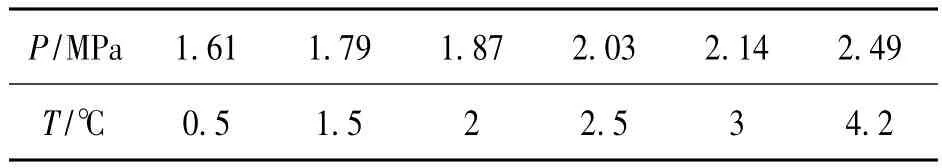
表1 實驗測得CO2水合物相平衡數據Table 1 Experimental data of CO2 hydrate phase equilibrium
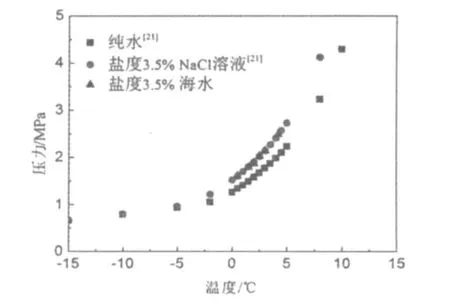
圖5 CO2水合物的相平衡圖Fig.5 Phase equilibrium diagram of CO2 hydrate
表1為實驗測得的鹽度3.5%海水中CO2水合物的相平衡數據,圖5為鹽度3.5%海水的實驗數據與Sloan[21]的純水和鹽度3.5%NaCl溶液數據的對比圖。結果發現本文測定的鹽度3.5%海水中CO2水合物的相平衡數據與 Sloan的鹽度3.5% NaCl溶液中的數據十分接近,說明海水中含有的除Na+之外的少量Mg2+,K+,Ca2+等離子對CO2水合物的額外影響很小;與純水相比,鹽度3.5%的海水提高了CO2水合物的相平衡壓力,抑制了CO2水合物的生成。
實驗表明,鹽類物質對CO2水合物的生成有抑制作用,并且當體系中的鹽度越高時,誘導時間越長,CO2水合物的相平衡壓力越高,抑制作用就越強;海水中除Na+之外的K+,Ca2+,Mg2+等離子含量很少,對CO2水合物的生成造成的額外影響極小,可與Na+合并計入鹽度一起考慮。
4 結 論
本文根據CO2海洋封存的設想,設計了一套實驗裝置和相應的實驗流程,通過實驗室實驗模擬深海環境,包括溫度、壓力、鹽度等環境條件,研究了密閉系統海洋環境中CO2水合物的生成反應特性。結果發現溫度越低、壓力越高,水合物生成的誘導時間越短,反應速率越快,生成水合物的量越多;在有液態CO2存在的水合物反應中,由于液態CO2的溶解度和擴散系數比氣態CO2的大,更有利于CO2水合物晶核的形成,縮短了誘導時間;鹽度對CO2水合物的生成有抑制作用,并且當體系中的鹽度越高,誘導時間就越長,CO2水合物的相平衡壓力越高,抑制作用就越強。
[1]MARCHETTIC.On geoengineering the CO2problem[J].Climatic Change,1977(1):59-68.
[2]MITSUKAWA H.International symposium on ocean disposal of carbon dioxide[J].Waste Management,1997 (17):275.
[3]TSUNOGAIS,WONG C S.Second international symposium on carbon dioxide in the oceans,Tsukuba,Japan (January 1999)[J].Mar Chem,2000(72):79-81.
[4]GOLOMB D S,ZEMBA SG.The fate of CO2sequestered in the deep ocean[J].Energy Conversion and Management,1992,33(5-8):675-683.
[5]KOMAI T.Formation and dissociation kinetics of gas hydrates inmarine sediments[R].Proc of ICGH5,Trondheim,Norway,2006.
[6]BREWER P G,FRIEDERICH G,PELTZER E T,et al.Direct experiments on the ocean disposal of fossil fuel CO2[J].Science,1999(284):943-945.
[7]GABITTO J,TSOURISC.Dissolution mechanisms of CO2hydrate droplets in deep seawaters[J].Energy Conversion and Management,2006,47(5):494-508.
[8]HUESEMANN M H,SKILLMAN A,GRECELIUS E A.The inhibition ofmarine nitrification by ocean disposal CO2[J].Marine Pollution Bulletin,2002,44(2):142-148.
[9]TAMBURRIM N,PELTZER E T,FRIEDERICH G et al.A field study of effects of CO2ocean disposal on mobile deep-sea animals[J].Marine Chemistry,2000,72(2-4):95-101.
[10]孫長宇,馬昌鋒,等.二氧化碳水合物分解動力學研究[J].石油大學學報,2001,25(3):8-10.
[11]馬昌鋒,陳光進,郭天民.水中懸浮氣泡法研究水合物生長動力學 [J].中國科學,2002,32(1):90-96.
[12]劉妮,王亮.二氧化碳水合物儲氣特性的實驗研究[J].環境工程學報,2010,4(3):621-624.
[13]劉妮,李菊,等.機械強化制備二氧化碳水合物的特性研究[J].中國電機工程學報,2011,31(2):51-54.
[14]劉妮,軒小波.溫度擾動促進CO2水合物生成特性的實驗研究[J].中國電機工程學報,2010,30(17): 41-44.
[15]劉妮,張國昌,等.添加劑對CO2水合物生成的影響[J].天然氣化工,2008,28(12):104-107.
[16]軒小波,劉妮,等.影響二氧化碳水合物生成特性的實驗研究[J].天然氣化工,2011,36(2):10-13.
[17]余康.水合物法分離煙氣中二氧化碳的實驗研究[J].化學工程與裝備,2010(11):3-5.
[18]李遵照,郭緒強,等.CO2置換CH4水合物CH4的實驗和動力學[J].化工學報,2007,58(5):1197-1203.
[19]TENG H,MASUTANISM,etal.Solubility of CO2in the ocean and its effect on CO2dissolution[J].Energy Conversion and Management,1996,37(6-8):1029-1038.
[20]孫志高,石磊,等.氣體水合物相平衡測定方法研究[J].石油與天然氣化工,2001,30(4):164-166.
[21]SLOAN E D.Clathrate Hydrates of Natural Gases[M].New York:Marcel Dekker,Inc,1997.
Experiments on The Formation of CO2Hydrate Under Simulating Marine Environment
XIAO Chen,LIU Ni,CHENWeijun,LIU Daoping
(Institute of Refrigeration Technology,University of Shanghai for Science and Technology,Shanghai200093,China)
It is significant for ocean storage of CO2to reduce or eliminate CO2emission from large power plants and major industrial processes.There aremany differences of CO2hydrate formation under the condition of pure water or ocean environment.To study the promoting and inhibiting factors on CO2hydrates formation in seawater,an experimental instrument is designed to simulate the CO2hydrate formation under themarine environmentof the depth of500m.With the experimental data,factors affecting the experimental results,including temperature,pressure and salinity,are in turn discussed.
carbon dioxide;hydrate;marine environment;salinity
P744.4
B
1007-7804(2012)01-0013-05
10.3969/j.issn.1007-7804.2012.01.001
2011-12-06
國家自然科學基金資助項目(50706028);上海市教育委員會科研創新項目資助(12YZ106);上海市重點學科建設項目(S30503)
肖 晨 (1986),男,碩士,制冷及低溫工程,研究方向:氣體水合物蓄冷、儲能技術。

