胃安顆粒微生物限度檢查方法的驗證*
鄭兆銀,陳延晶,賀 蕾
(天津市靜海縣藥品檢驗所,天津 301600)
實驗研究
胃安顆粒微生物限度檢查方法的驗證*
鄭兆銀,陳延晶,賀 蕾
(天津市靜海縣藥品檢驗所,天津 301600)
目的:建立胃安顆粒微生物限度檢查方法。方法:按《中國藥典》2010年版一部附錄微生物限度檢查法及應用指導原則[1],考察確定胃安顆粒微生物限度的檢查方法。用常規法進行預試驗,初步考察該樣品對試驗菌檢測的影響,根據結果,用培養基稀釋法進行再試驗。結果:常規法試驗,大腸埃希菌、白色念珠菌、黑曲霉的回收率均大于70%,而金黃色葡萄球菌、枯草芽孢桿菌的回收率均小于70%,控制菌檢查采用常規法。采用培養基稀釋法試驗時,可以有效消除抑菌作用,使金黃色葡萄球菌、枯草芽孢桿菌的回收率大于70%。結論:采用培養基稀釋法可以有效消除抑菌作用,簡便、準確。
微生物限度檢查,驗證試驗,培養基稀釋法
胃安顆粒是一復方中成藥制劑,由丹參、馬鞭草、蠶砂、石斛、太子參、白術、連翹、豆蔻、砂仁、蜂房、甘松、梅花和拳參組成,臨床上健脾益胃、化瘀行滯,用于萎縮性胃炎或不典型增生及殘胃炎。《中國藥典》2010年版規定[1],在進行藥品微生物限度檢查時,應對所用方法進行驗證,以確認所采用的方法適合于該藥品的微生物限度檢查。
1 試驗材料與儀器
1.1 樣品 胃安顆粒(某醫院制劑;批號20110916;規格:5 gx10袋/盒)。
1.2 儀器 GZX-9240MBE型數顯鼓風干燥箱(上海博迅實業有限公司醫療設備廠)、DHP-9162型電熱恒溫培養箱(上海一恒科技有限公司)、MJ-250BS-II型霉菌培養箱(上海新苗醫療器械制造有限公司)、SPX-250B生化培養箱(天津市華北實驗儀器有限公司)、RS-1型渦旋儀(北京昊諾斯科技有限公司)、LDZX-50FBS型蒸汽滅菌鍋(上海申安醫療器械廠)等。
1.3 菌種 金黃色葡萄球菌[CMCC(B)26003];大腸埃希菌[CMCC(B)44102];枯草芽孢桿菌;[CMCC(B)63501]白色念珠菌[CMCC(F)98001];黑曲霉[CMCC(F)98003];乙型副傷寒沙門菌[CMCC(B)50094]均來源于中國食品藥品檢定研究院。
1.4 培養基及稀釋劑 營養瓊脂培養基;玫瑰紅鈉瓊脂培養基;膽鹽乳糖培養基;營養肉湯培養基;改良馬丁培養基;pH 7.0無菌氯化鈉-蛋白胨緩沖液、0.9%無菌氯化鈉溶液、MUG培養基;膽鹽乳糖發酵培養基;四硫磺酸亮綠培養基;麥康凱瓊脂培養基;膽鹽硫乳瓊脂培養基;三糖鐵瓊脂培養基;改良馬丁瓊脂培養基。
2 驗證條件
無菌室環境潔凈度為100 00級,局部潔凈度為100級,凈化消毒30 min以上,供試品及滅菌的器具等經傳遞窗紫外殺菌燈照射30 min置無菌室內,試驗人員手消毒后穿無菌服進入操作間。
3 驗證試驗
3.1 試驗菌液的制備 取金黃色葡萄球菌、大腸埃希菌、枯草芽孢桿菌、乙型副傷寒沙門菌的新鮮培養物至營養肉湯培養基中,置30~35℃培養18~24 h;取白色念珠菌的新鮮培養物,接種至改良馬丁培養基中,23~28℃培養24~48 h,上述培養物用0.9%無菌氯化鈉溶液制成每1 ml含菌數約為50~100 cfu的菌懸液。取黑曲霉的新鮮斜面培養物至改良馬丁瓊脂斜面培養基,25℃培養5~7 d,加入3~5 ml含0.05%聚山梨酯80的0.9%無菌氯化鈉溶液溶液,將孢子洗下脫。然后采用適宜的方法吸出孢子懸液至無菌試管內,用含0.05%聚山梨酯80的0.9%無菌氯化鈉溶液制成每1 ml含孢子數50~100 cfu的孢子懸液。
3.2 供試品溶液的制備 稱取樣品10 g,加pH 7.0無菌氯化鈉-蛋白胨緩沖液至100 ml,振搖使分散均勻,制成1∶10的供試液。
3.3 細菌數、霉菌及酵母菌數計數方法的驗證
3.3.1 常規法 ①試驗組:分別吸取1∶10供試液1 ml和含菌數為50-100 cfu的試驗菌液1 ml置同一個無菌平皿中。②菌液組:吸取含菌數為50~100 cfu的試驗菌液1 ml置無菌平皿中。③供試品對照組:吸取1∶10供試液1 ml置無菌平皿中。每組平行制備2個平板,分別立即傾注不超過45℃的營養瓊脂培養基15~20 ml,在30~35℃培養48 h,或分別傾注不超過45℃的玫瑰紅鈉瓊脂培養基15~20 ml,在23~28℃培養72 h,點計菌落數,分別計算各試驗菌每次試驗的菌回收率。試驗組菌回收率計算:菌回收率(%)=(試驗組平均菌落數-供試品對照組平均菌落數)∕菌液組平均菌落數。結果見表1。
由表1可知,常規法3次試驗中,大腸埃希菌、白色念珠菌、黑曲霉在供試液中回收率均大于70%;金黃色葡萄球菌、枯草芽孢桿菌在供試液中回收率均小于70%。說明常規法適合于該品種的霉菌及酵母菌計數,但不適合于本品的細菌計數。根據上述情況,采用培養基稀釋法進行再試驗
3.3.2 培養基稀釋法 取1∶10供試液1 ml分別加入5個無菌平皿中(每皿0.2 ml),其他同于常規法。試驗組菌回收率計算:菌回收率(%)=(試驗組平均菌落數-供試品對照組平均菌落數)∕菌液組平均菌落數。結果見表2。
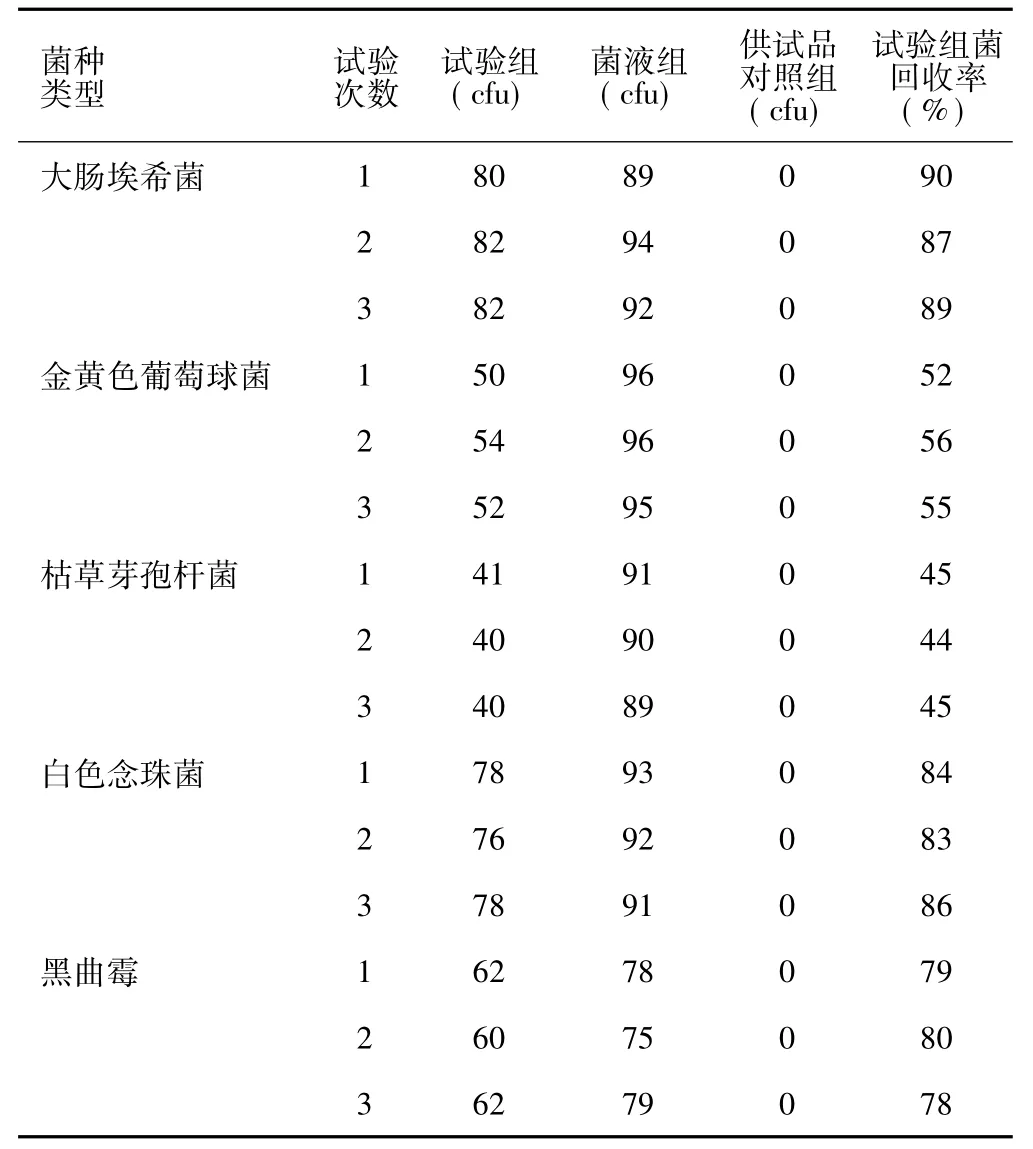
表1 常規法測定胃安顆粒的細菌數、霉菌及酵母菌數回收率結果
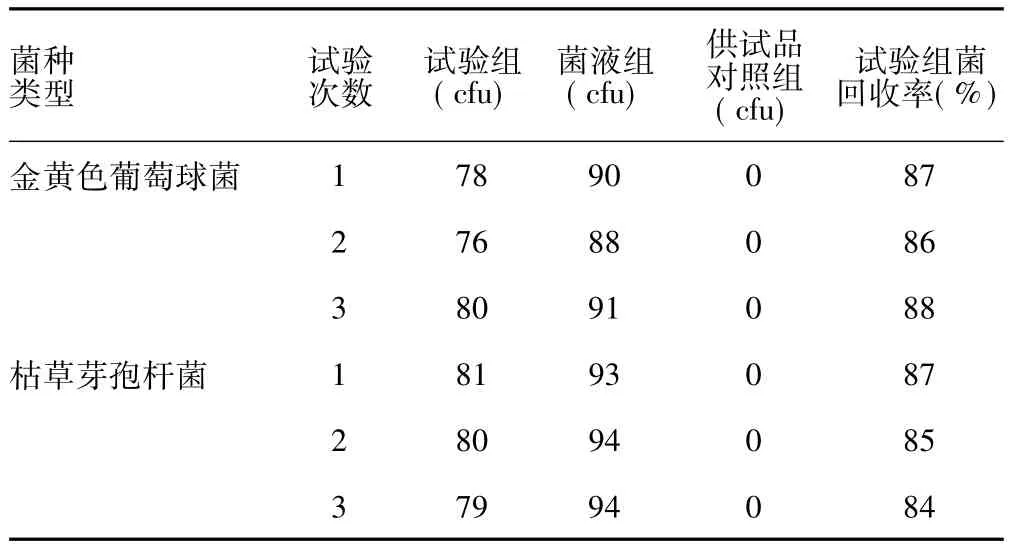
表2 培養基稀釋法測定胃安顆粒菌回收率結果
由表2可知,采用培養基稀釋法后,可消除供試液對金黃色葡萄球菌、枯草芽孢桿菌的抑菌作用,使菌回收率大于70%。說明培養基稀釋法(每皿0.2 ml)適合于該品種的菌落計數。
3.4 控制菌檢查方法的驗證
3.4.1 驗證方法
3.4.1.1 試驗組 取規定量1∶10供試液及含菌數為10~100 cfu試驗菌液1 ml加入增菌培養基中。
3.4.1.2 陰性菌對照組 取規定量供試液及含菌數為10~100 cfu金黃色葡萄球菌菌液1 ml加入增菌培養基中。
3.4.1.3 陽性對照組 取含菌數為10~100 cfu的試驗菌液1 ml加入增菌培養基中。
3.4.1.4 供試品對照組 取1∶10供試液,加入到增菌培養基中。
3.4.2 大腸埃希菌檢查方法的驗證 取1∶10供試液10 ml接種至100 ml膽鹽乳糖培養基,置30~35℃培養18~24 h。吸取上述培養物0.2 ml,接種至含5 ml MUG培養基的試管內,培養。于5和24 h在366 nm紫外線下觀察,同時用未接種的MUG培養基作本底對照。若管內培養物呈現熒光,為MUG陽性;不呈現熒光,為MUG陰性。觀察后,沿培養管的管壁加入數滴靛基質試液,液面呈玫瑰紅色,為靛基質陽性;呈試劑本色,為靛基質陰性。本底對照應為MUG陰性和靛基質陰性。如MUG陽性,靛基質陽性,判供試品檢出大腸埃希菌;如MUG陰性,靛基質陰性,判供試品未檢出大腸埃希菌。結果見表3。

表3 大腸埃希菌檢查方法驗證結果
由表3可知,陰性菌對照組未檢出大腸埃希菌,試驗組與陽性對照組均檢出大腸埃希菌,大腸埃希菌檢查可用常規法檢查。
3.4.3 大腸菌群檢查方法的驗證 取1∶10、1∶100和1∶1 000的供試液各1 ml分別加入含10 ml膽鹽乳糖發酵培養基的管中,30~35℃培養18~24 h。若不產氣產酸,判未檢出大腸菌群。若產氣產酸,將發酵管中的培養物分別劃線接種于麥康凱瓊脂培養基平板上,培養18~24 h。從分離平板上挑選4~5個疑似菌落,分別接種于乳糖發酵管中,培養24~48 h,若產氣產酸判檢出大腸菌群。結果見表4。

表4 大腸菌群檢查方法驗證結果
由表4可知,陰性菌對照組未檢出大腸菌群,試驗組與陽性對照組均檢出大腸菌群,大腸菌群檢查可用常規法檢查。
3.4.4 沙門菌檢查方法的驗證 取供試品10 g,接種至200 ml營養肉湯培養基中,振搖混合,30~35℃培養18~24 h。取上述培養物1 ml,接種于10 ml四硫磺酸鈉亮綠培養基中,培養18~24 h后,分別劃線接種于膽硫乳瓊脂培養基和麥康凱瓊脂培養基平板上,培養18~24 h,若平板上無菌落生長或無疑似菌落生長,判供試品未檢出沙門菌。否則,用接種針挑選2~3個疑似菌落分別于三糖鐵瓊脂培養基高層斜面上進行斜面和高層穿刺接種,培養18~24 h。斜面見紅色,底層見黃色,或斜面黃色、底層黑色判檢出沙門菌。結果見表5。

表5 沙門菌檢查方法驗證結果
由表5可知,陰性菌對照組未檢出沙門菌,試驗組與陽性對照組均檢出沙門菌,沙門菌檢查可用常規法檢查。
4 討論
采用常規法試驗時,該樣品對大腸埃希菌、白色念珠菌、黑曲霉的加菌回收率均大于70%,證明其對上述3種供試菌無抑菌作用。該樣品對金黃色葡萄球菌、枯草芽孢桿菌有抑菌作用,其加菌回收率小于70%,低于《中國藥典》2010年版規定的回收率不得低于70%才視為無抑菌作用的要求。結合該樣品的物理特性和常規法試驗結果,采用培養基稀釋法進行試驗后,金黃色葡萄球菌、枯草芽孢桿菌的加菌回收率可大于70%。故胃安顆粒的細菌數檢查可采用培養基稀釋法(0.2 ml),霉菌及酵母菌數的檢查采用常規法。
由控制菌檢查方法的驗證試驗結果表明,采用常規法試驗時,該樣品對大腸埃希菌、大腸菌群和沙門菌的檢查無干擾,故胃安顆粒的控制菌檢查可采用常規法。
1 中國藥典.一部.2010:附錄79,138
Weian granules in verification of microbial limit test method
Zheng Zhaoyin,Chen Yanjing,He Lei
(The Insititute for Drug Control of Jinghai,Tianjin 301600)
Objective:to establish microbial Weian granules limit inspection Methods.Methods:according to the China Pharmacopeia(2010 edition a microbial limits inspection and application appendix guiding principle),the investigation to determine the microbial limits stomach Ann particle inspection Methods.With conventional method on the test,a preliminary study samples of the experimental fungus effect on detecting,according to the results,with culture medium diluted method to test.Results:the normal method of test,escherichia coli,candida albicans,aspergillus are larger than the recovery rate of 70% ,and staphylococcus aureus and bacillus subtilis were less than the recovery rate of 70%,the conventional method check control bacteria.The culture medium diluted method test,can effectively eliminate the bacteriostatic action,make staphylococcus aureus,bacillus subtilis recovery rate of more than 70%.Conclusion:the culture medium diluted method can effectively eliminate the bacteriostatic action,is simple and accurate.
microbial limit inspection,validation test,culture medium diluted method
R927.11
A
1006-5687(2012)04-0001-03
2012-01-05

