信號肽編碼序列庫的構建及耐熱乳糖酶的分泌
夏 雨 弓紫豐 成玉梁 趙 瑩 孫 震
(江南大學食品學院,江蘇 無錫 214122)
信號肽編碼序列庫的構建及耐熱乳糖酶的分泌
夏 雨 弓紫豐 成玉梁 趙 瑩 孫 震
(江南大學食品學院,江蘇 無錫 214122)
為了實現來源于嗜熱脂肪芽孢桿菌的β-半乳糖苷酶在枯草芽孢桿菌中的分泌表達,建立一種較簡便的方法篩選能夠分泌該酶的信號肽,即針對11種信號肽構建信號肽編碼序列庫,采用隨機篩選方法得到合適的信號肽,構建相應的分泌表達載體和重組表達菌株。結果表明,通過信號肽隨機篩選方法獲得的枯草芽孢桿菌中性蛋白酶NprE信號肽能夠有效引導該酶的細胞外分泌,重組菌株搖瓶培養16h后,上清液中積累的耐熱β-半乳糖苷酶活力達到64.02U/mL,占該酶所表達的總酶活力的29.6%。該信號肽篩選方法可以為微生物蛋白質分泌過程中的信號肽快速選擇和優化提供參考。
β-半乳糖苷酶;枯草芽孢桿菌;蛋白質分泌;信號肽
β-半乳糖苷酶(EC 3.2.1.23)能催化乳糖水解生成葡萄糖和半乳糖,在食品工業中有重要應用。乳品工業中常采用β-半乳糖苷酶水解牛乳中乳糖,生產低乳糖牛乳以便解決“乳糖不耐癥”問題[1]。目前乳品工業中使用的β-半乳糖苷酶主要是來源于酵母或霉菌的中溫乳糖酶[2],最適反應溫度在40℃左右,在該溫度下進行牛乳中乳糖水解反應時,產品容易受到微生物污染,因此對生產工藝有較高的要求;而來源于嗜熱微生物的耐熱β-半乳糖苷酶其最適反應溫度一般在55℃以上,采用這類耐熱β-半乳糖苷酶,乳糖水解反應可以在較高溫度下進行以便減少微生物污染的可能性[2]。
筆者已對嗜熱脂肪芽孢桿菌(Geobacillus stearothermophilus)來源的耐熱β-半乳糖苷酶(BgaB)進行了基因克隆、重組表達、分離純化、固定化和酶學性質等研究[3],結果表明該酶的酶學性質非常適合于低乳糖牛乳的生產。為了簡化重組酶的純化步驟,提高生產效率,工業上常利用微生物的蛋白質分泌功能將細胞內合成的酶蛋白輸出到發酵上清液[4]。在先前的研究中,筆者在枯草芽孢桿菌(Bacillus subtilis)中嘗試了多種一般分泌途徑(the general secretion pathway,即Sec途徑)信號肽對BgaB的分泌,但均未實現分泌。本試驗擬在B.subtilis中嘗試信號肽隨機篩選方法來獲得適用于目標酶BgaB的信號肽,即構建信號肽編碼序列庫并采用信號肽編碼序列與目標基因bgaB的隨機融合來篩選能夠分泌該酶的信號肽,以便減少信號肽嘗試的次數,提高信號肽篩選效率。
1 材料與方法
1.1 材料
1.1.1 主要儀器設備
基因擴增儀:GS00001,英國G-Strom公司;
超聲波破碎儀:VCX-500,美國Sonics&Materials公司;
凝膠成像系統:Geldoc 2000,美國Bio-Rad公司;
回轉式恒溫氣浴搖床:ZHWY-2102,上海智城分析儀器制造有限公司。
1.1.2 試劑
LB培養基各配料:英國Oxoid公司;
PCR用高保真DNA聚合酶KOD Plus:日本Toyobo(上海)公司;
鄰-硝基苯-β-D-半乳糖吡喃糖苷(ONPG):上海生工生物工程有限公司;
各限制性內切酶和DNA連接酶、DNA分子量標準:美國 MBI Fermentas(中國)公司;
低分子量蛋白質標準:上海捷瑞生物工程有限公司;DNA瓊脂糖凝膠電泳膠回收試劑盒:北京索萊寶科技有限公司;
其它試劑:均為市售分析純。
1.1.3 菌種及培養條件大腸桿菌 (Escherichia coli)DH5α用于分子克隆和質粒的構建,G.stearothermophilusIAM11001株作為耐熱β-半乳糖苷酶編碼基因bgaB的供體菌株[5],B.subtilis168株作為分泌表達宿主菌株。其中DH5α和168菌株于37 ℃培養,G.stearothermophilusIAM11001株于55℃培養。所有菌株的培養均采用Luria-Bertani(LB)培養基,根據培養菌株的需要,向該培養基中添加氨芐青霉素(終濃度100μg/mL)或卡那霉素(終濃度50μg/mL)。
1.1.4 質粒E.coli中使用的亞克隆載體pUCX05由本研究室構建,質粒 pMA5是一個E.coli-B.subtilis穿梭載體[6],質粒pMA5△MCS-lipA 是pMA5的衍生質粒[7],為本研究室構建。本試驗基于pMA5和pMA5△MCS-lipA構建了表達載體pMA0911.1。
1.2 方法
1.2.1 常規分子生物學方法 分子生物學操作如E.coli感受態細胞的制備、質粒DNA的抽提及純化、限制性酶切、DNA片段的連接和轉化、聚合酶鏈式反應(PCR)、核酸凝膠電泳和蛋白質SDS-PAGE電泳等操作按Sambrook等編著的實驗手冊[8]進行,B.subtilis的感受態細胞制備和轉化按Harwood等編著的實驗手冊[9]進行。
1.2.2 表達載體pMA0911.1的構建方法 質粒pMA5啟動子下游無適合本試驗的限制性內切酶位點,為了引入更多適用的限制酶位點,本試驗對該質粒進行了改造。采用限制性內切酶NdeI和BamHI對質粒pMA5△MCS-lipA進行酶切,回收684bp片段并將其插入質粒pMA5的NdeI-BamHI位點之中,得到的重組質粒再用限制酶EcoRI進行酶切,回收7.2kb片段并進行自連接,得到載體命名為pMA0911.1。
1.2.3 枯草芽孢桿菌信號肽編碼序列庫的構建方法 以B.subtilis168株染色體DNA為模板,分別采用表1中各對引物進行PCR擴增,將擴增得到的信號肽編碼序列片段分別連接到亞克隆載體pUCX05的EcoRV位點,并轉化到E.coliDH5α中得到一組含11種不同信號肽編碼序列的重組質粒。使用時分別將這些重組質粒采用限制酶NdeI-EcoRI雙酶切并回收信號肽編碼序列,混合至終濃度為5~10ng/μL備用。
1.2.4 耐熱β-半乳糖苷酶基因克隆和分泌表達載體的構建方法 以G.stearothermophilusIAM11001株染色體 DNA作為模板,通過引物 P1(5′-GGGCCCGGAATTCATGAATGTGTTATCCTCAATTTG-3′)和 P2 (5′-GTTAATCGGATCCTCATCAAACCTTCCCGGCTTCATCATG-3′)進行PCR擴增出2kb左右的目標基因bgaB片段,并將其亞克隆到載體pUCX05中,得到pUCX05-bgaB。該重組質粒送上海博尚生物技術有限公司對bgaB基因進行測序。測序驗證序列正確后,將該質粒用限制性內切酶EcoRI和BamHI進行酶切并回收2kb左右的bgaB基因片段,將該片段插入到質粒pMA0911.1的相應酶切位點,所得重組質粒命名為pMA0911.1-bgaB。
1.2.5 耐熱β-半乳糖苷酶的表達和酶活力的檢測 將構建的耐熱β-半乳糖苷酶重組表達菌株種子液按1%體積比接種于100mL LB液體培養基中,于37℃,200r/min搖瓶培養。在培養的第6~16小時中,每隔1h取適量培養液,于12 000g離心20min后,分別回收發酵上清液和菌體。細胞外酶活力檢測直接采用上清液。對于細胞內酶活力檢測,將菌體用磷酸鹽緩沖液(PBS,pH 6.5)重懸洗滌2次,在冰浴中用超聲波破碎菌體(超聲波功率800W,時間為30min),細胞破碎液于12 000g離心30min后回收上清液進行細胞內酶活力的測定。酶活力按中性乳糖酶活力檢測方法進行[10],以ONPG為底物,一個中性乳糖酶單位定義:在55℃、pH 6.5條件下,每分鐘水解產生1nmol的鄰-硝基苯(ONP)所需酶的量為一個中性乳糖酶活單位(U)。
2 結果與討論
2.1 表達載體pMA0911.1及信號肽編碼序列庫的構建
質粒pMA5原始載體的啟動子PHpaII下游僅有NdeI和BamHI兩個單酶切位點,對于目標基因bgaB及其上游不同信號肽編碼序列的拼接融合并不方便,因此本試驗從質粒pMA5出發構建了質粒pMA0911.1(圖1),該質粒下游新引入了EcoRI、SalI等單酶切位點。
根據基因組范圍的預測結果,B.subtilis中約有300種可能輸出到細胞外的蛋白質[11],而蛋白質組學研究[12]表明B.subtilis培養上清液中存在約200種細胞外蛋白質。為了構建一個合適的信號肽編碼序列庫,本試驗參照文獻[12]的研究結果,選擇了11種在細胞外具有較大分泌輸出量的含信號肽蛋白質,按照1.2.3的方法構建了信號肽編碼序列庫。信號肽編碼序列的來源及其擴增所用引物見表1,擴增片段的電泳結果見圖2。擴增片段首先分別亞克隆至質粒pUCX05中以便保存,使用時通過限制性酶切將這些片段回收并按一定比例混合后得到一個含多種信號肽編碼序列的庫。
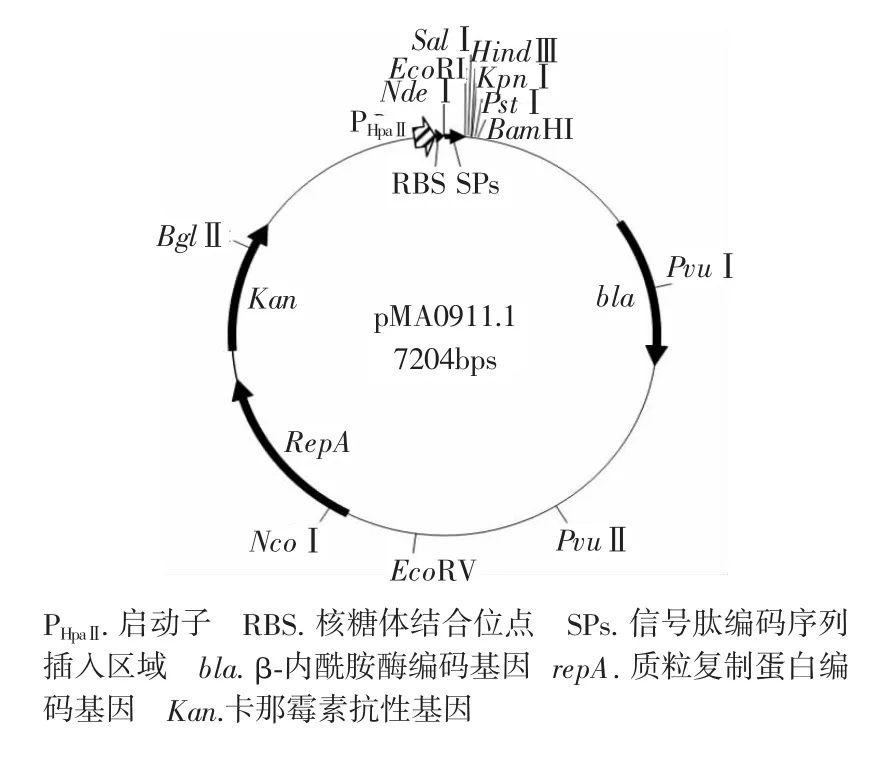
圖1 質粒pMA0911.1圖譜Figure 1 Physical map of plasmid pMA0911.1
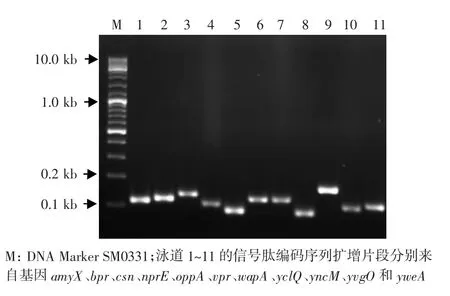
圖2 各信號肽編碼序列的PCR擴增結果Figure 2 The PCR results of the signal peptide coding sequences
2.2 耐熱β-半乳糖苷酶分泌表達體系的構建
從G.stearothermophilusIAM11001株基因組 DNA 出發,擴增出該酶的編碼基因bgaB,并將該基因克隆到質粒pMA0911.1中,得到重組質粒pMA0911.1-bgaB。為嘗試不同信號肽對該酶的分泌表達效率,將信號肽編碼序列庫中的信號肽編碼序列與pMA0911.1-bgaB的NdeI-EcoRI酶切回收片段相連接,并轉化B.subtilis168株感受態細胞,從平板上挑取轉化子并用引物 P3(5’-ACTTGGAAGTGGTTGCCGGA-3’)和 P4(5’-CTCTGGGTTATAATCTCCTC-3’)對轉化子樣本進行菌落PCR,以驗證重組B.subtilis轉化子所含質粒中信號肽編碼序列是否插入到bgaB基因的上游。
對300個轉化子樣本進行PCR驗證,其中約13.5%的轉化子為陽性,提示這些轉化子所含重組質粒中可能攜帶信號肽編碼序列。將40個陽性的PCR樣本進行序列測定,共得到33個有效測序結果,其中9個為NprE信號肽編碼序列,13個為AmyX信號肽編碼序列,6個為OppA信號肽編碼序列,5個為YweA編碼序列,其余7個為無效序列。通過信號肽篩選方法構建成功的分泌表達質粒和重組菌株見表2。

表1 信號肽編碼序列的來源及其擴增所用引物Table 1 Origins of the signal peptide coding sequences and the primers for amplification

表2 構建的重組分泌表達質粒和菌株Table 2 The secretory expression plasmids and strains constructed
由表2可知,信號肽編碼序列庫中的11條序列中有4條成功融合到到目標基因bgaB的上游,而其它信號肽編碼序列未能實現成功融合。在先前的研究中發現,某些枯草芽孢桿菌信號肽編碼序列無法成功融合到基因bgaB上游,推測這些不成功的例子是由于融合基因的表達產物對重組菌株具有致死作用,結合本試驗的結果可以進一步推斷,目標蛋白質與信號肽之間的配對是否合理影響到重組菌株能否正常生長。
2.3 耐熱β-半乳糖苷酶的表達及活性的檢測
按照1.2.5的方法對表2中4株重組菌株進行搖瓶培養,并對培養物細胞內外的耐熱β-半乳糖苷酶活力進行了檢測。搖瓶培養第6~16小時的各重組菌株細胞內外酶活力隨時間變化情況見圖3。

圖3 重組菌株細胞外的BgaB酶活力Figure 3 The extracellular BgaB enzymatic activities from the recombinant strains
由圖3可知,這4株重組菌株都實現了耐熱β-半乳糖苷酶的表達,其中重組菌株168(pMA0911-nprE-bgaB)和168(pMA0911-amyX-bgaB)在一定程度上實現該酶的細胞外分泌。重組菌株168(pMA0911-oppA-bgaB)和168(pMA0911-yweA-bgaB)培養上清液中無BgaB酶活力,然而該酶在細胞內卻實現了正常表達,推測其原因是OppA信號肽和YweA信號肽不適合該酶的細胞外分泌。在培養的第16小時,168(pMA0911-nprE-bgaB)菌株所產 BgaB的細胞內酶活力為152.01U/mL,細胞外酶活力為64.02U/mL;故分泌的BgaB酶活力占該菌株表達的總酶活力的29.6%,而168(pMA0911-amyX-bgaB)菌株細胞外酶活力較低。
對這4株重組菌株的培養上清液進行了SDS—PAGE電泳檢驗,其中168(pMA0911-amyX-bgaB)和168(pMA0911-nprE-bgaB)上清液電泳樣在 67kDa左右有條帶,且分子量大小與預期相符[5],而168(pMA0911-oppA-bgaB)和168(pMA0911-yweA-bgaB)上清液沒有明顯條帶(圖4),表明在這一表達系統中,NprE信號肽和AmyX信號肽能夠將BgaB分泌到細胞外,且NprE信號肽對于目標蛋白質BgaB的分泌效率要明顯高于AmyX信號肽。祝發明等[13]研究發現,枯草芽孢桿菌AmyX信號肽編碼序列能夠通過B.subtilis的雙精氨酸分泌途徑將G.stearothermophilus來源的耐熱β-半乳糖苷酶分泌到細胞外,與本試驗結果相符,而NprE信號肽引導該酶的分泌先前未見報道。

圖4 重組菌株發酵上清液的SDS-PAGE蛋白質電泳檢驗Figure 4 The SDS-PAGE analysis for the supernatants of the recombinant strains
3 結論
針對11種枯草芽孢桿菌信號肽構建了信號肽編碼序列庫,并采用隨機篩選的方法得到能夠分泌目標蛋白質BgaB的信號肽,其中枯草芽孢桿菌NprE信號肽和AmyX信號肽實現了BgaB的分泌。雖然分泌量尚低,還需要進一步篩選或設計適合該酶的信號肽,但本試驗構建信號肽編碼序列庫以及隨機篩選信號肽編碼序列的方法能用于各類目標蛋白質分泌信號肽的優化選擇,具有普遍適用性。
1 孫國慶,史玉東,付治軍,等.乳糖酶在生產低乳糖奶中的應用研究[J].食品與機械,2010,24(2):128~130.
2 Chen W,Chen H Q,Xia Y,et al.Production,purification,and characterization of a potential thermostable galactosidase for milk lactose hydrolysis fromBacillus stearothermophilus[J].Journal of Dairy Science,2008,91(5):1 751~1 758.
3 Chen W,Chen H Q,Xia Y,et al.Immobilization of recombinant thermostableβ-galactosidase fromBacillus stearothermophilusfor lactose hydrolysis in milk[J].Journal of Dairy Science,2009,92(2):491~498.
4 Degering C,Eggert T,Puls M,et al.Optimization of protease secretion inBacillus subtilisandBacillus licheniformisby screening of homologous and heterologous signal peptides[J].Applied and Environmental Microbiology,2010,76(19):6 370~6 376.
5 Hirata H,Negoro S,Okada H.Molecular basis of isozyme formation ofβ-galactosidases inBacillus stearothermophilus:Isolation of twoβ-galactosidase genes,bgaAandbgaB[J].Journal of Bacteriology,1984,160(1):9~14.
6 Westers L,Dijkstra D S,Westers H,et al.Secretion of functional human interleukin-3fromBacillus subtilis[J].Journal of Biotechnology,2006,123(2):211~224.
7 曾伶俐.不同信號肽對脂肪酶A在枯草芽孢桿菌中分泌表達的影響[D].無錫:江南大學,2010.
8 Sambrook J,Russell D W.Molecular cloning:a laboratory manual[M].3rd ed.New York:Cold Spring Harbor Laboratory Press,2001.
9 Harwood C R,Cutting S M.Molecularbiological methodsforBacillus[M].Sussex:Wiley,1990.
10 Yuan G,Wong S L.Regulation ofgroEexpression inBacillus subtilis:The involvement of theσA-like promoter and the roles of the inverted repeat sequence(CIRCE)[J].Journal of Bacteriology,1995,177(19):5 427~5 433.
11 Tjalsma H,Bolhuis A,Jongbloed J D H,et al.Signal peptidedependent protein transport inBacillus subtilis:A genomebased survey of the secretome[J].Microbiology and Molecular Biology Reviews,2000,64(3):515~547.
12 Antelmann H,Tjalsma H,Voigt B,et al.A proteomic view on genome-based signal peptide predictions[J].Genome Research,2001,11(9):1 484~1 502.
13 祝發明.枯草芽孢桿菌Tat分泌表達青霉素G酰化酶初步研究[D].楊凌:西北農林科技大學,2006.
Construction of a signal peptide coding sequence library and secretion of a thermostableβ-galactosidase
XIA Yu GONG Zi-feng CHEN Yu-liang ZHAO YingSUN Zhen
(School of Food Science and Technology,Jiangnan University,Wuxi,Jiangsu214122,China)
In order to achieve the extracellular secretion of the thermostableβ-galactosidase fromGeobacillus stearothermophilus,a simple and rapid method was developed in this study for screening of the signal peptide that can direct the secretion of the target enzyme.A signal peptide coding sequence library was constructed according to 11signal peptides,and the proper signal peptide coding sequences were obtained by random selection.The secretion plasmids and the recombinant strains were then constructed.Results showed that the signal peptide of NprE which obtained by random selection can secret the target enzyme properly.After cultivation for 16h,theβ-galactosidase accumulated in the supernatant reached 64.02U/mL,which accounted for 29.6%of the total target enzyme synthesized.The signal peptide screening method developed in this study can be applied for the rapid selection and optimization of signal peptides in other microbial protein secretion systems.
β-galactosidase;Bacillus subtilis;protein secretion;signal peptide
10.3969 /j.issn.1003-5788.2011.06.003
國家自然科學基金(編號:31000752);江蘇省基礎研究計劃(自然科學基金)(編號:BK2008103);教育部博士點基金(編號:200802951022)
夏雨(1975-),男,江南大學副教授,博士。E-mail:yuxia@jiangnan.edu.cn
孫震
2011-06-20

