嗜熱四膜蟲金屬硫蛋白基因MMT2和MTT4的表達(dá)規(guī)律比較與進(jìn)化模式分析
暢 悅, 馮立芳, 熊 杰, 繆 煒
(1. 中國科學(xué)院水生生物研究所 水生生物多樣性與保護(hù)重點(diǎn)實驗室,湖北 武漢 430072; 2. 浙江工商大學(xué) 食品與生物工程學(xué)院,浙江 杭州 310012; 3. 中國科學(xué)院研究生院,北京 100049)
嗜熱四膜蟲金屬硫蛋白基因MMT2和MTT4的表達(dá)規(guī)律比較與進(jìn)化模式分析
暢 悅1,3, 馮立芳1,2, 熊 杰1,3, 繆 煒1,*
(1. 中國科學(xué)院水生生物研究所 水生生物多樣性與保護(hù)重點(diǎn)實驗室,湖北 武漢 430072; 2. 浙江工商大學(xué) 食品與生物工程學(xué)院,浙江 杭州 310012; 3. 中國科學(xué)院研究生院,北京 100049)
多個金屬硫蛋白基因異構(gòu)型已在四膜蟲中被鑒定, 這些異構(gòu)型可分為7a和7b兩個亞家族。該文利用實時熒光定量PCR技術(shù)檢測了嗜熱四膜蟲金屬硫蛋白基因MTT2和MTT4在Hg、Cu、Cd、Zn、H2O2暴露下的表達(dá)水平, 結(jié)果顯示兩者表達(dá)規(guī)律相似, 均為:Cu暴露下上調(diào)最高(>200倍), Hg次之, Cd、Zn上調(diào)倍數(shù)不大, H2O2有下調(diào)趨勢。此表達(dá)規(guī)律明顯有別于7a亞家族, 具有7b亞家族的表達(dá)特征。同種誘導(dǎo)物暴露下MTT4的上調(diào)表達(dá)幅度比MTT2高出數(shù)倍, 結(jié)合生物信息學(xué)分析結(jié)果, 推測可能與MTT2和MTT4上游調(diào)控元件(如AP-1、MRE等)的數(shù)量差異有關(guān)。基于MTT2和MTT4在結(jié)構(gòu)和功能上的高度相似性, 推測兩者可能是經(jīng)近期基因復(fù)制事件產(chǎn)生, 并遵循基因劑量模型進(jìn)化而來。
嗜熱四膜蟲; 金屬硫蛋白基因; 實時熒光定量PCR; 表達(dá)分析; 基因復(fù)制
金屬硫蛋白(metallothionein, MTs)是一類廣泛分布于生物體內(nèi)的超家族蛋白, 能夠依靠巰基與金屬離子結(jié)合形成具有光譜學(xué)特征的金屬-巰基簇(metal-thiolate clusters)。MTs于1957年首次從馬的腎臟皮質(zhì)中被分離得到, 隨后類似的生物分子在眾多的真核生物物種及不同組織和細(xì)胞類型中得到鑒定。其典型特征包括:相對分子質(zhì)量低(<7× 103~10×103), 具有較高的重金屬離子結(jié)合率(以Zn、Cu和Cd為主), 含有18~23個高度保守的半胱氨酸(Cysteine, Cys)位點(diǎn), 缺少芳香族氨基酸和組氨酸等(Coyle et al, 2002)。
MTs不僅在動物界中廣泛分布, 在其他的真核生物(真菌、高等植物和原生動物)及原核微生物中也均有發(fā)現(xiàn)(Binz & Kagi, 1999)。由于MTs高度保守的特征和分布的廣泛性, 人們推測此類蛋白在生物體內(nèi)的重要代謝通路中扮演著不可缺少的角色。近幾十年來, 圍繞其功能展開的深入研究證實, MTs作為一類多功能蛋白參與眾多不同的生物過程, 已知的有:清除自由基、抗電離輻射(Dabrio et al, 2002); 重金屬解毒(Liu & Klaassen, 1996); 參與微量元素的代謝(Coyle et al, 2009); 參與機(jī)體應(yīng)激反應(yīng)、增強(qiáng)對抗不良狀態(tài)的適應(yīng)能力(Colangelo et al, 2004); 影響 DNA 復(fù)制、轉(zhuǎn)錄及蛋白質(zhì)的合成(Ostrakhovitch et al, 2006); 抗細(xì)胞凋亡(Niu et al, 2006)等。同時, 人們開始認(rèn)識到MTs的不同功能及其相對重要性是基于不同物種或組織在進(jìn)化過程中所產(chǎn)生的特殊生理需要和物種對不斷變化環(huán)境的適應(yīng)結(jié)果。因此, MTs的產(chǎn)生、基因重復(fù)與普遍存在的體內(nèi)表達(dá)等現(xiàn)象背后的進(jìn)化原因逐漸成為研究的熱點(diǎn)。
目前, 在單細(xì)胞原生動物中有關(guān)金屬硫蛋白的研究僅見于纖毛蟲類的數(shù)種四膜蟲(Tetrahymena)。Piccinni et al (1994)報道, 在T. pryformis和T. pigmentosa中分離得到了首個纖毛蟲鎘金屬硫蛋白(Cd-MT), 隨后, 在T. pigmentosa中分離鑒定到了首個四膜蟲銅結(jié)合金屬硫蛋白基因型(Cu-MT)(Santovito et al, 2001)。通過不同金屬的誘導(dǎo)實驗證明, Cd-MT和Cu-MT具有顯著不同的轉(zhuǎn)錄響應(yīng)模式。近年來, 在T. pigmentosa、T. thermophila和T. rostrata中也陸續(xù)發(fā)現(xiàn)了不同的 MTs異構(gòu)型(Amaro et al, 2008; Boldrin et al, 2003; Fu & Miao, 2006; Guo et al, 2008; Santovito et al, 2001; Shang et al, 2002)。根據(jù)四膜蟲MTs的系統(tǒng)發(fā)育關(guān)系、氨基酸序列中半胱氨酸保守簇、賴氨酸與半胱氨酸保守位點(diǎn)的相對位置以及各異構(gòu)型對Cd或Cu的不同誘導(dǎo)表達(dá)響應(yīng)模式等四個方面的特征, 四膜蟲MTs被進(jìn)一步劃分為7a和7b兩個亞家族, 7a為Cd-MT , 7b為Cu-MT (Diaz et al, 2007)。基于不同的MTs異構(gòu)型在基因內(nèi)串聯(lián)重復(fù)上的差異性, 推測基因復(fù)制(gene duplication)是四膜蟲金屬硫蛋白基因在進(jìn)化過程中的一個典型特征。Boldrin et al (2003)提出現(xiàn)今不同四膜蟲物種中分布的金屬硫蛋白基因很可能是由一個祖先功能單元發(fā)生多重復(fù)制和分化事件形成的, 期間也可能伴隨著片段的丟失, 但具體進(jìn)化路線依然不明。
目前, 圍繞四膜蟲金屬硫蛋白結(jié)構(gòu)、功能和進(jìn)化的研究工作主要集中在7a亞家族(Diaz et al, 2007; Dondero et al, 2004; Santovito et al, 2007), 而對7b亞家族成員的研究則相對較少。本文在對 7b亞家族中嗜熱四膜蟲(T. thermophila)MTT2(基因 ID: TTHERM_00433520)和MTT4(基因ID: TTHERM_ 00433530)基因序列分析和不同誘導(dǎo)物暴露下表達(dá)變化情況進(jìn)行考察的基礎(chǔ)上, 探討了兩者的功能異同和進(jìn)化機(jī)制。
1 材料與方法
1.1 四膜蟲的培養(yǎng)與脅迫處理
嗜熱四膜蟲 SB210株由美國加州大學(xué)圣巴巴拉分校Eduardo Orias教授惠贈。四膜蟲培養(yǎng)基配制方法如下:2% Tryptone (Oxide)和0.1% yeast extract (Oxide)溶于雙蒸水, 經(jīng)103 kPa、120 ℃滅菌20 min后冷卻至室溫。30 ℃無菌培養(yǎng)細(xì)胞至平臺早期后,分別用于Cu濃度梯度處理實驗和不同誘導(dǎo)物暴露實驗。Cu濃度梯度處理實驗按終濃度356、500、630、783、922和 1 067 μmol/L梯度依次加入CuCl2·2H2O。不同誘導(dǎo)物暴露實驗中, 我們選擇的誘導(dǎo)物為HgCl2、CuCl2·2H2O、ZnCl2、CdCl2·2.5H2O和 H2O2(國藥集團(tuán)), 并參照相關(guān)文獻(xiàn)報道(Nilsson, 1989)和預(yù)實驗結(jié)果, 使用了不影響細(xì)胞生長率的最高處理濃度, 依次為 10、630、306、45和 200 μmol/L。對照組培養(yǎng)基中加入相應(yīng)體積的無菌水,處理時間均為2 h。
1.2 mRNA提取與cDNA合成
吸取1 mL 步驟1.1中處理過的四膜蟲, 8 000 r/min離心10 min (Beckman Instruments Inc., Fullerton, U.S.A.)富集, 參照試劑盒TRIzol Reagent (Invitrogen)操作說明提取總 RNA, 瓊脂糖凝膠電泳鑒定所提RNA 質(zhì)量, 經(jīng)分光光度計(Malcom)測得樣品OD260/280在 2.02~2.08范圍內(nèi)。總 RNA用 RQ1 RNase-free DNase (Promega)消化處理后, 用M-MLV逆轉(zhuǎn)錄酶RNase H+(TOYOBO)逆轉(zhuǎn)錄合成cDNA, 50 μL反應(yīng)體系中包括100 U酶, 5 pmol/L Oligo_(dT)20primers (Promega), 反應(yīng)步驟依照試劑說明書。
1.3 實時熒光定量PCR檢測基因表達(dá)水平
PCR反應(yīng)在 96孔 Chromo4型實時熒光定量PCR儀(MJ Research)上進(jìn)行。MTT2和MTT4共用的正向引物為:F-5'-TCTGCAAATGTGGAACTAC TGCTGCTTG-3'。MTT2和MTT2反向引物均設(shè)計在基因3'端旁側(cè)區(qū), 具有很好的特異性, 序列分別為:R-5'-ACATATCTTCTCAATAAAATACATTCAATAAT-3'和 R-5'-TATATTCAATACATACTTTAGATTTGG TTAAGA-3'。PCR產(chǎn)物經(jīng)測序驗證了產(chǎn)物的正確性。內(nèi)參為看家基因β-actin, 正向引物為:5'-TCCACGA ACTTACCTTCAACTC-3', 反向引物為:5'-GGAAC CACCAATCCAGACAG-3', GenBank no. M13939 (Cupples & Pearlman, 1986)。實時熒光定量PCR反應(yīng)體系如下: 2.5 μL 10×buffer, 0.5 μL 10 mmol/L dNTP, 0.4 μmol/L引物, 1.2 μL EvaGreen (Biotium), 1 U Hot start Taq酶(天為時代), 最后加雙蒸水配成25 μL PCR反應(yīng)體系。反應(yīng)條件如下:94 °C預(yù)變性5 min, 中間40個循環(huán)94 °C 20 s, 54 °C 30 s, 72 °C 30 s, 81°C β-actin讀板1 s, 84.4 °CMTT2和MTT4讀板1 s, 接著72 °C延伸10 min, 最后制作溶解曲線70~90 °C, 以0.3 °C/s速率讀取數(shù)據(jù)。每個cDNA樣品設(shè)置3個平行樣。反應(yīng)數(shù)據(jù)通過軟件Opticon 2 (MJ Research)讀取。MTT2和MTT4的相對表達(dá)水平由分析工具Relative Expression Software Tool計算(Pfaffl et al, 2002), 統(tǒng)計方法采用軟件默認(rèn)的ANOVA,P<0.05為有統(tǒng)計學(xué)意義。具體分析方法參照以往文獻(xiàn)(Feng et al, 2007)。
1.4 MTT2與MTT4 序列分析
通過 Tetrahymena Genome Database (TGD) (http://www.ciliate.org/)的GBrowse查詢兩者位置信息。使用ClustalW比對MTT2和MTT4編碼區(qū)序列。利用Paml44軟件包(Yang, 2007)中的yn00程序, 使用Nei-Gojobori法(Nei & Gojobori, 1986)計算MTT2和MTT4的非同義替換率和同義替換率比值(Ka/Ks)。同時, 我們從MTT2和MTT4編碼區(qū)上游各截取長度 1 kb的序列, 利用在線分析工具TFSearch(http://www.cbrc.jp/research/db/TFSEARC H.html)進(jìn)行調(diào)控元件的預(yù)測分析, 并且根據(jù)文獻(xiàn)中關(guān)于四膜蟲MT基因重要表達(dá)調(diào)控元件MRE(metalresponsive element)(Boldrin et al, 2003)和MTCM1 (Metallothionein Conserved Motif 1)(Diaz et al, 2007)序列的保守性預(yù)測了MTT2和MTT4上游的MRE和MTCM1。
1.5 共表達(dá)基因分析
MTT2和MTT4基因表達(dá)數(shù)據(jù)來自四膜蟲基因表達(dá)數(shù)據(jù)庫 Tetrahymena Genome Expression Database(TGED, http://tged.ihb.ac.cn/(Xiong et al, 2011), 通過計算所有基因表達(dá)譜間的相關(guān)系數(shù)分別得到四膜蟲MTT2和MTT4基因的共表達(dá)基因(相關(guān)系數(shù)>0.9) (Miao et al, 2009)。之后用Blast2GO對共表達(dá)基因進(jìn)行Gene Ontology (Aury et al, 2006)基因功能注釋, 通過分析和比較共表達(dá)基因及其功能注釋, 推測MTT2和MTT4基因功能間的關(guān)系。
2 結(jié) 果
2.1 不同濃度Cu暴露下MTT2與MTT4表達(dá)水平的變化
在356、500、630、783、922和1 067 μmol/L 6個濃度Cu暴露下,MTT2與MTT4的表達(dá)量隨著濃度的增高有著明顯的變化。MTT2在356 μmol/L和 500 μmol/L濃度處理下表達(dá)量較高, 并且在500 μmol/L下達(dá)到最大值, 為對照組的237倍。隨著濃度的進(jìn)一步增加,MTT2的表達(dá)量呈下降趨勢。MTT4表達(dá)量的變化趨勢與MTT2相似, 但是變化幅度遠(yuǎn)大于MTT2。MTT4同樣在500 μmol/L下達(dá)到最大值, 為對照組的1 983倍。考慮到相應(yīng)的p值較大, 以及基因表達(dá)量太高導(dǎo)致產(chǎn)生的熒光信號值可能已超出儀器正確讀取的范圍等因素, 該具體上調(diào)倍數(shù)可能不準(zhǔn)確, 但MTT4在Cu誘導(dǎo)下上調(diào)倍數(shù)明顯高于MTT2是可以確定的。此規(guī)律在各個濃度下均有體現(xiàn)(圖1)。
2.2 MTT2與MTT4不同誘導(dǎo)物處理下表達(dá)水平的差異
Cu處理組中MTT2和MTT4表達(dá)量分別上調(diào)219倍和 425倍, 是其他誘導(dǎo)物處理組的數(shù)倍。另外 Hg暴露下, 兩者的表達(dá)量也有較大幅度上調(diào),MTT4的表達(dá)量上調(diào)101倍, 高于MTT2的17倍。與前兩個處理條件相比, Zn和Cd處理組中兩者的表達(dá)變化幅度很小, 僅在1~3倍之間。H2O2處理組則均呈現(xiàn)下調(diào)的趨勢(圖2)。
2.3 MTT2和MTT4基因的序列分析
通過TGD的GBrowse查詢可知MTT4位于MTT2上游1 391 bp處, 兩者中間沒有其他基因。MTT2和MTT4基因編碼區(qū)長度均為327 bp, 其中只有8個堿基的差異, 導(dǎo)致了2個氨基酸的不同(圖3)。Nei-Gojobori法計算得到兩者Ka/Ks值為0.0816。

圖1 不同濃度Cu暴露下MTT2和MTT4的表達(dá)水平變化Fig.1 Gene expression levels of MTT2 and MTT4 in Tetrahymena induced by Cu of serial concentrations

圖2 MTT2和MTT4在Hg、Cu、Zn、Cd和H2O2分別誘導(dǎo)下的表達(dá)變化Fig.2 Gene expression levels of MTT2 and MTT4 induced by Hg, Cu, Zn, Cd, and H2O2, respectively
利用TFSEARCH在MTT2和MTT4上游1 kb區(qū)分別預(yù)測到了TATA-box、AP-1等多種調(diào)控元件。在MTT2上游預(yù)測到一個AP-1結(jié)合位點(diǎn), 而MTT4上游共預(yù)測到3個AP-1位點(diǎn)。另外, 基于序列保守性的預(yù)測結(jié)果顯示,MTT2上游可能存在5個金屬應(yīng)答元件(metal response element, MRE), 而MTT4上游可能存在3個MRE和1個與AP-1重疊的MTCM1位點(diǎn)(圖3)。
2.4 共表達(dá)基因分析
MTT2和MTT4共表達(dá)基因的數(shù)量分別為80和 110, 其中65個基因是重疊的。有GO功能注釋的基因數(shù)在MTT2中是20, 在MTT4中是25, 其中16個基因為兩者共有(表1)。進(jìn)一步對比這些具有GO功能注釋的基因在生物學(xué)過程(biological process)方面的功能描述, 發(fā)現(xiàn)MTT2共表達(dá)基因的115條功能描述包括了MTT4共表達(dá)基因的全部107條功能描述。兩者的功能分類情況差別不大(圖4), 僅發(fā)現(xiàn)一條MTT2特有的與信號處理相關(guān)(signal process)的功能描述。
3 討 論
MTs在細(xì)胞內(nèi)行使多種功能, 其多種異構(gòu)型在多細(xì)胞生物中廣泛存在, 在哺乳動物中多態(tài)性最高,所有被檢測物種都擁有2種或以上數(shù)量的異構(gòu)型。不同異構(gòu)型在功能上有著分工, 但部分功能有可能發(fā)生重疊。在對金屬的響應(yīng)程度上, 不同異構(gòu)型存在明顯的差異(Binz & Kagi, 1999)。另外, 一些異構(gòu)型在某些組織中特異表達(dá)并執(zhí)行特定的功能(Kramer et al, 1996; Miles et al, 2000; Syring et al, 2000)。這些現(xiàn)象揭示了金屬硫蛋白所涉及生物學(xué)功能的廣泛程度與其多樣的異構(gòu)型種類存在關(guān)聯(lián)。這些異構(gòu)型功能上的分化程度, 其產(chǎn)生和進(jìn)化的機(jī)制和生物學(xué)意義都是值得關(guān)注的。同樣, 在單細(xì)胞生物中也有大量金屬硫蛋白異構(gòu)型存在。嗜熱四膜蟲中至今已有5個MT基因被鑒定, 異構(gòu)型種類明顯比其他單細(xì)胞真核生物豐富。因此, 嗜熱四膜蟲是研究 MT不同異構(gòu)型功能分化和進(jìn)化關(guān)系的理想對象。
MTT2和MTT4對Cu的響應(yīng)要遠(yuǎn)遠(yuǎn)高于Cd以及其他3種誘導(dǎo)物; 在Hg誘導(dǎo)下也有一定程度的上調(diào)。盡管Zn能夠普遍誘導(dǎo)哺乳動物中的MT基因的高表達(dá)(Kagi, 1993),MTT2和MTT4在其暴露下表達(dá)水平卻沒有明顯的提升。而在 H2O2暴露下兩者表達(dá)量稍有下降。這些現(xiàn)象與以往報道中 7a亞家族成員的表達(dá)情況有著明顯差異。7a亞家族成員在Cd誘導(dǎo)下表達(dá)量均要高于Cu(Boldrin et al, 2003; Diaz et al, 2007; Fu & Miao, 2006; Piccinni et al, 1999), 在Zn誘導(dǎo)下也能夠有較高程度的上調(diào)(Diaz et al, 2007; Fu & Miao, 2006), 同時MTT1被報道在H2O2暴露下表達(dá)水平大幅提高(Dondero et al, 2004),而7b亞家族中的MTT2和TpigMT-2則對Cu響應(yīng)遠(yuǎn)高于Cd(Boldrin et al, 2003)。MTT2和MTT4對誘導(dǎo)物響應(yīng)情況與以往報道相符, 呈現(xiàn)出 7b亞家族的特征, 同時與7a亞家族存在明顯的區(qū)別, 驗證了四膜蟲中MT異構(gòu)型存在明顯的功能分化。值得注意的是, 盡管對不同誘導(dǎo)物響應(yīng)的程度不同, 但MTT2和MTT4對這些誘導(dǎo)物的響應(yīng)趨勢完全一致,說明它們可能在脅迫條件下行使相似的功能。

圖3 MTT2和MTT4序列及預(yù)測調(diào)控元件Fig.3 Sequences of MTT2 and MTT4 with the predicted regulatory elements
考慮到兩者對誘導(dǎo)物的響應(yīng)程度不同可能是由編碼區(qū)上游調(diào)控序列的差異造成的, 我們截取MTT2和MTT4編碼區(qū)上游1 kb長度的序列進(jìn)行了調(diào)控元件預(yù)測, 所得重要元件被標(biāo)記在圖3中。其中MRE是MT基因5'端旁側(cè)序列中普遍存在的調(diào)控元件(Stuart et al, 1985; Thiele, 1992), 能夠被金屬響應(yīng)轉(zhuǎn)錄因子 MTF-1接合進(jìn)而激活下游基因轉(zhuǎn)錄活性(Haq et al, 2003)。四膜蟲MT基因上游預(yù)測有多個MRE拷貝存在(Boldrin et al, 2008; Diaz et al, 2007), 但是未發(fā)現(xiàn)MTF-1的同源基因(Diaz et al, 2007)。Boldrin et al (2003)分析了四膜蟲中MRE的保守序列和位置特點(diǎn), 以此為依據(jù), 我們在MTT4上游預(yù)測到3個MRE, 在MTT2上游預(yù)測到5個。多個拷貝的 MRE之間存在共同作用, 并且拷貝數(shù)被認(rèn)為與轉(zhuǎn)錄活性相關(guān)(Imbert et al, 1990)。因此,MTT2和MTT4上游多個拷貝MRE的存在可能是兩者在Cu暴露下表達(dá)倍數(shù)能夠顯著提高的重要條件
之一。另一方面, MTCM1是在四膜蟲MT基因7a亞家族中發(fā)現(xiàn)的一段保守基序, 被推測參與轉(zhuǎn)錄因子發(fā)生協(xié)同作用進(jìn)而產(chǎn)生特異性響應(yīng)(Diaz et al, 2007)。MTCM1保守序列(TGANTCA)在T. thermophila和T. pryformis中的7a亞家族成員中高度保守, 因與 AP-1結(jié)合存在序列上的重合而被認(rèn)為與 AP-1存在聯(lián)系(Shaulian & Karin, 2002), 而AP-1是真核生物重要的轉(zhuǎn)錄調(diào)控因子之一, 在酵母中被報道與重金屬抗性密切相關(guān)(Wu et al, 1993)。我們在MTT4上游預(yù)測到了3個AP-1結(jié)合位點(diǎn), 其中 1個與 MTCM1保守序列重合。而在MTT2上游僅有 1個 AP-1接合位點(diǎn), 未發(fā)現(xiàn)MTCM1。因此, 上游AP-1結(jié)合位點(diǎn)的數(shù)量不同可能是引起MTT2和MTT4對重金屬響應(yīng)程度差異的主要原因。
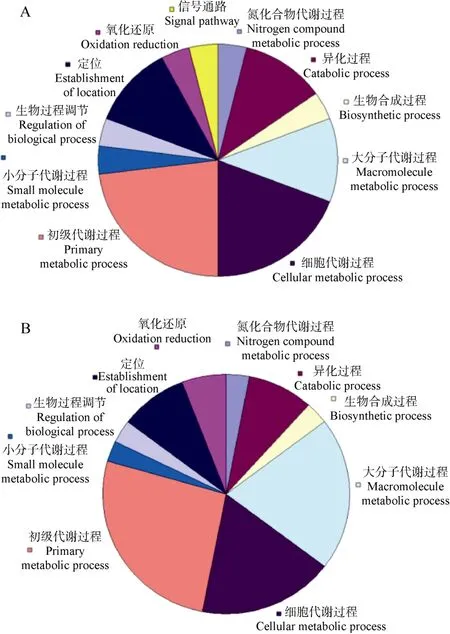
圖4 MTT2和MTT4共表達(dá)基因的功能注釋分類情況,按照生物學(xué)過程第三級描述繪制Fig. 4 Function classification of MTT2 and MTT4 according to description of level 3 in biological process
MTs除了在異常狀態(tài)下對機(jī)體起保護(hù)作用, 也參與多種正常生理過程, 如微量元素代謝、個體發(fā)育和細(xì)胞分化過程等(Coyle et al, 2009)。MTT2和MTT4在三種生理狀態(tài) 20個階段的表達(dá)模式一致,僅表達(dá)量有些許差異, 并且在普通生理時期(生長、接合)表達(dá)量較高, 說明兩者除了在脅迫條件下發(fā)生作用外, 也在四膜蟲正常生理活動中起重要作用。GO功能注釋顯示,MTT2和MTT4共表達(dá)基因的功能繁多但分類相似, 如初級代謝、氧化還原等(圖3)。因此,MTT2和MTT4在四膜蟲正常生理狀態(tài)下也可能行使相似的功能。
在核酸水平上,MTT2和MTT4的編碼序列的長度完全一致, 序列一致性為 97.6%, 僅存在 8個堿基的區(qū)別。而在氨基酸水平上, 這8個堿基的不同僅導(dǎo)致了兩者蛋白序列中兩個氨基酸位點(diǎn)的差異。MTT2和MTT4的序列具有高度的同源性, 并且兩個基因的編碼核酸序列的同義替換率較小(Ks=0.0958), 說明兩者極有可能是由近期的基因復(fù)制(gene duplication)所產(chǎn)生, 與推測的四膜蟲中MTs基因的分化模式相符(Boldrin et al, 2003)。
生物體中的同源基因可能來源于全基因組的復(fù)制事件, 比如同樣是原生動物的草履蟲(Aury et al, 2006), 或是高等動物輻鰭魚(Zhou et al, 2006);同源基因也有可能來自于部分基因片斷的復(fù)制事件, 隨后生物個體中復(fù)制所產(chǎn)生的基因可能會丟失,但少數(shù)在基因組中得以保留。而在基因組中保留下來需要經(jīng)歷復(fù)雜的過程。復(fù)制后的基因必須先在整個生物群體中得以固定, 而隨后逐漸累積的突變將會決定其命運(yùn)。目前已有多個經(jīng)典的模型來解釋復(fù)制基因的命運(yùn), 其中包括新功能化模型、亞功能化模型、假基因化模型和基因劑量模型(Innan & Kondrashov, 2010)。新功能化模型和亞功能化模型解釋了復(fù)制后產(chǎn)生的兩個基因在個體功能上的差異; 假基因化模型則解釋了復(fù)制基因的去功能化;基因劑量模型則用解釋了復(fù)制后產(chǎn)生的兩個基因功能相同并在基因組中得以保留是由于基因所需劑量決定。
基因劑量模型通常可應(yīng)用于三類基因, 包括介導(dǎo)機(jī)體與環(huán)境作用的基因、蛋白互作基因和對基因劑量有高要求的基因(如核糖體蛋白),MTT2和MTT4基因?qū)儆诘谝活悺?fù)制基因由于基因的劑量在基因組中保留后會受到負(fù)選擇作用以保證其功能上的相似。對MTT2基因和MTT4基因的分析表明, 其非同義替換率和同義替換率的比值(Ka/Ks)為 0.0816, 遠(yuǎn)遠(yuǎn)小于 1, 說明其受到了強(qiáng)烈的負(fù)選擇。同時, 在序列上,MTT2基因和MTT4具有很高的相似性, 其所具有的上游調(diào)控元件類型一致, 僅存在數(shù)量上的差別。功能上, 盡管存在響應(yīng)程度的不同(可能由上游調(diào)控元件的數(shù)量導(dǎo)致),MTT2基因和MTT4基因在對不同誘導(dǎo)物處理條件下的表達(dá)趨勢非常相似; 基因芯片的結(jié)果顯示MTT2基因和MTT4基因在嗜熱四膜蟲三個重要的生理和發(fā)育時期表達(dá)變化很相似, 僅存在表達(dá)量的些許差異; GO分析兩者的共表達(dá)基因也表明其存在功能上的相似性(圖4)。因此,MTT2和MTT4的功能高度相似。由此可見,MTT2基因和MTT4基因復(fù)制后在基因組中保留下來更符合基因劑量模型。
致謝:本實驗所用嗜熱四膜蟲SB210株系由美國加州大學(xué)圣巴巴拉分校的 Eduardo Orias教授惠贈, 在此表示衷心感謝。
Amaro F, de Lucas MD, Martin-Gonzalez A, Gutierrez JC. 2008. Two new members of theTetrahymenamulti-stress-inducible metallothionein family: Characterization and expression analysis ofT.rostrataCd/Cu metallothionein genes [J].Gene, 423(1): 85-91.
Aury JM, Jaillon O, Duret L, Noel B, Jubin C, Porcel BM, Segurens B, Daubin V, Anthouard V, Aiach N, Arnaiz O, Billaut A, Beisson J, Blanc I, Bouhouche K, Camara F, Duharcourt S, Guigo R, Gogendeau D, Katinka M, Keller AM, Kissmehl R, Klotz C, Koll F, Le Mouel A, Lepere G, Malinsky S, Nowacki M, Nowak JK, Plattner H, Poulain J, Ruiz F, Serrano V, Zagulski M, Dessen P, Betermier M, Weissenbach J, Scarpelli C, Schachter V, Sperling L, Meyer E, Cohen J, Wincker P. 2006. Global trends of whole-genome duplications revealed by the ciliateParamecium tetraurelia[J].Nature, 444(7116): 171-178.
Binz PA, Kagi JHR. 1999. Metallothionein: Molecular Evolution and Classification [M]//Klaassen CD. Metallothionein IV. Basel: Birkhauser Verlag, 7-13.
Boldrin F, Santovito G, Formigari A, Bisharyan Y, Cassidy-Hanley D, Clark TG, Piccinni E. 2008.MTT2, a copper-inducible metallothionein gene fromTetrahymena thermophila[J].Comp Biochem Phys C, 147(2): 232-240.
Boldrin F, Santovito G, Negrisolo E, Piccinni E. 2003. Cloning and sequencing of four new metallothionein genes fromTetrahymena thermophilaandT. pigmentosa: Evolutionary relationships inTetrahymenaMT family [J].Protist, 154(3-4): 431-442.
Colangelo D, Mahboobi H, Viarengo A, Osella D. 2004. Protective effect of metallothioneins against oxidative stress evaluated on wildtype and MT-null cell lines by means of flow cytometry [J].Biometals, 17(4): 365-370.
Coyle P, Martin SA, Carey LC, Summers BL, Rofe AM. 2009. Ethanol-mediated fetal dysmorphology and its relationship to the ontogeny of maternal liver metallothionein [J].Alcohol Clin Exp Res, 33(6): 1051-1058.
Coyle P, Philcox JC, Carey LC, Rofe AM. 2002. Metallothionein: The multipurpose protein [J].Cell Mol Life Sci, 59(4): 627-647.
Cupples CG, Pearlman RE. 1986. Isolation and characterization of the actin gene fromTetrahymena thermophila[J].Proc Natl Acad Sci USA, 83(14): 5160-5164.
Dabrio M, Rodriguez AR, Bordin G, Bebianno MJ, De Ley M, Sestakova I, Vasak M, Nordberg M. 2002. Recent developments in quantification methods for metallothionein [J].J Inorg Biochem, 88(2): 123-134.
Diaz S, Amaro F, Rico D, Campos V, Benitez L, Martin-Gonzalez A, Hamilton EP, Orias E, Gutierrez JC. 2007.Tetrahymenametallothioneins fall into two discrete subfamilies [J].PLoS One, 2(3): e291.
Dondero F, Cavaletto M, Ghezzi AR, La Terza A, Banni M, Viarengo A. 2004. Biochemical characterization and quantitative gene expression analysis of the multi-stress inducible metallothionein fromTetrahymena thermophila[J].Protist, 155(2): 157-168.
Feng L, Miao W, Wu Y. 2007. Differentially expressedgenes ofTetrahymena thermophilain response to Tributyltin (TBT) identified by suppression subtractive hybridization and real time quantitative PCR [J].Aquat Toxic, 81(1): 99-105.
Fu CJ, Miao W. 2006. Cloning and characterization of a new multi-stress inducible metallothionein gene inTetrahymena pyriformis[J].Protist, 157(2): 193-203.
Guo LN, Fu CJ, Miao W. 2008. Cloning, characterization, and gene expression analysis of a novel cadmium metallothionein gene inTetrahymena pigmentosa[J].Gene, 423(1): 29-35.
Haq F, Mahoney M, Koropatnick J. 2003. Signaling events for metallothionein induction [J].Mutat Res, 533(1-2): 211-226.
Imbert J, Culotta V, Furst P, Gedamu L, Hamer D. 1990. Regulation of metallothionein gene transcription by metals [J].Adv Inorg Biochem, 8: 139-164.
Innan H, Kondrashov F. 2010. The Evolution of gene duplications: Classifying and distinguishing between models [J].Nat Rev Genet, 11(2): 97-108.
Kagi JHR. 1993. Evolution, Structure and Chemical Activity of Class-I Metallothioneins - an Overview [M]//Suzuki KT, Imura N, Kimura M. Metallothionein III - Biological Roles and Medical Implications. Basel: Birkhauser Verlag, 29-55.
Kramer KK, Liu J, Choudhuri S, Klaassen CD. 1996. Induction of metallothionein mrna and protein in murine astrocyte cultures [J].Toxicol Appl Pharm, 136(1): 94-100.
Liu J, Klaassen CD. 1996. Absorption and distribution of cadmium in metallothionein-I transgenic mice [J].Fund Appl Toxicol, 29(2): 294-300.
Miao W, Xiong J, Bowen J, Wang W, Liu YF, Braguinets O, Grigull J, Pearlman RE, Orias E, Gorovsky MA. 2009. Microarray analyses of gene expression during theTetrahymena thermophilalife cycle [J].PLoS One, 4(2): e4429.
Miles AT, Hawksworth GM, Beattie JH, Rodilla V. 2000. Induction, regulation, degradation, and biological significance of mammalian metallothioneins [J].Crit Rev Biochem Mol, 35(1): 35-70.
Nei M, Gojobori T. 1986. Simple methods for estimating the numbers of synonymous and nonsynonymous nucleotidesubstitutions [J].Mol Biol Evol, 3(5): 418-426.
Nilsson JR. 1989. Tetrahymena in cytotoxicology - with special reference to effects of heavy-metals and selected drugs [J].Eur J Protistol, 25(1): 2-25.
Niu J, Azfer A, Kolattukudy PE. 2006. Monocyte-specific Bcl-2 expression attenuates inflammation and heart failure in monocyte chemoattractant protein-1 (MCP-1)-iduced cardiomyopathy [J].Cardiovasc Res, 71(1): 139-148.
Ostrakhovitch EA, Olsson PE, Jiang S, Cherian MG. 2006. Interaction of metallothionein with tumor suppressor P53 protein [J].FEBS Lett, 580(5): 1235-1238.
Pfaffl MW, Horgan GW, Dempfle L. 2002. Relative expression software tool (Rest (C)) for group-wise comparison and statistical analysis of relative expression results in real-time PCR [J].Nucleic Acids Res, 30(9): e36.
Piccinni E, Bertaggia D, Santovito G, Miceli C, Kraev A. 1999. Cadmium metallothionein gene ofTetrahymena pyriformis[J].Gene, 234(1): 51-59.
Piccinni E, Staudenmann W, Albergoni V, Degabrieli R, James P. 1994. Purification and primary structure of metallothioneins induced by cadmium in the protistsTetrahymena pigmentosaandTetrahymena pyriformis[J].Eur J Biochem, 226(3): 853-859.
Santovito G, Formigari A, Boldrin F, Piccinni E. 2007. Molecular and functional evolution of tetrahymena metallothioneins: New insights into the gene family ofTetrahymena thermophila[J].Comp Biochem Phys C, 144(4): 391-397.
Santovito G, Irato P, Palermo S, Boldrin F, Hunziker P, Piccinni E. 2001. Identification, cloning and characterisation of a novel copper-metallothionein inTetrahymena pigmentosa. Sequencing of cDNA and expression [J].Protist, 152(3): 219-229.
Shang YH, Song XY, Bowen J, Corstanje R, Gao Y, Gaertig J, Gorovsky MA. 2002. A robust inducible-repressible promoter greatly facilitates gene knockouts, conditional expression, and overexpression of homologous and heterologous genes inTetrahymena thermophila[J].Proc Natl Acad Sci USA, 99(6): 3734-3739.
Shaulian E, Karin M. 2002. AP-1 as a regulator of cell life and death [J].Nat Cell Biol, 4(5): e131-e136.
Stuart GW, Searle PF, Palmiter RD. 1985. Identification of multiple metal regulatory elements in mouse metallothionein-I promoter by assaying synthetic sequences [J].Nature, 317(6040): 828-831.
Syring RA, Brouwer TH, Brouwer M. 2000. Cloning and sequencing of cdnas encoding for a novel copper-specific metallothionein and two cadmium-inducible metallothioneins from the blue crabCallinectes Sapidus[J].Comp Biochem Physiol C: Pharm Toxic Endocrin, 125(3): 325-332.
Thiele DJ. 1992. Metal-regulated transcription in eukaryotes [J].Nucleic Acids Res, 20(6): 1183-1191.
Wu AL, Wemmie JA, Edgington NP, Goebl M, Guevara JL, Moyerowley WS. 1993. Yeast bZip proteins mediate pleiotropic drug and metal resistance [J].J Biol Chem, 268(25): 18850-18858.
Xiong J, Lu X, Lu Y, Zeng H, Yuan D, Feng L, Chang Y, Bowen J, Gorovsky M, Fu C, Miao W. 2011.Tetrahymenagene expression database (TGED): A resource of microarray data and co-expression analyses forTetrahymena[J].Sci Chn: Life Sci, 54(1): 65-67.
Yang ZH. 2007. Paml 4: Phylogenetic analysis by maximum likelihood [J].Mol Biol Evol, 24(8): 1586-1591.
Zhou L, Wang Y, Gui JF. 2006. Fish-specific genome duplication [J].Zool Res, 27(5): 525-532. [周莉, 汪洋, 桂建芳. 2006. 魚類特異的基因組復(fù)制. 動物學(xué)研究, 27(5): 525-532.]
Function comparison and evolution analysis of metallothionein geneMTT2andMTT4inTetrahymena thermophila
CHANG Yue1,3, FENG Li-Fang1,2, XIONG Jie1,3, MIAO Wei1,*
(1. State Key Laboratory of Freshwater Ecology and Biotechnology,Institute of Hydrobiology,the Chinese Academy of Sciences,Wuhan430072,China; 2. College of Food Science and Biotechnology,Zhejiang Gongshang University,Hangzhou310035,China;3. Graduate School of the Chinese Academy of Sciences,Beijing100049,China)
Tetrahymenahas a high genetic polymorphism of metallothionein proteins. These protein isoforms can be divided into subfamilies 7a and 7b. We used real-time quantitative PCR to test the expression levels ofTetrahymena thermophilametallothionein genesMTT2andMTT4after exposure to different inducers, including Hg, Cu, Cd, Zn and H2O2. Both genes were most efficiently induced by Cu and secondly by Hg. Their expression was slightly up-regulated after exposure to Cd and Zn, but down-regulated by H2O2. The expression pattern differed from those reported in the 7a subfamily, but was consistent with 7b subfamily members. However, the induced expression level ofMTT4was much higher than that ofMTT2, which might be due to differences in their upstream regulatory elements (AP-1, MRE). The high similarities in gene structures and functions indicate thatMTT2andMTT4were generated by recent gene duplication following the dosage balance model.
Tetrahymena thermophila; Metallothionein gene; Real-time quantitative PCR; Expression analysis; Gene duplication
Q959.117; Q513
A
0254-5853-(2011)05-0476-09
10.3724/SP.J.1141.2011.05476
2011-03-01;接受日期:2011-07-13
武漢市學(xué)科帶頭人項目(201051730561)
?通訊作者(Corresponding author),E-mail: miaowei@ihb.ac.cn
- Zoological Research的其它文章
- 白眉山鷓鴣冬季覓食地選擇
- Association of RELN promoter SNPs with schizophrenia in the Chinese population
- Decreased contrast sensitivity of visual cortical cells to visual stimuli accompanies a reduction of intracortical inhibition in old cats
- Complete mitochondrial genome of the laced fritillary Argyreus hyperbius (Lepidoptera: Nymphalidae)
- Possible genetic reproductive isolation between two tilapiine genera and species: Oreochromis niloticus and Sarotherodonmelanotheron
- A new blind loach species, Triplophysa huanjiangensis (Teleostei: Balitoridae), from Guangxi, China

