濕法煙氣脫硫石膏制備硫酸銨
譚文軼,郭菲菲,曹 鵬,趙 蘭,閆懷晴
(南京工程學院 環境工程系,江蘇 南京 211167)
濕法煙氣脫硫石膏制備硫酸銨
譚文軼,郭菲菲,曹 鵬,趙 蘭,閆懷晴
(南京工程學院 環境工程系,江蘇 南京 211167)
采用濕法煙氣脫硫石膏為原料,與(NH4)2CO3反應,制備(NH4)2SO4。通過X射線衍射儀表征可知:脫硫石膏的主要成分為CaSO4,反應后CaSO4中的Ca2+大部分以CaCO3形式存在于固體沉淀物中,CaCO3粉末平均粒徑為80 nm;而原先CaSO4中的不溶性SO2-4則與NH+4結合生成(NH4)2SO4,后者以可溶性SO2-4的形式進入液相。脫硫石膏制備(NH4)2SO4的最佳反應條件:反應時間為1.5 h,反應溫度為40℃,攪拌轉速為300 r/min,n(CO2-3)∶n(SO2-4)為1.2,在此最佳條件下CaSO4轉化率為87.4%。
濕法煙氣脫硫;石膏;硫酸銨;綜合利用
在現有的煙氣脫硫方法中,石灰石-石膏法最為成熟,工業應用也最為廣泛。但石灰石-石膏法的廣泛應用產生了大量的脫硫石膏[1]。目前,由于煙氣脫硫實際運行效果常常不甚理想,同時對脫硫石膏中水分、氯離子含量等要求逐漸嚴格,限制了脫硫石膏作為水泥、石膏板原材料及農業等方面的利用[2-5]。大量的脫硫石膏如果不進行有效利用,將成為繼粉煤灰后火電廠的又一大固體廢物。目前已有以磷石膏為原料制取 K2SO4的報道[6-7]。
本工作研究了以脫硫石膏為原料制取K2SO4的第一步反應——制備(NH4)2SO4的工藝影響因素。
1 實驗部分
1.1 原料、試劑和儀器
脫硫石膏為某電廠石灰石-石膏法煙氣脫硫的副產物,主要成分為CaSO4·2H2O,其化學成分見表1。
實驗所用藥品均為分析純。
Bruker D8 ADVANCE型X射線衍射(XRD)儀:掃描速率 5(°)/min,CuKa,λ =0.154 05 nm;測試電壓40 kV,測試電流20 mA,德國Bruker公司。SHZ-D(Ⅲ)型循環水多用真空泵:鞏義英峪儀器廠。

表1 脫硫石膏的化學成分
1.2 脫硫石膏的預處理及(NH4)2SO4的制備
將脫硫石膏過200目篩網,烘干。稱取19.2 g(NH4)2CO3溶解在500 mL的蒸餾水中,配制成(NH4)2CO3溶液。將一定量的脫硫石膏加入(NH4)2CO3溶液中制成混合物,將混合物轉移至反應瓶中,在一定攪拌轉速下升溫至預設反應溫度,溶液成懸濁態。
反應完成后,將反應物冷卻至室溫,抽濾,將濾餅烘干,記為濾餅1。為了證明CaSO4中的SO2-4進入了液相,取部分濾液,加入BaCl2,將所得沉淀過濾,將濾餅烘干,記為濾餅2。
1.3 分析方法
采用文獻[8-9]的方法分析脫硫石膏的成分。考慮到反應物和產物為CaSO4和CaCO3的混合物,根據 GB19281—2003《超微細碳酸鈣》[10]測定反應前后固體物質中CaCO3的質量,來間接表示脫硫石膏中CaSO4的轉化率。
2 結果與討論
2.1 反應物和產物的XRD分析
脫硫石膏、濾餅1和濾餅2的XRD譜圖分別見圖1~圖3。與標準譜圖對比,由圖1可見,脫硫石膏與天然石膏的特征衍射峰位置相差不大。由圖2可見,濾餅1與CaCO3標準試樣的特征衍射峰位置相同,說明濾餅1中的主要成分是CaCO3,通過Sherrer公式計算所生成的CaCO3平均粒徑為80 nm。由圖3可見,濾餅2與BaSO4標準試樣的特征衍射峰位置非常吻合。XRD結果說明,CaSO4中的 Ca2+大部分轉化為 CaCO3形式存在,而原先CaSO4中的不溶性SO24-則以可溶性SO24-的形式進入液相,與 NH4+結合生成(NH4)2SO4。
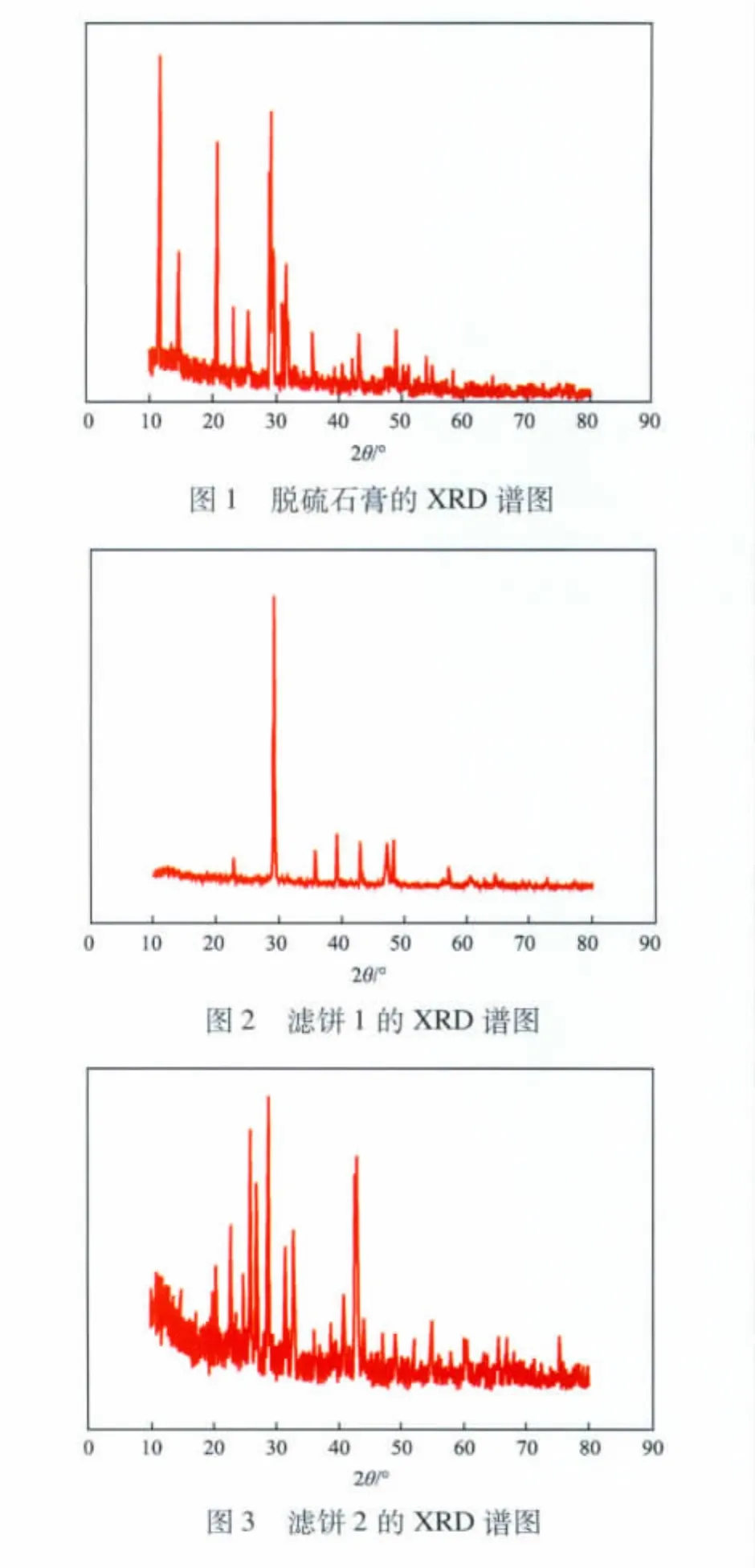
2.2 反應時間對CaSO4轉化率的影響
在反應溫度為60℃、攪拌轉速為300 r/min、n(CO2-3)∶n(SO2-4)為1.2的條件下,反應時間對CaSO4轉化率的影響見圖4。由圖4可見:隨反應時間的增加,脫硫石膏中CaSO4轉化率逐漸提高;反應1.5 h后,轉化率增加幅度不大。這說明反應1.5 h后,反應基本完成,故本實驗適宜的反應時間為1.5 h。
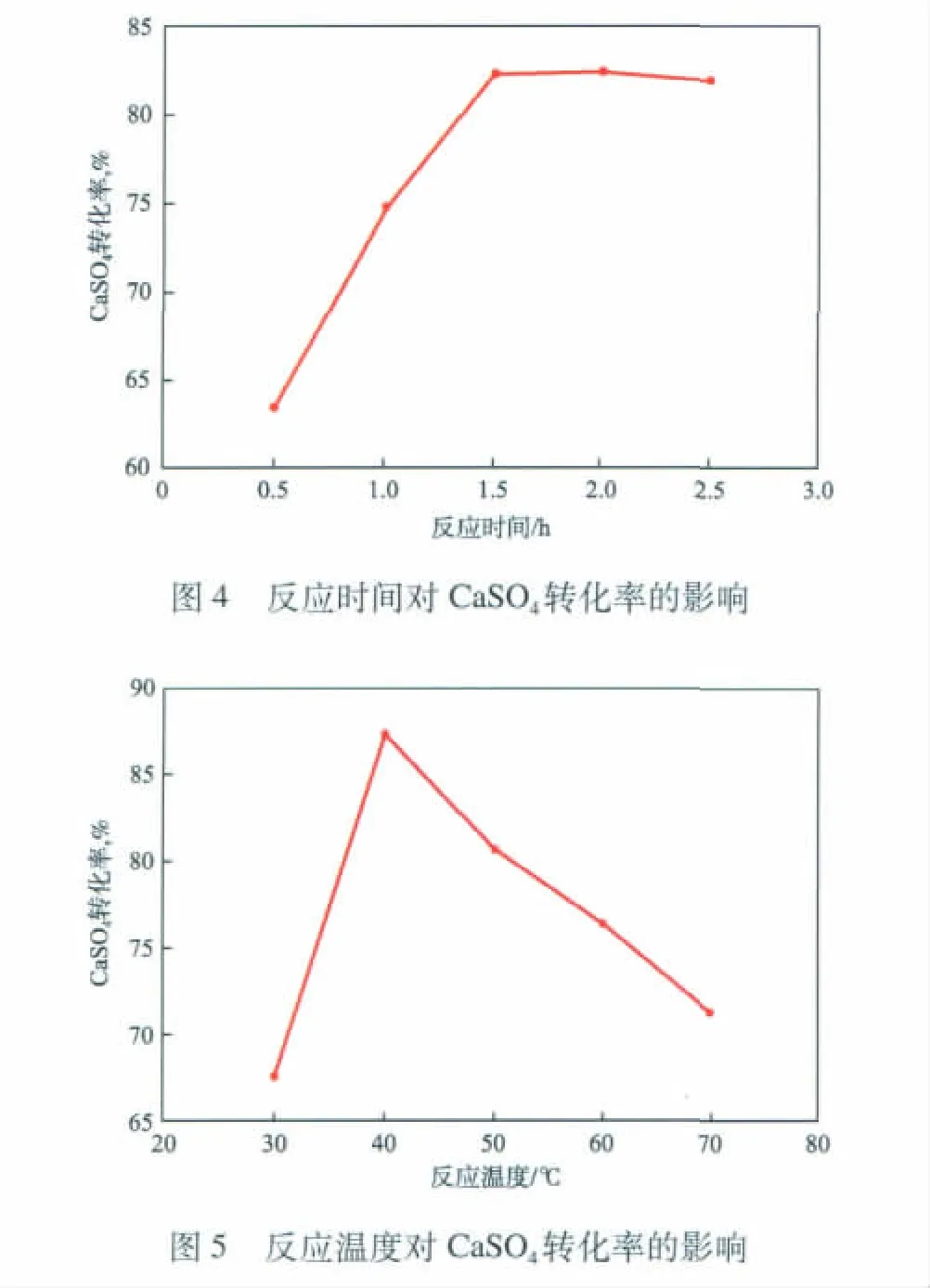
2.3 反應溫度對CaSO4轉化率的影響
在反應時間為1.5 h、攪拌轉速為300 r/min、n(CO23-)∶n(SO24-)為1.2的條件下,反應溫度對CaSO4轉化率的影響見圖5。由圖5可見:隨反應溫度升高,反應物分子的熱運動加快,CaSO4轉化率提高;反應溫度高于40℃后,(NH4)2CO3受熱易分解,且該反應是放熱反應,隨溫度升高反應速率反而降低,CaSO4轉化率也隨之降低。因為CaSO4的溶解度在常壓下隨溫度升高先升后降,故反應溫度對反應的影響較為復雜,本實驗最佳反應溫度為40℃。
2.4 n(CO23-)∶n(SO24-)對CaSO4轉化率的影響
在反應溫度為40℃、反應時間為1.5 h、攪拌轉速為300 r/min的條件下,n(CO23-)∶n(SO24-)對CaSO4轉化率的影響見圖6。
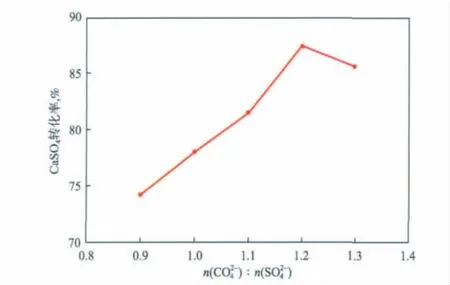
圖6n(CO2-3)∶n(SO2-4)對CaSO4轉化率的影響
由圖6可見:隨n(CO23-)∶n(SO24-)增大,CaSO4轉化率線性增大;當n(CO23-)∶n(SO24-)為1.2時,CaSO4轉化率最高,達87.4%。根據理論計算,最佳 n(CO23-)∶n(SO24-)應為 1.0,而實驗的最佳n(CO23-)∶n(SO24-)為 1.2。這是因為,CaSO4的溶度積為4.93 ×10-5,CaCO3的溶度積[11]為 3.36 ×10-9,CaCO3比 CaSO4更難溶解[12-13],同時,在相同濃度條件下,由CaSO4溶解貢獻出來的SO24-將會遠多于CaCO3溶解貢獻的CO23-。但是由于(NH4)2CO3屬于弱酸弱堿鹽,其水解后不僅含有CO23-還會產生HCO3-,即CO23-會有所減少。因此,加入的(NH4)2CO3的物質的量需要略多一些。
2.5 攪拌轉速對CaSO4轉化率的影響
在反應溫度為 40℃、反應時間為 1.5 h、n(CO2-3)∶n(SO2-4)為1.2的條件下,攪拌轉速對CaSO4轉化率的影響見圖7。由圖7可見:隨攪拌轉速增加,CaSO4轉化率增大;攪拌轉速大于 300 r/min后,CaSO4轉化率增加不明顯。這是因為:反應裝置中湍動程度隨攪拌轉速的增加而愈發劇烈,反應物得以均勻分布,同時,較快的攪拌轉速能夠促進CaSO4的溶解;當攪拌轉速達到300 r/min時,CaSO4轉化率基本保持不變,此時CaSO4溶解達到一定的平衡,參與反應的Ca2+和SO2-4在溶液中的分布也逐漸保持恒定。
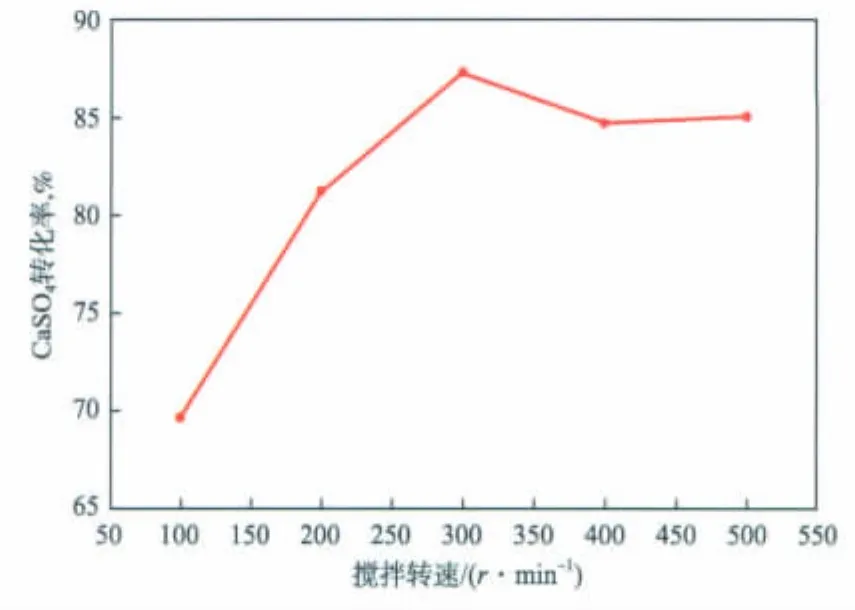
圖7 攪拌轉速對CaSO4轉化率的影響
3 結論
a)采用脫硫石膏為原料,與(NH4)2CO3反應,制備(NH4)2SO4。通過XRD表征可知:脫硫石膏的主要成分為CaSO4,反應后CaSO4中的Ca2+大部分以CaCO3形式存在于固體沉淀物中,CaCO3粉末平均粒徑為80 nm;而原先CaSO4中的不溶性SO24-則以可溶性SO24-的形式進入液相,與NH4+結合生成(NH4)2SO4。
b)脫硫石膏制備(NH4)2SO4的最佳反應條件:反應時間為1.5 h,反應溫度為40℃,攪拌轉速為300 r/min,n(CO23-)∶n(SO24-)為 1.2,在此最佳條件下CaSO4轉化率為87.4%。
[1] 金晶,羅慶明,胡華龍.燃煤電廠脫硫石膏產生量分析研究[J].環境與可持續發展,2008,(5):21-23.
[2] 田賀忠,郝吉明,趙喆,等.燃煤電廠煙氣脫硫石膏綜合利用途徑及潛力分析[J].中國電力,2006,(2):3-6.
[3] 耿春女,錢華,李小平,等.脫硫石膏農業利用研究進展與展望[J].環境污染治理技術與設備,2006,7(12):15-19.
[4] Tzouvalas G,Rantis G,Tsimas S.Alternative calciumsulfate-bearing materials as cement retarders:PartⅡ.FGD gypsum[J].Cement Concrete Res,2004,34:2119-2125.
[5] 葉蓓紅,談曉青.我國脫硫石膏與脫硫建筑石膏質量問題及成因分析[J].粉煤灰,2009,(6):38-40.
[6] 張萬福.利用磷石膏制硫酸銨的工程化分析[J].化學工程,2009,(11):2 -6.
[7] 黃頌安,許振良,汪瑾.石膏和碳銨母液制取硫酸銨的工藝研究[J].化肥工業,1990,17(5):3-5.
[8] 周志祥,段建中,薛建明.火電廠濕法煙氣脫硫技術手冊[M].北京:中國電力出版社,2006:301-320.
[9] Laperche V,Bigham J M.Quantitative,chemical and mineralogical characterization of flue gas desulfurization by-production[J].J Environ Quality,2002,31:979 -988.
[10] 國家質量監督檢驗檢疫總局.GB19281—2003超微細碳酸鈣[S].北京:中國標準出版社,2003.
[11] 楊宏孝.無機化學[M].第3版.北京:高等教育出版社,2002:157-177.
[12] Chong T H,Sheikholeslami R.Thermodynamics and kinetics for mixed calcium carbonate and calcium sulfate precipitation[J].Chem Eng Sci,2001,56:5391-5400.
[13] Michael S,Roya S.Coprecipitation of CaCO3and CaSO4[J].Can J Chem Eng,2000,(2):21 - 31.
Preparation of Ammonium Sulfate from Wet Flue Gas Desulfurization Gypsum
Tan Wenyi,Guo Feifei,Cao Peng,Zhao Lan,Yan Huaiqing
(Department of Environmental Engineering,Nanjing Institute of Technology,Nanjing Jiangsu 211167,China)
(NH4)2SO4was prepared by the reaction of wet flue gas desulfurization gypsum with(NH4)2CO3.The XRD characterization results indicate that:After reaction,the most of Ca2+in CaSO4,which is the chief constituent of the gypsum,are presented in the solid precipitate in the form of CaCO3with 80 nm of average diameter;However,the insoluble SO2-4in CaSO4reacts with NH+4and turn into(NH4)2SO4,so it can enter into the liquid-phase in the form of soluble SO2-4.Under the optimum reaction conditions of reaction time 1.5 h,reaction temperature 40 ℃,stirring speed 300 r/min and n(CO2-3)∶n(SO2-4)=1.2,the CaSO4conversion rate is 87.4%.
wet flue gas desulfurization;gypsum;ammonium sulfate;comprehensive utilization
X705
A
1006-1878(2011)03-0252-04
2010-12-09;
2011-01-17。
譚文軼(1980—),男,江西省九江市人,博士,副教授,主要從事大氣污染控制方面的研究。電話025-86118973,電郵 twy@njit.edu.cn。
江蘇省教育廳“青藍工程”資助項目(2008-30);2010年江蘇省高等學校大學生實踐創新項目(166201100023)。
(編輯 祖國紅)

