豬膽汁中鵝去氧膽酸提取工藝的研究
曹榮安 ,李良玉 ,張麗萍 ,*
(1.黑龍江八一農墾大學食品學院,黑龍江 大慶 163319;2.黑龍江農產品加工工程技術研究中心,黑龍江 大慶 163319)
豬膽汁中鵝去氧膽酸提取工藝的研究
曹榮安1,李良玉2,張麗萍1,*
(1.黑龍江八一農墾大學食品學院,黑龍江 大慶 163319;2.黑龍江農產品加工工程技術研究中心,黑龍江 大慶 163319)
以提取出膽紅素的豬膽粉為原料,研究了反應溫度、pH、CaCl2添加量、反應時間對CDCA純度的影響,實驗顯示:反應溫度為45℃、樣品pH為10.5、CaCl2添加量為樣品質量的10%、反應時間為2h,鵝去氧膽酸純度達到47.05%。
豬膽汁;鵝去氧膽酸;提取
鵝去氧膽酸(chenodeoxycholic acid,CDCA),又稱3α,7α-二羥基-5β-膽烷酸,是動物體膽汁中的一種生化物質。CDCA為無色針狀結晶,無臭、味苦,幾乎不溶于水,易溶于乙醇、冰乙酸、微溶于氯仿[1-3],在臨床上主要用于治療膽結石癥,尤其對膽固醇膽結石有很好的溶解作用,還具有顯著的平喘、抗炎、鎮咳和祛痰作用。本研究采用膽紅素和膽酸聯產工藝方案,以膽汁提取膽紅素生產過程中的濾去膽鈣鹽的母液為原料,采用CaCl2為沉淀劑進行鵝去氧膽酸提取工藝研究[4-8]。
1 材料與方法
1.1 材料
1.1.1 材料與試劑
新鮮豬膽:采購自大慶金鑼公司;鵝去氧膽酸標準品:中國藥品生物制品檢定所;氫氧化鈉、氯化鈣、鹽酸、乙酸乙酯、氨水:均為分析純,沈陽市華東化學試劑廠。
1.1.2 主要儀器
恒溫水浴箱:上海森信實驗儀器有限公司;MD100-2電子分析天平:沈陽華騰電子有限公司;烘干箱:天津市泰斯特儀器有限公司;島津UV-260紫外分光光度計。
1.2 方法
1.2.1 豬膽汁預處理
豬膽汁提取膽紅素后剩余的母液烘干成膽粉[9-11]。
1.2.2 實驗方案
膽粉→加水→15%NaOH調pH→加氯化鈣→水洗沉淀→清液加鹽酸調pH→水洗沉淀至中性→烘干→鵝去氧膽酸粗品
1.2.3 CDCA的測定[12-15]
1.2.3.1 標準曲線的繪制
精密量取CDCA標準品12.5 mg,置于25 mL容量瓶中,加入60%醋酸定容,搖勻,精密量取0.2、0.4、0.6、0.8、1.0 mL分別置帶塞試管中,用60%醋酸溶液稀釋1.0 mL,加1%糠醛溶液1 mL,在冰浴中放置5 min,加硫酸溶液[V(H2SO4):V(H2O)=50:65]13 mL 混勻,在70℃水浴中加熱10 min迅速移至冰浴中放置2 min取出,以相應試劑為空白,在380 nm波長處紫外分光光度計測定吸光度,根據吸光光度值繪出標準曲線圖,并計算R2值。CDCA測定的標準曲線圖見圖1。
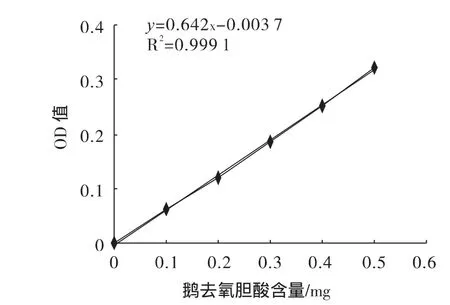
圖1 鵝去氧膽酸標準曲線Fig.1 The standard curve of CDCA determination
1.2.3.2 粗品CDCA的測定
精密稱取樣品12.5 mg,加60%醋酸液適量,充分攪拌,移入25 mL容量瓶中,殘渣再用60%醋酸液攪拌,全部移入容量瓶中并稀釋至25 mL,精密量取溶液1 mL,置于試管中加1%糠醛液1 mL,在冰浴中放置5 min,加[V(H2SO4):V(H2O)=50:65]硫酸溶液 13 mL 混勻,在70℃水浴中加熱10 min,迅速移至冰浴中放置2 min,取出,以相應試劑為空白,紫外分光光度計在380 nm波長處測定吸光度,根據吸光度計算樣品中CDCA的含量。
2 結果與討論
2.1 反應溫度對CDCA純度的影響
準確稱取5份10 g膽粉加50 mL蒸餾水,用15%的NaOH調pH至10.5,CaCl2添加量為10%,設置反應溫度為 35、40、45、50、55 ℃ 5 個水平,反應時間 1 h,再根據實驗方案進行水洗、調pH和烘干處理。測定膽粉中CDCA的含量,根據所得數據繪制出水浴溫度與CDCA純度的關系圖,見圖2。

圖2 反應溫度與鵝去氧膽酸純度關系圖Fig.2 The relation between different temperature and the purity of CDCA
由圖2可以看出,隨著反應溫度的升高CDCA純度顯著提高(p<0.05),當溫度為45℃時CDCA純度最高。這是由于溫度在低于45℃時,反應不完全;溫度高于45℃時可能是分子運動過于活躍,不容易形成膽酸鈣鹽,因此選擇40、45、50℃為提取CDCA的最佳反應溫度。
2.2 樣品pH對CDCA純度的影響
準確稱取5份10 g膽粉加50 mL蒸餾水,用15%的 NaOH 分別把樣品 pH 調至 8.5、9.5、10.5、11.5、12.55個水平,CaCl2添加量為10%,50℃水浴1 h,再根據實驗方案進行水洗、調pH和烘干處理。測定膽粉中CDCA的含量,根據所得數據繪制出樣品pH與CDCA純度的關系圖,見圖3。
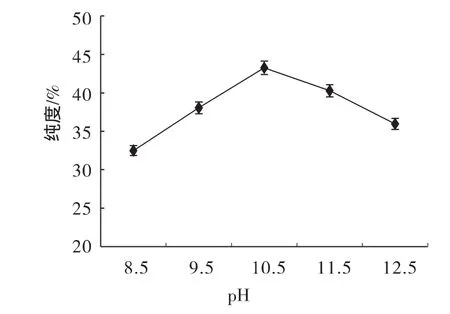
圖3 樣品pH與鵝去氧膽酸純度關系圖Fig.3 The relation between different pH and the purity of CDCA
由圖3可以看出,隨著pH值的增加CDCA的純度顯著提高(p<0.05),在pH為10.5時CDCA純度最高,之后隨著pH的增加CDCD純度顯著降低(p<0.05)。這是由于膽酸在堿性條件溶解度較大,隨著pH的升高溶解度逐漸增加,但在pH達到10.5后膽酸分子遭到破壞使膽酸含量降低。因此9.5、10.5、11.5為提取CDCA的最佳pH。
2.3 CaCl2添加量對CDCA純度的影響
準確稱取5份10 g膽粉加50 mL蒸餾水,用15%的NaOH調pH至10.5,CaCl2添加量為6%、8%、10%、12%、14%5個水平,在50℃下水浴處理時間1 h,再根據實驗方案進行水洗、調pH和烘干處理。測定膽粉中CDCA的含量,繪制出CaCl2添加量與CDCA純度的關系圖,見圖4。
由圖4可以看出,添加量為6%~8%時CDCA純度顯著提高(p<0.05),10%時 CDCA 的純度最高,添加量高于12%純度提高趨于平緩,差異不顯著(p>0.05)。因此,添加8%、10%、12%時為提取CDCA的CaCl2最佳添加量。
2.4 反應時間對CDCA純度的影響

圖4 氯化鈣添加量與鵝去氧膽酸純度的關系圖Fig.4 The relation between CaCl2and the purity of CDCA
準確稱取5份10 g膽粉加50 mL蒸餾水,用15%的NaOH調pH至10.5,CaCl2添加量為10%,水浴溫度為 50 ℃,分別選擇反應時間為 0.5、1.0、1.5、2.0、2.5 h,再根據實驗方案進行水洗、調pH和烘干處理。測定膽粉中CDCA的含量,根據所得數據繪制出反應時間與CDCA純度的關系曲線圖,見圖5。
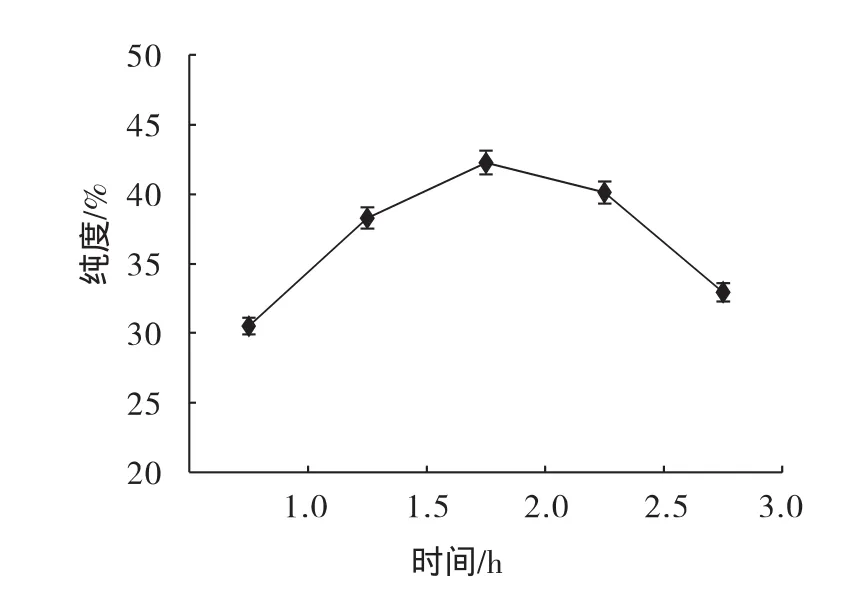
圖5 氯化鈣反應時間與鵝去氧膽酸純度的關系圖Fig.5 The relation between different time and the purity of CDCA
由圖5可以看出,隨著反應時間的增加CDCA純度顯著提高(p<0.05),反應時間為2 h時CDCA純度最高,之后隨著反應時間的增加CDCA純度顯著下降(p<0.05)。反應時間小于2 h時,反應不完全;反應時間大于2 h時,由于時間過長使膽酸分子遭到破壞,CDCA純度降低。因此2 h為提取CDCA的最佳反應時間。
2.5 CDCA提取正交試驗
根據單因素試驗結果進行正交試驗,因素水平表見表1,正交試驗結果見表2。

表1 因素水平表Table 1 The table of factor levels
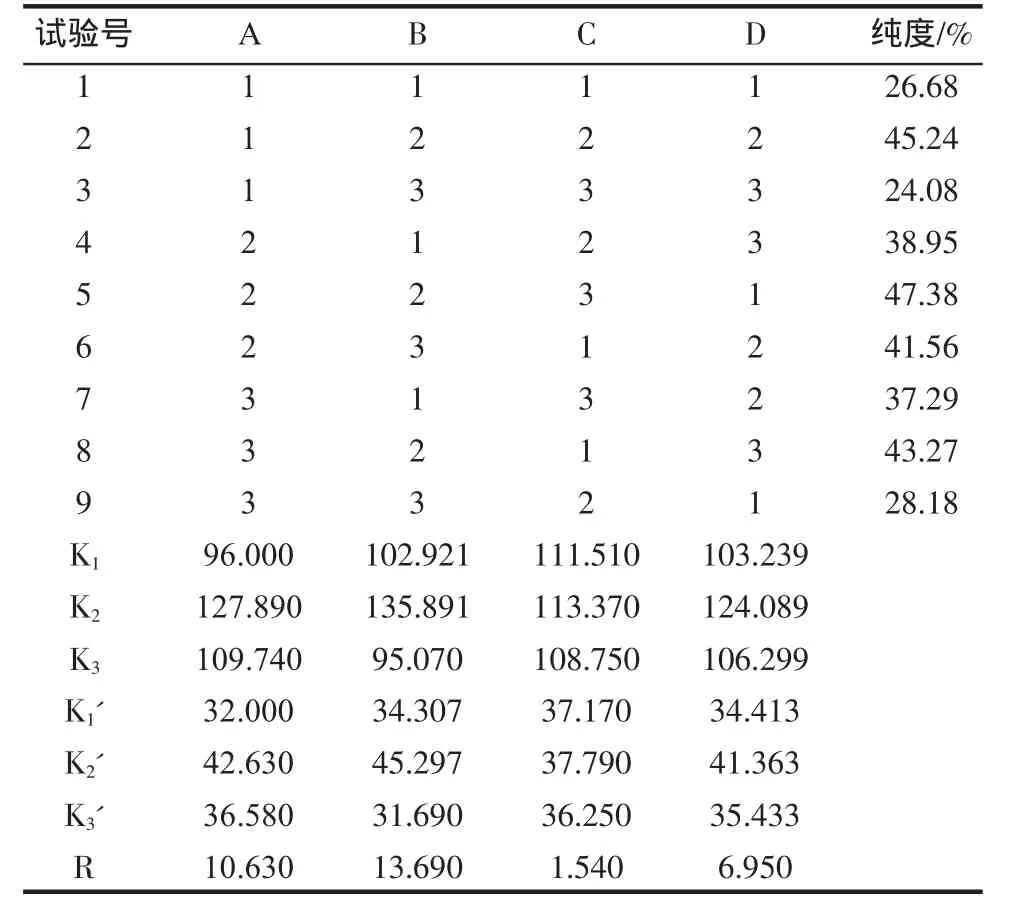
表2 正交試驗結果表Table 2 Scheme and results of regression orthogonal rotary design
根據試驗結果進行方差分析見表3,結果顯示:A因素F值為47.330,大于在0.05水平上的F統計量的值,因此因素A(反應溫度)對試驗的影響顯著(p<0.05);B因素F值為99.256,大于在0.01水平上的F統計量的值,因此因素B(樣品pH)對試驗的影響極顯著(p<0.01);D 因素 F值為23.448,大于在 0.05水平上的F統計量的值,因此因素D(反應時間)對試驗的影響顯著(p<0.05)。為確定最佳的工藝參數對因素A、B、D進行多重比較,見表4~表7。

表3 方差分析表Table 3 The table of ANOVA

表4 多重比較SSR及LSR值表Table 4 The SSR and LSR of multiple comparison

表5 反應溫度多重比較Table 5 The multiple comparison of temperature
由表5可以看出,A因素K2-K3=6.050>LSR0.05=4.0876,所以 A2,A3差異顯著,因此 A2最好。

表6 樣品pH多重比較Table 6 The multiple comparison of pH
由表6可以看出,B因素K2-K3=10.99>LSR0.01=9.3970,所以 B2,B1差異顯著,因此 B2最好。

表7 反應時間因素多重比較Table 7 The multiple comparison of time
由表7可以看出,B因素K2-K3=5.930>LSR0.05=4.0876,所以 D2,D3差異顯著,因此 D2最好。
由于C因素對試驗影響較小,所以選擇低能耗的C1(8%)。經多重比較分析后,最佳的工藝參數為A2B2C1D2,即為:反應溫度為50℃,樣品pH為10.5,CaCl2添加量為8%,反應時間為2.0 h。用正交試驗得出的最佳工藝參數A2B2C1D2作驗證試驗,設平行樣3組,以提取率為指標,結果顯CDCA的平均純度為47.05%,且重復實驗相對偏差不超過2%,說明試驗條件重現性良好。
3 結論
通過以上試驗數據證明,在單因素的基礎上以CDCA純度為指標,對反應溫度、pH、CaCl2添加量、反應時間4個因素進行L9(43)正交試驗。確定出最佳提取條件:反應溫度為45℃,樣品pH為10.5,CaCl2添加量為8%,反應時間為2.0 h,純度達到47.05%。
采用CaCl2為沉淀劑提取CDCA的方法研究豬膽汁中CDCA的提取工藝,通過正交試驗得到了最佳的提取工藝條件,為對動物膽汁進行提取純化及加工生產開辟了一條新的切實可行的途徑;其工藝簡單易行,適合工業化生產;同時也達到了進一步提高畜禽副產物附加值的作用。
[1]潘現軍.從豬膽膏中分離純化鵝去氧膽酸的新工藝[J].河北醫藥,2006,28(2):147-148
[2]都麗莉.具有開發價值的動物膽汁的藥用研究[J].中國醫學學報,2000,15(1):27-28
[3]郝麗莉,趙文靜.動物膽汁的藥用研究[J].中國民族民間醫藥雜志,1999,(40):279-280
[4]張天民.動物生化制藥學[M].北京:北京人民出版社,1981:259-266
[5]張宗信,蓋雪.動物膽汁藥的應用[J].河北醫學,2006,12(2):191-192
[6]郭文.膽汁酸代謝的進展[J].國外醫學生理病理科學與臨床分冊,1996,16(1):18-20
[7]陳懷慶,譚子平.豬膽汁中膽紅素和膽酸含量的測定[J].時珍國醫國藥,2001,12(40):315-334
[8]王有同,吳文俊.CDCA的制備[J].農副產品加工,1995,13(2):39-40
[9]高玉瓊,劉建華.CDCA制備新工藝[J].中國生化藥物雜志,1996,17(1):17-18
[10]羅小明,吳思維.豬膽汁中CDCA的提取[J].重慶廣播電視大學學報,1999,9(5):46-48
[11]呂軍,趙松華.HDCA精品的生產工藝[J].中國藥業,1999,4(1):27-28
[12]丁新騰.從豬膽汁提取鵝去氧膽酸及豬膽酸[J].醫藥工業,1987,18(9):416
[13]吳健.豬膽汁中膽酸的分離研究[J].貴陽醫學院學報,1991,16(1):50-51
[14]張德桐,張能容.雞膽汁與蛇膽汁組分的對比研究[J].中國生化藥物雜志,1994,15(10):4-7
[15]吳健.豬膽汁中膽酸的分離研究[J].貴陽醫學院學報,1991,16(1):50-51
Study on the Extraction Technology of Chenodeoxycholic Acid from Porcine Bile
CAO Rong-an1,LI Liang-yu2,ZHANG Li-ping1,*
(1.Heilongjiang August First Agricultural Reclamation University Food College,Daqing 163319,Heilongjiang,China;2.HLJ Agricultural Food Process Engineering and Technological Research Center,Daqing 163319,Heilongjiang,China)
This experimental uses the production which is extracted bilirubin,selects temperature,pH,concentration of CaCl2and time as the factors.The result shows that the optimal extraction method is temperature 45℃,pH 10.5,concentration of CaCl210%,time 2 h.The purity of CDCA is 47.05%.
porcine bile;CDCA;extraction
黑龍江省農墾總局《大鵝系列快餐化食品及其副產物綜合利用技術研究》(HNKXIV-08-11)
曹榮安(1980—),男(漢),講師,碩士,研究方向:畜產品加工。*通信作者
2010-08-06

