HPLC測定不同方法提取的山黧豆中β-ODAP
趙興秀,何義國,鄧靜,方春玉,孟延發
(1.四川理工學院 生物工程系,四川 自貢 643000;2.四川大學 生命科學學院,四川 成都 610064)
山黧豆(Lathyrus sativus L.)屬豆科蝶形花亞科山黧豆屬一年生作物,在全世界有廣泛的種植,是人畜都可食用的豆科植物。其對環境具有廣泛的適應性:耐寒、耐旱、抗蟲害,尤其在干旱年份,在其他豆類及谷物都絕收時,它仍能維持一定的產量,是適合于干旱、半干旱地區種植的作物。山黧豆營養豐富,種子中蛋白質含量高達25%~28%,近似于小麥2倍,淀粉含量為55%~61%。而且蛋白質水解產物含有哺乳動物所需的17種主要的α-氨基酸[1],所以是比較理想的高蛋白豆科飼料作物。但山黧豆籽實內含有一種非蛋白質氨基酸β-N-草酰基-α,β-二氨基丙酸(β-N-oxalyl-α,β-diaminopropionic,簡稱β-ODAP),是一種主要的毒素[2-3],長期食用可引起下肢癱瘓,稱為山黧豆中毒,從而妨礙了山黧豆的推廣和種植。更進一步的研究顯示,山黧豆中還存在著β-ODAP的另一種異構體,α-N-草酰 基 -α,β - 二 氨 基 丙 酸 (α -N -oxalyl-α,β -diaminopropionic,簡稱α-ODAP),其中β-ODAP有毒性,α-ODAP無毒性或者毒性較弱,在水溶液中加熱可使這兩種異構體互相轉化[4]。
為了充分利用這一耐旱作物的高營養,國內外學者已經在β-ODAP的分離鑒定、化學及生物合成、分析方法、毒理學及代謝機理等方面做了大量工作[5]。這些工作都涉及到大量樣品中β-ODAP和無毒的α-ODAP的分析測定。因此,研究和建立快速、方便、準確的提取和分析方法非常必要。目前,對β-ODAP的測定方法已有不少報道[5]。如用6-氨基喹啉-N-羥丁二酰亞胺氨基甲酸酯(AQC)[6]、異硫氰酸苯酯(PITC)[7]、9-芴基甲基氯甲酸酯(FMOC)[8]等試劑柱前衍生液相色譜(HPLC)法。這些方法都采用梯度洗脫,或異構體夾雜在樣品中其它氨基酸色譜峰之間,分析時間長,或不能區分α和β-ODAP的異構體。Wang等[9]提出2,4-二硝基氟苯(DNFB)試劑柱前衍生的HPLC法可使α,β-ODAP最先出峰。用高氯酸提取法、乙醇提取法和水提取法進行樣品的預處理,采用恒組分進行洗脫,結果發現高氯酸提取法使樣品的分析時間大大縮短,這將有利于大量樣品的分析。同時,還研究了3種不同提取方法對ODAP含量的影響。
1 材料與方法
1.1 材料
山黧豆:購自甘肅;α,β-ODAP標樣:由蘭州大學應用有機化學國家重點實驗室提供;衍生化試劑DNFB:購自美國Sigma公司;乙腈為色譜純。實驗中其他試劑均為分析純。實驗溶液用Molli-Q水配制。高效液相色譜儀(LC-6AD):島津 LC-6AD泵(2臺),柱溫箱為CTO-10AS,檢測器為SPD-M20A,系統控制器為CBM-20A。
1.2 方法
1.2.1 提取方法
采用水提取法、30%乙醇提取法和0.2 mol/L高氯酸提取法。各法均準確稱量600 mg山黧豆粉,分別加入5 mL水、30%乙醇和0.2 mol/L高氯酸中,水提取法于60℃浸取24 h,30%乙醇提取法于室溫浸取24 h,高氯酸提取法于0℃~4℃浸取1 h,然后離心(12000 r/min),取上清液,保存于4℃。
1.2.2 標準品衍生化和預處理
取不同質量的標準品溶解于100 μL的NaHCO3溶液(0.5 mol/L)中,配成梯度溶液,然后加入100 μL DNFB乙腈溶液(1 μL DNFB溶解于100 μL乙腈中)。在60℃水浴中避光反應30 min后,冷卻至室溫,然后加入800 μL KH2PO4溶液(0.01 mol/L),搖勻后用0.45 μm膜過濾,然后進樣,進樣量為20 μL。
1.2.3 樣品衍生化和預處理
水提取液和乙醇提取液的衍生均為:分別取100μL水提取和乙醇提取的上清液加入100 μL的NaHCO3溶液(0.5 mol/L),再加入50 μL蒸餾水,然后加入100 μL DNFB乙腈溶液(1 μL DNFB溶解于100 μL乙腈中)。在60℃水浴中避光反應30 min后,冷卻至室溫,然后加入650 μL KH2PO4溶液(0.01 mol/L),搖勻并用0.45 μm膜過濾,進樣量為20 μL。
高氯酸提取液的衍生為:100 μL上清液加入150 μL的NaHCO3溶液,然后加入100 μL DNFB乙腈溶液。在60℃水浴中避光反應30 min后,冷卻至室溫,然后加入650 μL KH2PO4溶液,搖勻并用0.45 μm膜過濾,進樣量為20 μL。
1.2.4 色譜條件
色譜柱:C18,250 mm×46 mm,5 μm;流動相:乙腈/溶液A(17∶83,體積比,溶液A是 K2HPO4∶二甲基甲酰胺∶水為0.03 mol∶10 mL∶990 mL的溶液,并用冰醋酸調pH為5.5);流速:1.0 mL/min;檢測波長360 nm;溫度:28℃。
2 結果與分析
2.1 衍生條件的優化
根據文獻[9-10],選擇DNFB的量是ODAP的3倍以及60℃水浴中避光反應30 min為最佳衍生條件。衍生后的產物比較穩定,可在室溫放置一周或者4℃放置3個月,α-ODAP-DNB和β-ODAP-DNB的峰面積都不會發生改變,但是DNB-OH的面積會增加,分析認為這是由于DNFB水解引起的。
2.2 色譜條件的優化
2.2.1 流動相pH對分離效果的影響
流動相pH對分離效果的影響見圖1。

圖1 pH對β-ODAP-DNB和α-ODAP-DNB保留時間的影響Fig.1 Effect of pH on retention time of β-ODAP-DNB and α-ODAP-DNB
如圖1所示,pH對α-ODAP-DNB和β-ODAP-DNB分離影響不大,但是當pH低于4時,發現α-ODAP-DNB和β-ODAP-DNB的峰變得很寬而且拖尾現象很嚴重,當pH在4~5.5范圍內,α-ODAP-DNB和β-ODAP-DNB分離效果較好,而且峰形很好,無拖尾現象。
2.2.2 乙腈含量對分離效果的影響
在實驗中發現:如果乙腈含量太高,α-ODAPDNB和β-ODAP-DNB分不開;乙腈含量太低,出峰較晚。經反復實驗,乙腈含量為17%分離效果最好。
2.2.3 柱溫對分離效果的影響
柱溫對色譜峰的分離和拖尾均有一定的影響。實驗得:柱溫太高,α-ODAP-DNB和β-ODAP-DNB分不開,柱溫太低,峰出現拖尾現象;當柱溫為28℃時,既無拖尾,又能將兩者分開。
所以,在標準品和樣品的HPLC檢測中,均將最佳色譜條件確定為:pH為5.5,柱溫為28℃,流動相為乙腈/溶液A(17∶83,體積比)。
2.3 樣品檢測
在最佳色譜條件下,經過上樣檢測,得到ODAP標準品、高氯酸提取液、乙醇提取液和水提取液的色譜圖(圖2~圖5),再用ODAP兩個異構體的濃度與色譜面積(×107)回歸得到工作曲線方程(表1)。
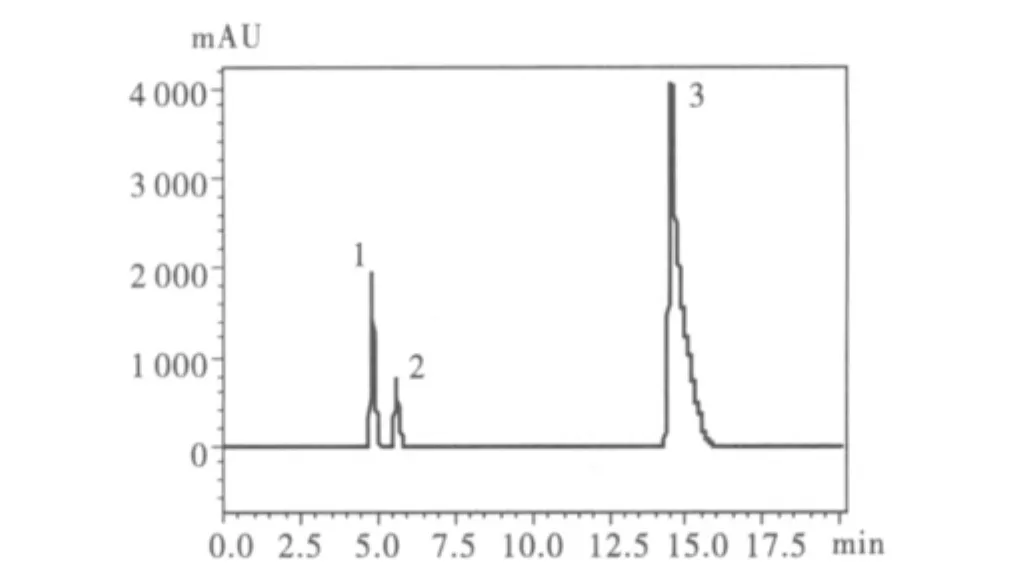
圖2 ODAP標準品色譜圖Fig.2 Chromatogram of ODAP standard derivatized with FDNB
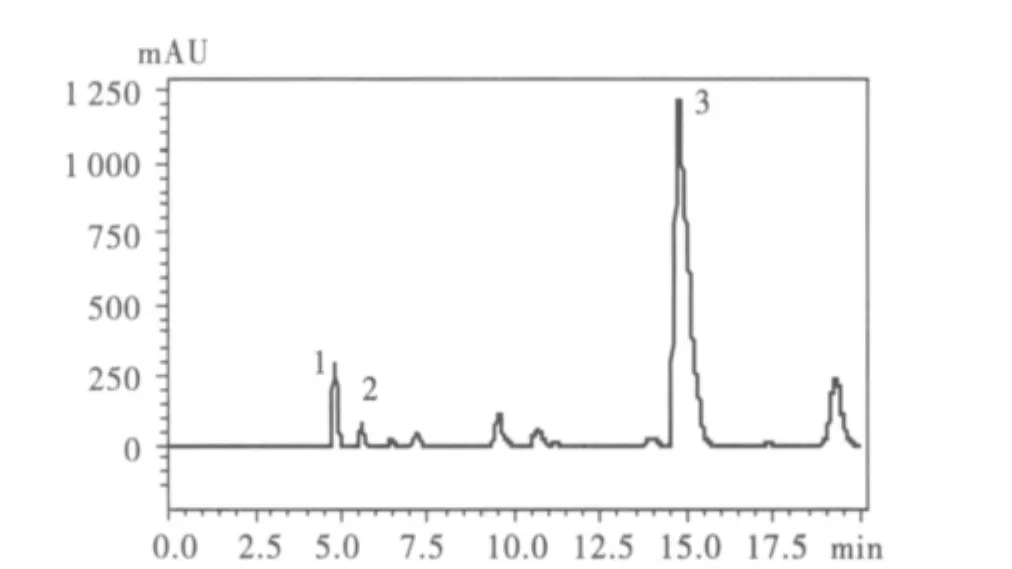
圖3 高氯酸提取山黧豆樣品色譜圖Fig.3 Typical chromatogram of the sample from Lathyrus sativus by the method of perchloric acid extraction
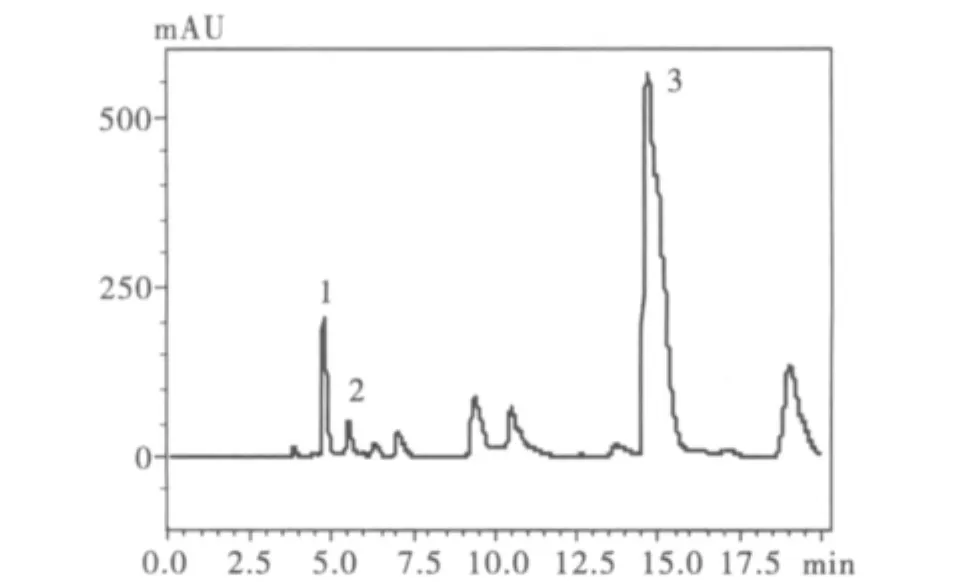
圖4 乙醇提取山黧豆樣品色譜圖Fig.4 Typical chromatogram of the sample from Lathyrus sativus by the method of aqueous ethanol extraction
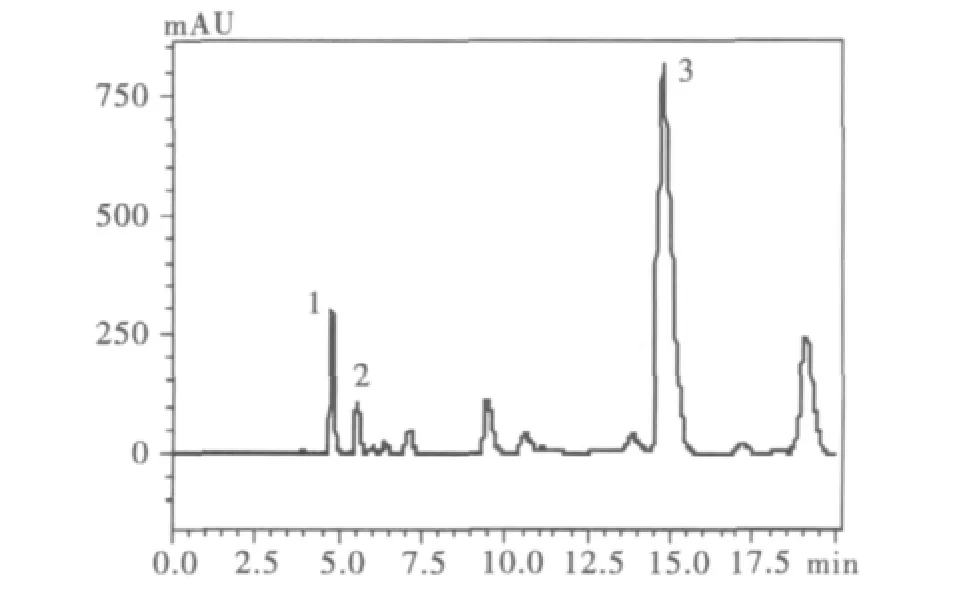
圖5 水提取山黧豆樣品色譜圖Fig.5 Typical chromatogram of the sample from Lathyrus sativus by the method of water extraction
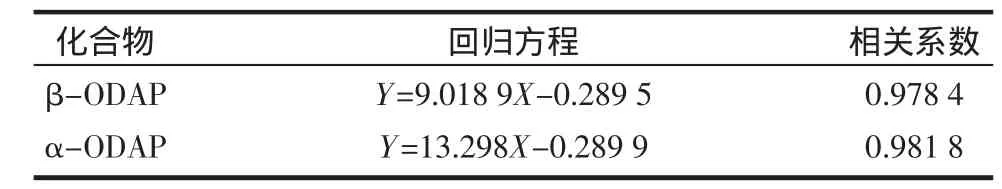
表1 α,β-ODAP的工作曲線Table 1 Calibration curve date of α,β-ODAP
從表1可以看出,兩個回歸方程的相關系數分別為以0.9784和0.9818,說明β-ODAP和α-ODAP濃度都與其峰面積具有非常好的線性關系,從而可以根據峰面積直接得出兩種化合物的濃度和含量。
根據曲線方程得到3種不同方法提取的萃取液中的β-ODAP和α-ODAP的含量,結果見表2。
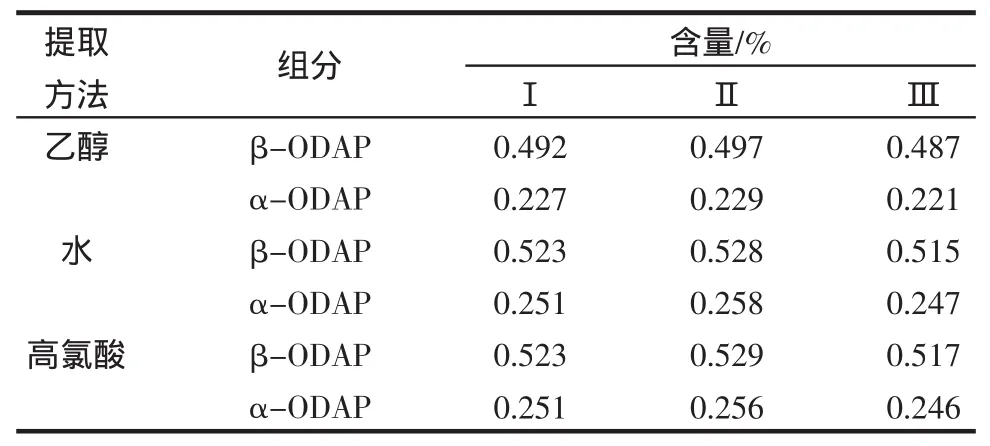
表2 不同方法得到的樣品提取液的分析結果Table 2 Contents of α,β-ODAP in Lathyrus sativus via three extraction methods
從表2可以看出,30%乙醇提取的β-ODAP和α-ODAP的最大量分別為0.497%和0.229%,而采用水和高氯酸提取法β-ODAP的最大量可以達到為0.528%和0.529%,α-ODAP的最大量為0.258%和0.256%。其提取效果均高于30%乙醇提法。
3 結論
水提取法和0.2 mol/L高氯酸提取法效果相當。其中水提法得到的上清液中β-ODAP的含量為0.522%,α-ODAP的含量為0.252%;高氯酸提取法得到的上清液中β-ODAP的含量為0.523%,α-ODAP的含量為0.251%;而30%乙醇提取法不如水提法和高氯酸提取效果好,其上清液中β-ODAP的含量為0.492%,α-ODAP的含量為0.225%。但是水和乙醇提取法耗時長,均需24 h。而0.2 mol/L高氯酸提取法耗時短,只需要在0℃~4℃提取1 h,這就有利于大量樣品的分析,為進一步制備純化等研究奠定了基礎。
[1]HANBURYCD,WHITECL,MULLANBP,et al.A review of the potential of Lathyrus sativus L.and L.cicera L.grain for use as animal feed[J].Anim Feed Science and Technology,2000,87(2):1-27
[2]MURTIVVS,SESHADRITR,VENKITASUBRAMANIANTA.Neurotoxic compound of the seeds of Lathyrus sativus[J].Phytochemistry,1964,3(6):73-78
[3]RAOSLN,ADIGA P R,SARMA P S.The isolation and chraracterization of β -N-oxalyl-α,β -diaminopropionic acid:a neurotoin from the seeds of Lathyrus sativus[J].Biochemistry,1964,3(3):432-436
[4]李志孝,孟延發,張立,等.山黧豆中α-及β-草酰二氨基丙酸相對含量的電泳測定[J].蘭州大學學報:自然科學版,1992,28:89-92
[5]嚴則義,邢更妹,王崇英,等.家山黧豆及其毒素ODAP的研究[J].西北植物學報,2004,24(5):911-920
[6]CHEN X,WANG F,CHEN Q,et al.Analysis of neurotoxin 3-N-oxaly-L-2,3-diamino propionic acid and its α-isomer in Lathyrus sativus by high performance liquid chromatography with 6-anino-quinolyl-N-hydroxysuccinimidyl carbamate(AQC)derivatization[J].J Agric Food Chem,2000,48(5):3383-3386
[7]KHANJK,KUOYH,KEBEDEN,et al.Determination of non-protein amino acids and toxins in Lathyrus by high performance liquid chromatography with 6 -anino -quinolyl-N-hydroxysuccinimidyl carbamate(AQC)derivatization[J].Chromatogr,1994,687(4):113-119
[8]GEDA A,BRIGGS C J,VENKATARAN S J.Determination of the neurolathyrogen β -N-oxalyl-α, β -diaminopropionic acid using high performance liquid chromatography with fluorometric detection[J].Chromatogr.,1993,635(3):338-341
[9]WANG F,CHEN Q,QIN X C,et al.Determination of neurotoxin 3-N-oxaly-L-2,3-diamino propionic acid and non-protein amino acids in Lathyrus sativus by precolumn derivatization with 1-fluoro-2,4-dinitrobenzene[J].Journal of Chromatography,2000,883(2):113-118
[10]張海霞,劉滿倉,靳小舜,等.2,4-二硝其氟苯柱前衍生測定山黧豆毒素ODAP[J].分析化學,2006,34(1):100-102

