鋁酸鈉溶液分解過程的理論及技術研究進展
李小斌,趙東峰,王丹琴,閻 麗
(中南大學 冶金科學與工程學院,長沙 410083)
鋁酸鈉溶液分解過程的理論及技術研究進展
李小斌,趙東峰,王丹琴,閻 麗
(中南大學 冶金科學與工程學院,長沙 410083)
鋁酸鈉溶液分解是堿法生產氧化鋁過程的關鍵環節。總結鋁酸鈉溶液分解過程的理論及技術研究進展,論述鋁酸鈉溶液分解過程的熱力學和宏觀動力學、鋁酸鈉溶液的結構及其演變規律、氫氧化鋁顆粒行為、分解體系固?液界面作用調控以及鋁酸鈉溶液分解技術等。認為鋁酸鈉溶液分解過程中有利于氫氧化鋁析出的含鋁離子是,調控溶液中其他復雜含鋁離子結構向該類結構轉變則有利于氫氧化鋁析出;增大分解末期體系中最小顆粒尺寸是提高分解深度的關鍵;協同調控分解過程中溶液物理化學性質、離子結構和固?液界面作用的原理和方法是強化鋁酸鈉溶液分解技術研究的基礎。
鋁酸鈉溶液;晶種分解;機理;技術;研究進展
鋁酸鈉溶液分解過程是影響氧化鋁生產效率及產品質量的關鍵環節,包括碳酸化分解和晶種分解兩種方式。自1889—1892年Bayer提出拜耳法生產氧化鋁技術近120年以來,氧化鋁工業規模逐年擴大,特別是近 20年來,氧化鋁產能迅速增加,據統計,2008年全球氧化鋁總產能約1億t[1]。但作為拜耳法生產氧化鋁技術中關鍵工序之一的晶種分解過程卻一直未能有任何突破性進展,是全球氧化鋁技術研究的熱點問題之一[2]。分解過程中始終存在氫氧化鋁晶種加入量大(晶種系數大于2)、分解時間長(30~70 h)、分解率低(45%~52%)和產出率低(一般每立方米溶液產出 Al2O3小于90 kg)等問題。目前一般認為,這主要是由于鋁酸鈉溶液存在強烈的過飽和現象,完全不同于一般無機鹽溶液。由于鋁酸鈉溶液與氫氧化鋁晶體間的界面張力大,分解過程難以自發成核,必須加入大量晶種以縮短成核的誘導期,促進氫氧化鋁析出。在拜耳法工業生產中,分解過程就是在添加大量氫氧化鋁晶種的條件下進行的。而燒結法生產氧化鋁則主要采用碳酸化分解技術,碳酸化分解具有分解時間短(2~8 h)、分解率高(90%~92%)等優點,但產品質量較難調控。
鋁酸鈉溶液分解過程存在的上述問題是全球氧化鋁生產亟待突破的技術瓶頸,為此,本文作者對近年來國內外眾多研究者關于鋁酸鈉溶液分解過程機理和技術所開展的大量研究工作從如下5個方面進行了回顧與總結:1) 鋁酸鈉溶液分解過程的熱力學與宏觀動力學。主要包括三水鋁石以及硅等雜質在Na2O-Al2O3-H2O系中的溶解度、析出氫氧化鋁的顆粒尺寸與其溶解度的關系、鋁酸鈉溶液晶種分解和碳酸化分解過程的熱力學和宏觀動力學;2) 鋁酸鈉溶液的離子結構及其演變規律。主要包括鋁酸鈉溶液結構與其性質間的關系、鋁酸根陰離子的行為及其結構調控;3) 氫氧化鋁顆粒的行為、調控原理與方法;4) 固?液界面作用調控;5) 鋁酸鈉溶液分解技術。主要包括生產冶金級砂狀氧化鋁產品的工業生產技術、強化晶種分解技術、析出一水軟鋁石的鋁酸鈉溶液分解技術以及分解技術的最新進展。
1 鋁酸鈉溶液分解過程的熱力學與宏觀動力學
1.1 NaOH-NaAl(OH)4-H2O體系中 Al(OH)3溶解度的熱力學計算模型
氧化鋁水合物在NaOH-NaAl(OH)4-H2O體系中的溶解度是堿法生產氧化鋁的理論基礎,全面掌握水合氧化鋁在氫氧化鈉溶液中的溶解度,對于研究鋁酸鈉溶液分解過程至關重要。鋁酸鈉溶液是氧化鋁生產過程的中間產物,其結構十分復雜,在不同條件下具有不同的物理化學特性。由于工業鋁酸鈉電解質溶液組成復雜,理論模型和半經驗公式至今仍然不能可靠地應用在該體系中。RUSSELL等[3],IKKATAI和OKADA[4],APPS 和 NEIL[5],POKROVSKII和HELGESON[6],VERDES 等[7],SCHR?DLE 等[8]研究了水合氧化鋁在氫氧化鈉溶液中的溶解度。由于實驗數據的局限性,很多學者則試圖通過體系熱力學模型的研究,得到更為便利的溶解度計算方法,已有的該體系熱力學模型研究方法主要分為兩類:1) 基于測定NaOH-NaAl(OH)4-H2O體系物理化學性質獲取熱力學計算模型的方法。ZHOU等[9]測得NaOH-NaAl(OH)4-H2O體系在313.2 K時的滲透系數,通過數據擬合得到 Pitzer模型參數,適用于 ρNaOHT(ρNaOH+ρNaAl(OH)4)=0.05~12 mol/kg,αK(ρNaOHT/ ρNaAl(OH)4)= 1.64~ 5.53 的鋁酸鈉溶液體系;K?NIGSBERGER 等[10]通過Zdanovskii法測量了包括氫氧化鈉和拜耳法溶液中其他成分在50 ℃和100 ℃下的壓力,并依據Pitzer方程建立了熱力學預測模型;CAIANI等[11]實測了溫度為50~250 ℃時含鋁離子在過量 NaOH溶液中的表觀摩爾比熱容,得到了相應的Pitzer模型;MAGALH?ES等[12]測量了 25 ℃時離子強度達到 6 mol/kg的NaOH/NaAl(OH)4溶液的比熱容,并驗證了Pitzer模型的適用性和準確性。2) 基于NaOH-NaAl(OH)4-H2O體系Al(OH)3溶解度數據獲取熱力學計算模型的方法。WESOLOWSKI[13]通過 Pitzer方程對三水鋁石的溶解度數據進行了擬合,得到了 0~100 ℃范圍內NaAl(OH)4在純電解質溶液中的 Pitzer模型參數和混合參數;李小斌等則引入鋁酸鈉溶液表觀介電常數的概念,試圖將 Debye-Hückel模型應用于 NaOHNaAl(OH)4-H2O體系,并得出了適用條件及其參數取值[14],構建了NaOH-NaAl(OH)4-H2O體系電解質活度系數的計算模型[15?16]。
盡管關于鋁酸鈉溶液熱力學的研究已有很多報道,但對于平衡常數值并未得到共識,特別是缺乏準確描述平衡常數的理論模型。文獻[9?13]均利用實測數據得到了相應Pitzer模型和參數,在研究過程中很多學者遇到了平衡常數數據匱乏等問題,且大都通過實驗數據或其他文獻計算而得。然而,溶解度實測數據與活度系數計算數據之間存在一定偏差,由溶解度數據計算所得反應平衡常數往往不完全與實際平衡常數相等。如WESOLOWSKI[13]計算所得平衡常數值與RUSSELL等[3]的實驗數據匹配較好,但明顯大于文獻[4, 6, 9]利用以往實驗數據所得的計算值。由于以往數據的誤差及理論依據不足,本文作者曾報道過計算三水鋁石在氫氧化鈉溶液中溶解反應平衡常數的經驗方程[14]。目前,本文作者已完善了該模型相應的理論支撐,得到適用范圍在25~100 ℃內的表達式:

式中:T為熱力學溫度,K。利用該表達式計算所得平衡常數與文獻報道值[3,5,13,17]能較好地吻合,且獲得了新的 NaAl(OH)4的 Pitzer模型參數和 NaOH-NaAl(OH)4-H2O體系的熱力學混合參數,可用于預測三水鋁石溶解于氫氧化鈉溶液的平衡溶解度和計算活度因子,其理論推導思路和計算方法也可推廣到其他1:1價型的電解質溶液體系。
今后,有關NaOH-NaAl(OH)4-H2O體系中Al(OH)3溶解度的熱力學計算模型方面的研究,應結合工業鋁酸鈉溶液結構更復雜和其物理化學性質變化大的特點,明晰雜質的影響規律,從理論上解決計算模型對于工業鋁酸鈉溶液的適應性問題。
1.2 雜質在NaOH-NaAl(OH)4-H2O體系中的溶解度
氧化硅、碳酸鈉、氯化鈉、硫酸鈉、鉀離子和有機物等雜質對工業鋁酸鈉溶液中Al(OH)3析出過程的影響很大,雜質的存在不僅影響溶液分解速率,而且影響分解產品的質量[18?20]。
堿法生產氧化鋁的關鍵在于鋁硅分離,氧化鋁生產中硅主要以鈉硅渣(即水合鋁硅酸鈉)形式去除,溶液中SiO2的平衡溶解度直接影響溶液脫硅、分解以及管道結疤等過程,是影響氧化鋁生產技術經濟指標的重要因素[21]。鋁酸鈉溶液中SiO2的平衡溶解度受堿濃度、氧化鋁濃度、溫度及雜質等因素的影響,ADAMSON等[22],CRESSWELL[23]和 JAMIALAHMADI等[24]對鋁酸鈉溶液中SiO2的平衡濃度進行了實驗研究,并提出了相應的SiO2平衡濃度經驗公式,但由于實驗者采用的研究條件不同,經驗公式僅適用于特定溫度、濃度等條件,計算結果相差較大;對此,JAMIALAHMADI等[25]提出了徑向基函數神經網絡(RBF),用以計算SiO2在鋁酸鈉溶液中的溶解度,并拓寬了適用范圍;李小斌等則提出了組成類似化合物的熱力學數據與其組成間存在線性關系[26]和復雜無機化合物熱力學數據估算方法[27],并據此計算了4種鈉硅渣的熱力學數據,得到了SiO2在鋁酸鈉溶液中的平衡濃度[26]和鋁酸鈉溶液碳酸化分解過程SiO2平衡濃度的變化規律,認為SiO2進入到產品主要是其平衡濃度變化的結果[28]。
目前,對其他雜質在鋁酸鈉溶液中的溶解度研究甚少,研究表明[29]:碳酸鈉對工業鋁酸鈉溶液的熱力學性質也有重要影響,彭小奇等[30]建立了基于Bromley模型的 NaOH-NaAl(OH)4-Na2CO3-H2O體系活度因子的計算模型。更多的研究主要集中在雜質對分解過程的影響方面。彭志宏等[20]研究了鋁酸鈉溶液中無機鹽雜質對晶種分解過程的影響,當氯化鈉濃度大于10 g/L、碳酸鈉濃度大于10 g/L、硫酸鈉濃度大于5 g/L時,均對鋁酸鈉溶液晶種分解產生不利影響,這與文獻[31]的報道基本一致;van STRATEN等[32]對過飽和鋁酸鈉溶液中的鋰離子、鈉離子和鉀離子進行了研究,認為25 ℃下有Na+和K+存在時,水合氧化鋁的析出順序為:無定形、擬薄水鋁石、拜耳石,而溶液中的 Li+因形成鋁酸鋰而加速拜耳石的結晶和生長。
總之,溶液中的雜質對分解過程的影響極為復雜,而有關雜質在鋁酸鈉溶液中的熱力學行為研究較少,應加強分解過程中碳酸鹽、硫酸鹽和硅酸鹽等主要無機鹽雜質和有機物的熱力學行為及其交互作用規律等方面的研究,以利于分解過程效率和產品質量的控制。
1.3 氫氧化鋁顆粒尺寸與溶解度的關系
鋁酸鈉溶液分解屬固?液?(氣)多相體系,體系中粒子(晶種/或產品)的群分布特征勢必導致不同粒子在分解過程中熱力學和動力學行為的不確定性。1871年,THOMSON首次在氣?液體系中提出了粒子尺寸與溶解度的關系,1900年,OSTWALD和FREUNDLICH將該關系式應用于固?液體系,提出了Ostwald 熟化公式[33],并指出顆粒尺寸與其溶解度成反比,溫度恒定時,對于其平衡狀態下的固?液混合體系,若固體顆粒半徑小于臨界晶核尺寸,則該顆粒將溶解。
對于鋁酸鈉溶液分解體系,隨著體系中能量和質量的交換,氫氧化鋁固體不斷析出,固?液界面之間的物理化學性質的變化不容忽視。LI等[34]研究了Al(OH)3在鋁酸鈉溶液中的成核機理,從固?液界面性質出發,認為氫氧化鋁顆粒的尺寸與其溶解度密切相關,且晶體的生長速率取決于溶液的過飽和度和NaOH濃度[35]。與之同時,LI等[36]也提出在鋁酸鈉溶液分解體系中,當其他條件相同時,大顆粒氫氧化鋁晶體表觀生長速率明顯大于小顆粒氫氧化鋁晶 體,相對于細顆粒而言,粗顆粒在溶液中的平衡溶解度較小,因而其對應的溶液過飽和度較大,即分解過程的推動力較大,這與文獻[35]的結論基本一致。
1.4 碳酸化分解和晶種分解過程Al(OH)3的析出機理
目前,對過飽和鋁酸鈉溶液晶種分解過程中Al(OH)3析出機理的研究較多[18,37?39],認識也基本一致。一般認為,由于三水鋁石在鋁酸鈉溶液中的固?液界面張力大、自發成核活化能高(120~160 kJ/mol),導致氫氧化鋁晶核難于自發形成,因此,晶種分解時須向精液中加入大量Al(OH)3晶種以降低溶液的穩定性,縮短誘導期,從而促進 Al(OH)3的析出。而對有固?液?氣三相參與反應的碳酸化分解過程的研究則相對較少,對其Al(OH)3析出機理尚未達成共識。文獻中主要有兩種觀點,即溶液穩定性破壞機制(式(2))和酸堿中和直接作用機制(式(3)),
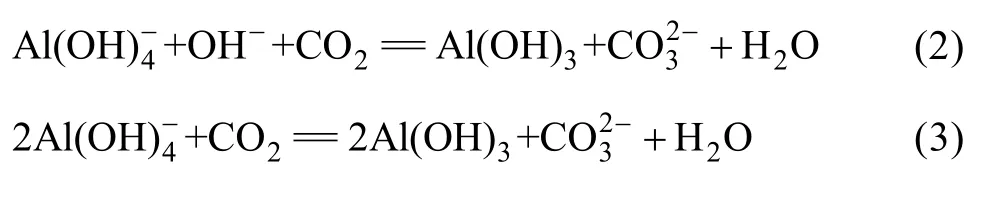
前者實際上與晶種分解過程 Al(OH)3的析出機理相同,即認為由于碳酸化分解過程中通入的CO2氣體中和溶液中游離的苛性堿,提高了溶液的過飽和度,降低了溶液的穩定性,從而導致Al(OH)3析出。但近年來進一步的研究表明,碳酸化分解和晶種分解過程Al(OH)3析出遵循同一機制。李小斌等[28]結合實驗數據對上述兩種機制進行了熱力學計算(見圖1)和分析,結果表明,按溶液穩定性破壞機制進行時,其反應的吉布斯自由能變比按酸堿中和直接作用機制的小很多,即熱力學上碳酸化分解反應按溶液穩定性破壞機制進行反應的可能性更大些;同時,動力學研究表明,鋁酸鈉溶液碳酸化分解和晶種分解過程中Al(OH)3析出強烈地受到溶液過飽和度的影響,兩者對過飽和度的級數在2~5之間,其表觀活化能也基本相當,碳分過程表觀活化能為75.115 kJ/mol[40],晶種分解過程表觀活化能為30~121 kJ/mol[41?47];此外,碳酸化分解試驗結果表明,隨著碳酸化分解時間的延長,溶液苛性比值呈“鋸齒”型曲線變化[28],從試驗上進一步支持了碳酸化分解過程中Al(OH)3析出遵循溶液穩定性破壞機制這一觀點。碳酸化分解和晶種分解過程
Al(OH)3析出機理的同一性對碳酸化分解過程具有重要的實際應用價值,已有晶種分解的理論研究成果對燒結法碳酸化分解過程同樣具有指導意義。

圖1 式(2)和(3)的反應吉布斯自由能變?GT隨溫度的變化Fig.1 Change of Gibbs free energy (?GT) for reactions (2)and (3) at different temperatures
2 鋁酸鈉溶液結構及其演變規律
鋁酸鈉溶液結構及其性質是堿法生產氧化鋁的重要理論基礎,只有揭示和掌握鋁酸鈉溶液結構及其性質變化的本質,找到過飽和鋁酸鈉溶液分解緩慢的原因,才能為提高氧化鋁生產效率、改善產品質量和探索強化鋁酸鈉溶液分解新途徑提供可靠的理論依據[48]。
2.1 鋁酸鈉溶液的結構與性能的關系
2.1.1 鋁酸鈉溶液的結構
在鋁酸鈉溶液結構研究早期,一直未能解決鋁酸鈉溶液到底是膠體還是真溶液的問題[49],如今,鋁酸鈉溶液屬于真溶液已經被廣泛確定。關于鋁酸根離子的結構,低濃度過飽和鋁酸鈉溶液中占絕對主要成分的是單核四面體鋁酸根離子 A l(OH)-4,這一說法目前已被紅外、拉曼、核磁共振譜、溶液 XRD等各種檢測方法確定[50?51];然而關于高濃度鋁酸鈉溶液中是否存在 A l(OH)-4之外的其他離子、這些離子的存在形式以及鋁酸鈉溶液中各種離子間的相互轉化關系,至今仍不明晰。
單核鋁酸根離子除 A l(OH)-4外,CARREIRA等[52]研究認為在 pH>12.5的鋁酸鈉溶液中鋁酸根離子以AlO-2形態存在于溶液中;KRAUS等[53]也認為Al(OH)-4會脫水產生 A lO(OH)-2和 A lO-2[52],從而解釋蒸氣壓測量結果;電導率測量[54]及ab initio量子化學計算法[55]推測鋁酸鈉溶液中可能存在 A l(OH)52-離子,紫外、核磁及拉曼光譜法[56]推斷在高苛性比的鋁酸鈉溶液中除 A l(OH)-4外還有少量 A l(OH)36-離子存在,但其濃度很低。
NMR研究結果還揭示了在強堿性鋁酸鈉溶液中各種離子對的存在(如 NaOH[50]和 N aAlOH-4[51])。GUTOWSKY等[57]認為,盡管 A lO-2、OH?的靜電半徑都是1.40 ?,但溶液中Na+趨于與 A lO-2、 A l(OH)-4形成離子對而不是與 OH?形成離子對,溶液中存在Na+Al(OH)-4、 N a+AlO(OH)-2、Na+A lO-2、Na+OH?離子對及它們之間的化學平衡,其中 N a+A l(OH)-4離子對是溶液的主要成分。同時 ANDERSON和CASTET[58?59]通過對 A12O3在堿性溶液中的溶解度和鋁酸鈉溶液熱力學性質的研究,推論 N a+A l(OH)-4和Al(OH)-4是鋁酸鈉溶液的主要成分,但關于 Na+的配位狀態及其與鋁酸根形成離子對的方式(靜電作用、氫鍵還是弱化學鍵)未曾報道。
目前,存在較多爭議的是聚合鋁酸根離子的形態,其中包括二聚鋁酸根離子和多聚鋁酸根離子。拉曼光譜、核磁共振及電導率測量證明有二聚體離子Al2O (OH)62-的存在,WATLING[60]總結前人研究成果認為鋁酸根離子既有四面體構型,也有八面體構型的鋁酸根聚陰離子,且鋁原子通過—O—,—OH—橋連接起來。最近的研究指出,二聚鋁酸根離子也可能存在。CHEN等[62]通過量子化學計算,認為 A l6(OH)62-4是三水鋁石析出的主要生長基元,SIPOS等[63]通過電勢和光譜測量結果推論六個單體鋁酸根離子 A l(OH)-4釋放兩個OH?后生成六聚體 A l6(OH)42-2。
總之,鋁酸鈉溶液中離子結構復雜,對此的認識并不深入,除Na+、OH?、 A l(OH)-4以及二聚鋁酸根離子(OH)3Al-O- A l(OH)32-)及它們形成的離子對,可以定性甚至定量的解釋某些實驗現象之外,其他鋁酸根離子,如 A lO-2、 A l(OH)52-或 A l(OH)36-可能并不存在,被認為是生長基元的六聚體鋁酸根離子,目前也只是通過計算的推測,尚未得到實驗驗證。
2.1.2 鋁酸鈉溶液的物理化學性質
鋁酸鈉溶液的表面張力、黏度、密度、折射率及電導率等物理化學性質得到了較多的研究。鋁酸鈉溶液的表面張力與溫度成反比,氧化鋁的濃度一定時,鋁酸鈉溶液的表面張力隨堿濃度的增加而增加;苛性比一定時,鋁酸鈉溶液的表面張力隨氧化鋁濃度的增加而增加;同時,硅的存在使鋁酸鈉溶液的表面張力增加[64]。低溫、高堿濃度、高苛性比及過飽和度較高的鋁酸鈉溶液黏度較大,反之則較小[65?66]。鋁酸鈉溶液黏度與溫度、濃度及苛性比的定量關系為[65]:ln η=?1.554+1.139αk+0.018 72ρ?0.050 3T。鋁酸鈉溶液的電導率與溶液組成的關系也已經明晰,即鋁酸鈉溶液的電導率隨苛性比的升高而增大,苛性比一定時,溶液的電導率隨Na2O質量濃度的升高先升高后降低,并在100~120 g/L出現一個極大值[67]。
2.1.3 鋁酸鈉溶液的結構與物理化學性質之間的關系
通過鋁酸鈉溶液的物理化學性質與鋁酸根離子的結構的關系,可以更有效地研究不同結構鋁酸根離子之間的相互轉化,但是關于這方面的研究仍然較少。王雅靜等[64]結合拉曼光譜,定性解釋了鋁酸鈉溶液表面張力和結構之間的關系,但是未對鋁酸根離子結構形式作深入研究;HEFTER等[68]分析了 NaOH+NaAl(OH)4混合物體系的黏度,得出了混合電解質溶液體系的黏度與 A l(OH)-4的含量之間的關系,但缺少對其他類型的鋁酸根離子的分析;BARCZA等[54]曾通過研究溶液電導率,推測鋁酸鈉溶液中存在 A l(OH)-4、。這些研究均未明晰鋁酸鈉溶液中鋁酸根離子結構與其物理化學性質之間的關系。李小斌[67]等在解析鋁酸鈉溶液的結構與物理化學性質之間的關系方面作了有益的嘗試,他們通過測定不同 Na2O質量濃度和苛性比 αk鋁酸鈉溶液的電導率,按Kohlrausch提出的強電解質溶液極限摩爾電導率的經驗方程,計算離子的遷移數
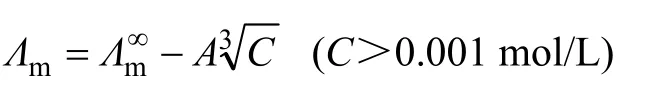
式中: Λm∞為電解質溶液的極限摩爾電導率;t(X)為X離子的遷移數;c為濃度(mol/L),A為常數。
計算了不同Na2O質量濃度下鋁酸根陰離子的遷移數,結合鋁酸鈉溶液的紅外光譜表征,研究了鋁酸鈉溶液的電導率與其結構間的內在關系。結果表明,鋁酸鈉溶液中鋁酸根離子聚合度隨溶液堿濃度的增大而增大,鋁酸根離子的電遷移能力則隨離子聚合度的增大而降低,且 A l(OH)-4的電遷移能力最強,鋁酸根離子遷移數的計算結果如表1和表2所列。該研究思路和結果將有助于更深入理解氧化鋁生產過程溶液的作用規律,為強化分解過程技術研究提供新的思路。
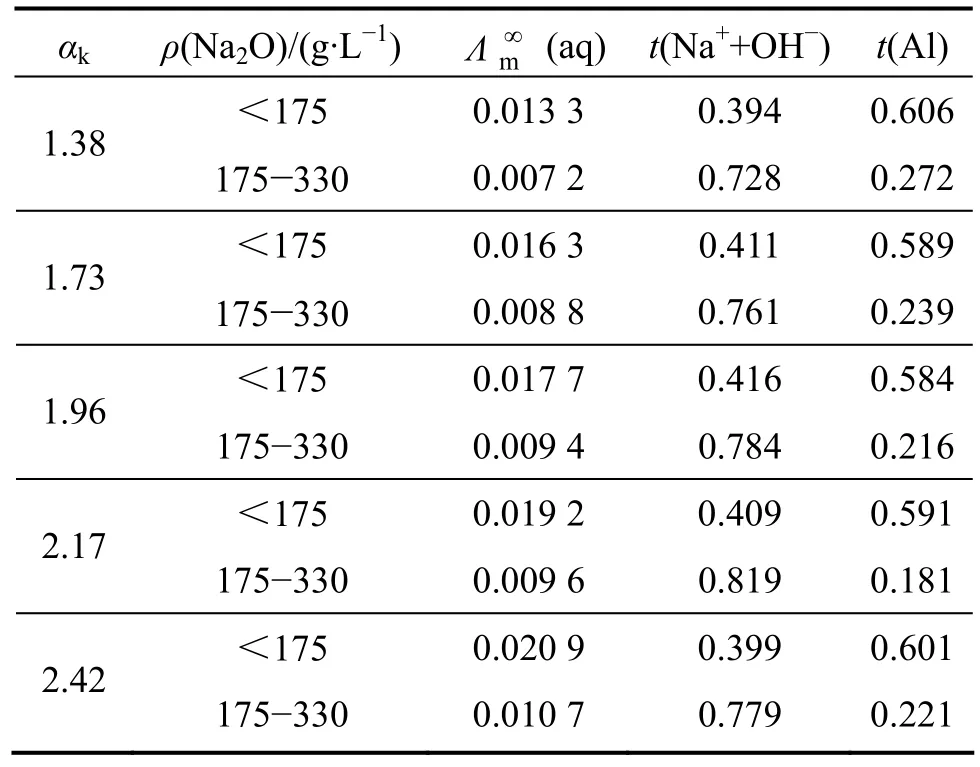
表1 鋁酸鈉溶液的極限摩爾電導率及鋁酸根離子的離子遷移數Table 1 Limiting molar electric conductivity and transference number of aluminate ions in aluminate solution

表2 高濃度下鋁酸鈉溶液的極限摩爾電導率及鋁酸根離子的遷移數Table 2 Limiting molar conductivity and transfer number of aluminate ions in aluminate solution at high concentration
2.2 分解過程鋁酸根陰離子的行為
2.2.1 分解過程鋁酸根陰離子的行為
孫素琴等[69]用近紅外傅立葉變化拉曼光譜儀原位跟蹤了鋁酸鈉溶液碳酸化過程,發現代表 A l(OH)-4離子的625 cm?1處的拉曼光譜峰在通入CO2分解過程中會逐步減弱;劉吉波[70]、尹建國等[71]分別研究了超聲波處理鋁酸鈉溶液和加入陽離子聚丙烯酰胺強化種分過程,觀察到這兩種處理方法均使鋁酸鈉溶液中的濃度降低,并認為形成了高聚體離子,其中二聚體離子等促使鋁酸鈉溶液結構向有利于分解的方向進行,但是工業實踐中,鋁酸鈉溶液濃度較低、苛性比較小時,分解過程更容易進行,而此時溶液中以 A l(OH)-4為主[72],上述研究觀點并不能解釋這個現象。COUNTER等[73]通過冷凍透射電鏡研究了鋁酸鈉溶液種分過程,觀察到四面體 A l(OH)-4聚集成有序的膠狀粒子,最后生長成Al(OH)3晶體;WATLING[60]認為 A l(OH)-4離子聚集成束,最終形成氫氧化鋁;LI等[34]也認為鋁酸鈉溶液中四面體Al(OH)-4和二聚體聚合成含鋁陰離子,最終形成Al(OH)3晶體;但是到目前為止,究竟是四面體還是聚合鋁酸根離子等引起鋁酸鈉溶液析出氫氧化鋁仍不明晰。
在 LI等[74]最近的研究中,通過對種分實驗中不同分解時間的分解母液進行紅外光譜跟蹤測試,發現隨著分解的進行,鋁酸鈉溶液的峰形以及各峰的強度都發生了變化,對880、720、635和530 cm?1處的吸收峰對應的鋁酸根陰離子進行半定量計算,得出種分過程中各鋁酸根陰離子的濃度隨分解時間的變化規律,如圖2所示。由于種分過程屬于化學反應控制,說明鋁酸鈉溶液的分解主要是由720 cm?1和880 cm?1處對應的四面體鋁酸根離子引起的,從而認為四面體鋁酸根離子是導致鋁酸鈉溶液析出氫氧化鋁的最主要因素。
2.2.2 固?液界面鋁酸根離子結構
研究[34,75]表明,三水鋁石/溶液界面的物理化學性質與三水鋁石析出的機理密切相關,但是,在晶體生長的界面層,采用光譜分析未能檢測出顯著的特征峰,這是由于參與晶體生長過程的膠束離子是在溶液本體中形成的。鋁酸鈉溶液晶種的表面性質對分解后期分解率的影響顯著,只有附帶分解母液的晶種能使鋁酸鈉溶液繼續分解,而其他形式的晶種則很難促進鋁酸鈉溶液繼續分解[76]。本文作者[74]采用ATR差減法半定量研究了鋁酸鈉溶液晶種分解過程中晶體表面附液層中的離子結構,通過種分過程中帶附液的氫氧化鋁紅外譜圖對氫氧化鋁晶體的紅外譜圖進行差減而得到附液層中的離子結構。差減后的紅外光譜圖中主要是Al(OH)-4,即氫氧化鋁晶體表面附液中主要為,且其含量基本保持不變。
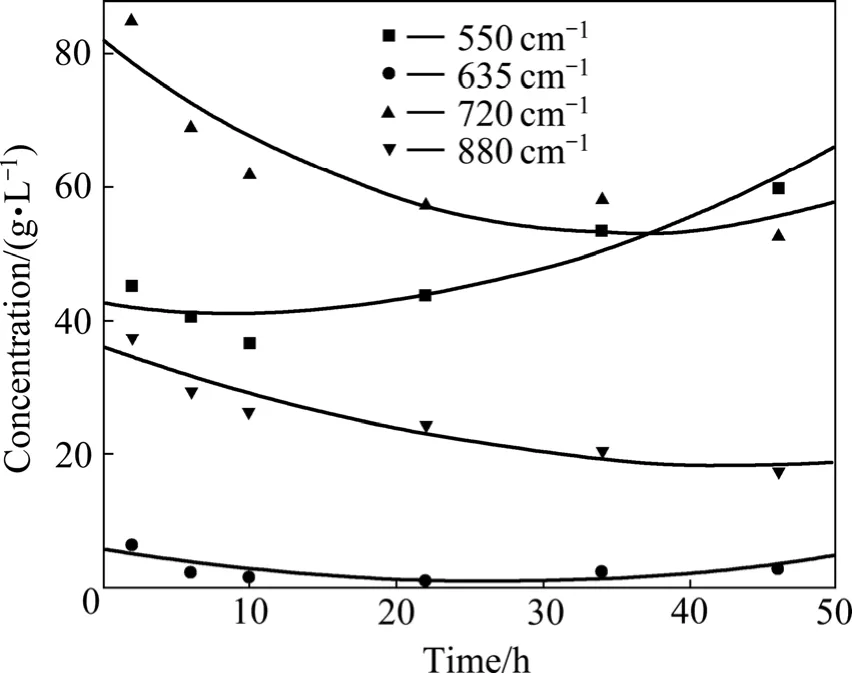
圖2 分解過程中不同吸收峰處鋁酸根陰離子的濃度變化規律Fig.2 Concentration variation of aluminate ions during seeded precipitation process
采用壓片法對不同分解時間取樣抽濾后得到帶附液的氫氧化鋁進行紅外光譜測試。用R( A l(OH)-4/A l2O (OH)26-)表征不同種分時間的晶體附液中 A l(OH)-4相對于二聚體 A l2O (OH)26-的濃度變化(見圖3),結果表明,隨著分解時間的進行,R值不斷增大,即隨著分解進行氫氧化鋁晶體表面附液中Al(OH)-4含量相對 A l2O(OH)62-含量而言略有增加。
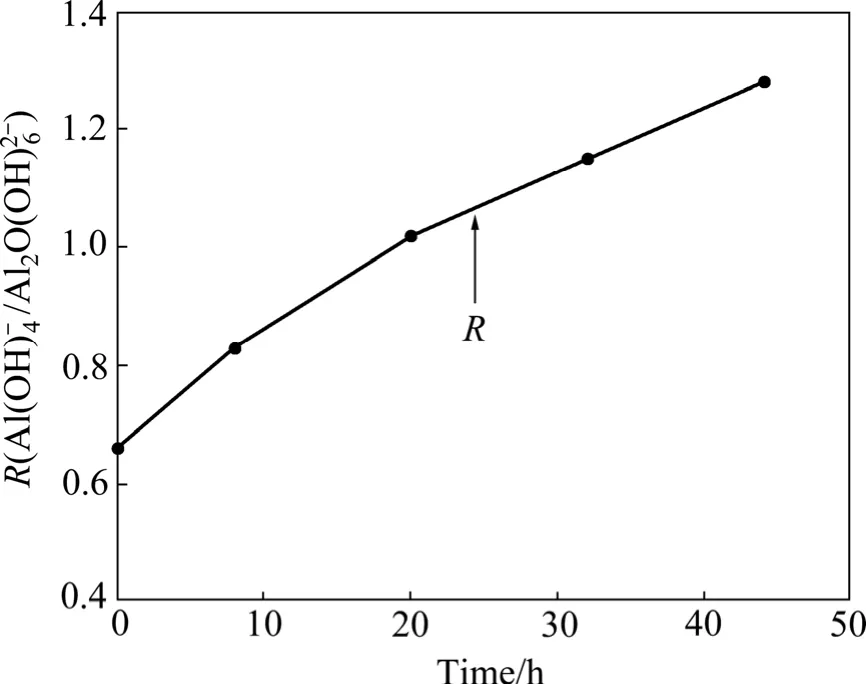
圖3 分解過程中晶體附液中R( A l(OH)-4/A l2 O (OH)26-)隨時間的變化規律Fig.3 Change of R( A l(OH)-4/A l2 O (OH)62-) with time during seeded precipitation process
鋁酸根離子從本體溶液擴散到晶體表面后,繼續向邊界層內擴散,其中,四面體鋁酸根離子由于其電遷移能力較強,在邊界層內更易擴散。然而,隨著分解的進行,本體溶液中四面體鋁酸根離子濃度越來越低,單體聚集成簇的驅動力越來越小,且簇的大小較難達到臨界晶核尺寸,所以,分解后期即使附液層中四面體鋁酸根陰離子濃度較高也較難析出氫氧化鋁晶體。
2.3 種分過程鋁酸根離子結構的調控方法
目前,改變鋁酸鈉溶液離子結構的方式主要有:雜質、外場和水。雜質主要包括無機鹽雜質(包括碳酸鈉、硫酸鈉、硅等)和添加劑(油酸、硬脂酸及醇類)。例如當溶液中1, 2辛二醇的濃度達到2 mmol/L時,溶液的兩個側峰峰形、強度發生了比較明顯的變化,意味著溶液中多聚的鋁酸根陰離子的形態可能發生了某種轉變,使結晶過程變得困難[75]。外場包括電場、磁場及超聲場等;劉吉波[70]認為,超聲波作用下溶液中單體鋁酸根離子 A l(OH)-4濃度減少,二聚體離子濃度增多,從而認為聚合體離子等更有利于分解過程,但是,工業實踐中鋁酸鈉溶液濃度較低、苛性比較小時,分解過程更容易進行,而此時溶液中以 A l(OH)-4為主[50],上述研究觀點并不能解釋這個現象。最近,本文作者研究發現,鋁酸鈉溶液分解過程中,鋁酸鈉溶液蒸發一定濃度后,再加入水補回到蒸發前濃度時,溶液結構則有所變化。關于種分過程鋁酸根離子結構的調控方法,還有待進一步的研究。
3 鋁酸鈉溶液分解過程中機理和氫氧化鋁粒子的行為
鋁酸鈉溶液分解過程屬于鋁酸鈉溶液?帶電固體粒子的固?液兩相體系,深入研究鋁酸鈉溶液分解過程的機理和氫氧化鋁粒子的行為,尋找切實可行的調控固?液界面的有效途徑,在提高鋁酸鈉溶液晶種分解過程的產出率的同時,保證分解產品質量,是氧化鋁工業的迫切需要。氫氧化鋁顆粒在鋁酸鈉溶液中的行為主要包括:成核、長大、附聚、破裂與磨損,這些現象往往同時發生,只是在不同條件下,發生的程度不同,且有主次之分。
成核又分為原生成核和次生成核,它會使最終產品的粒度細化。原生成核是指過飽和溶液中的均相成核。鋁酸鈉溶液中 A l(OH)-4形成鋁酸根離子群的締合物不斷長大,當其半徑超過臨界半徑后,就可以成為晶核繼續存在并長大成為晶體。對于均相成核的研究,HALFON等[43]選取0.01 μm作為臨界核尺寸模擬了成核模型,但計算所得的結果小于三水鋁石的晶格尺寸,大于微觀粒子的觀測值;利用HERRMANN等[77]報道的固?液界面張力數據,MYERSON和 TOYOKURA等[78]通過計算認為臨界核尺寸為 0.11 μm;張立川等[79]通過測量鋁酸鈉溶液的電導率,認為氫氧化鋁臨界成核半徑為1.5~2.0 μm;ROSSITER等[37]借助多角度激光掃描設備,計算得出三水鋁石均相成核臨界尺寸為(0.001 2±0.000 1) μm。上述不同的研究者得出的臨界核尺寸不盡相同,這主要可歸因于所采用的溶液濃度不同、方法各異以及實驗誤差等因素。研究溶液均相成核問題應將固?液界面性質(例如固體界面能、顆粒粒度、溶液表面張力等)考慮在內,而固?液界面能是隨體系溫度、濃度和顆粒性質等的變化而變化的,已有研究將宏觀尺寸測得的界面性質用于計算微觀的臨界尺寸,且不考慮濃度和溫度的影響,勢必導致結果的差異。次生成核是在原始溶液過飽和度高、溫度低、分解速度快而晶體表面積小的條件下先生成枝狀結晶,在顆粒相互碰撞時發生破裂折斷而脫離母晶轉入溶液,從而產生新晶核的過程。BROWN[80]研究認為,晶種表面的微觀磨蝕而產生的碎片是新晶核產生的主要源泉,晶核生成率與晶種粒度有關,晶種越粗,產生的新晶核數量越多;MISRA和WHITE等[41]認為在高攪拌速率下二次成核的效果才更顯著;LI等[81]通過計算得出二次成核活化能為132 kJ/mol,且該過程與溶液過飽和度和溫度密切相關,與鈉離子濃度無關,這與文獻[18]的結論相符;HALFON等[43]將成核率與晶種表面空缺數聯系起來,得到了二次成核速率方程。總之,高過飽和度、低溫、低種子比、低位錯密度等條件有利于二次成核,在實際生產中要合理的控制這些條件。
附聚是鋁酸鈉溶液中氫氧化鋁顆粒長大的一種重要方式,一般認為[41,82?84],該基本可以分為物理絮凝和結晶附聚兩個步驟。MARCHAL等[85]認為附聚結果取決于顆粒的流體動力學碰撞頻率、顆粒間相互作用以及晶體生長的結合能力;SAKAMOTO和KANEHARA等[86]認為氫氧化鋁晶粒的附聚主要取決于“粘結劑”氫氧化鋁的析出速度和為牢固穩定絮凝物所需的“粘結劑”數量之間的平衡。許多學者先后提出了不同的附聚模型,HALFON等[84]認為粒子附聚與原始尺寸無關,提出氫氧化鋁晶體的附聚速率A的表達式為

式中:X為單位體積、單位時間內粒徑在m~m+dm間粒子的二元碰撞數目;a(c)為相關系數。而STEEMSON等[87]則提出了臨界附聚尺寸的概念,認為附聚主要發生在粒徑相近的細粒子之間,超過某一臨界尺寸的顆粒之間不會發生附聚;SEYSSIECQ等[82]在總結了不同附聚模型的基礎上,認為附聚速率Ai可以表示為
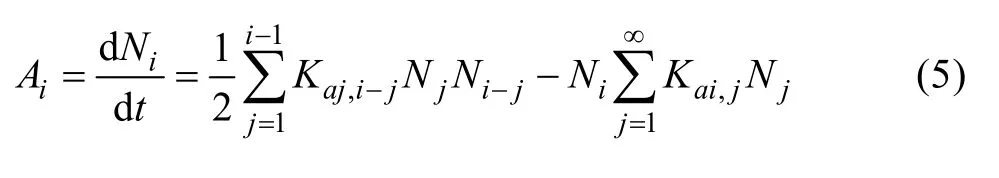
式中:Ni為某一體積區間的總粒子數;Kai,j為附聚參數;ZHOU等[88]研究了鋁酸鈉溶液碳酸化分解過程中Al(OH)3顆粒附聚問題,以分解過程顆粒數的消失速率表征附聚速率,從理論上推導出附聚模型,并得到實驗結果的支持,認為附聚速率與溶液過飽和度的變化速率、顆粒數、顆粒尺寸等因素相關。上述研究表明,高溫、高過飽和度、低種子比、加入一定量的細晶種等有利于附聚。一般認為附聚發生在分解初期(5~9 h),本文作者提出[76],在分解后期亦存在附聚現象,鋁酸鈉溶液晶種分解后期晶種表面界面層溶液結構對分解速率有重大影響。因而,調控利于附聚的因素,充分利用附聚得到粒度適中、強度較高的砂狀氧化鋁產品對工業生產至關重要。
晶體長大是氫氧化鋁直接從鋁酸鈉溶液中析出的重要途徑。目前,較一致的觀點是[89?91],氫氧化鋁晶體表面存在不同的生長速率,因而晶體的生長上具有形貌多樣性;關于Al(OH)3晶體生長的微觀機理[92?93],研究表明氫氧化鋁晶體的(001)面本身具有一種垂直于該表面的靜電引力,使得該表面處于較高的能級狀態,易于吸附 A l(OH)-4離子,使晶體長大。關于晶體生長速率,一般用單位時間三水鋁石直徑的增大值來表示,晶體生長相關動力學模型[41?47]反映的就是所有粒徑粒子的生長而引起的質量增加的綜合作用,較為一致的結論是:晶種分解過程在經典的動力學領域被視為二級反應,分解速率與溶液過飽和度成正比。然而,多數研究忽略了晶體尺寸的影響因素,為了更真實地描述Al(OH)3生長的特征與規律,必須提出與晶體尺寸相關的晶體生長速率的計算模型,并結合體系組成與溫度制度,得出不同尺寸晶體生長的動力學參數。LI等[36]認為,雖然晶種分解是一個包含成核、附聚與晶體生長等多種物理化學變化的復雜過程,但它們綜合作用的結果都反映在分解過程的粒子數密度的變化率上,由此提出了通過對分解過程的群分布顆粒粒度分布的變化進行數據處理計算長大速率的方法,并得出顆粒長大速率與尺寸正相關的結論,這一結論與工業實踐相吻合。
氫氧化鋁晶體的破裂與磨蝕主要是由于在攪拌過程中顆粒間及顆粒與器壁、攪拌漿等固體物質的相互碰撞所引起的,它屬于一種機械現象[48],該過程所產生的細粒子在分解過程中作為二次成核的晶核而存在。一般在工業分解槽中的攪拌強度不會導致顯著的顆粒破裂。
總之,鋁酸鈉溶液分解產品的產量和質量與其對應的分解過程動力學密切相關,其中的任何一個過程受到影響,都可能對整個的工藝產生較大的影響,甚至可能影響到最終產品的質量。在實際的生產過程中對這些過程要很好地進行控制與調整。
4 分解體系固?液界面作用調控
LI等[76]研究了不同類型晶種對高苛性比鋁酸鈉溶液分解率的影響,指出分解后期晶種表面界面層溶液結構對分解速率有重要影響,該結論在后來的研究中[74]也得到了證明,由此可見,在鋁酸鈉溶液分解過程中,固?液界面作用的影響是必然的。結合上述鋁酸鈉溶液結構與性能的關系、Al(OH)3顆粒在分解體系的溶解度及其與顆粒尺寸之間的關系、粒子在分解過程中的行為,研究調控固?液界面作用的原理與方法,對于緩和產品質量與分解率之間的矛盾具有重要意義[94],引起了業界廣泛重視。有關分解體系界面作用調控的研究主要從兩個方面進行。
4.1 晶種的活化處理
晶種的表面性質對鋁酸鈉溶液種分分解率的影響顯著,目前制備活化晶種的主要方法有以下幾種[95]:1) 熱活化。采用工業氫氧化鋁焙燒窯窯灰作晶種;2)機械活化。采用球磨機等設備研磨工業晶種使其表面化學鍵斷裂,晶體缺陷增加而改變固體的熱力學性質和參與化學反應的能力;3) 濕法活化處理。用離子交換樹脂處理分解原液,可顯著縮短種分誘導期,降低表觀活化能提高分解速度,同時可制得具有較大比表面積和大量活性點的氫氧化鋁晶種;4) 鋁酸鈉溶液分解制備活性晶種。有報道向鋁酸鈉溶液中添加誘發劑分解制取活性晶種,鋁酸鈉溶液冷凍法制取活性晶種,鋁酸鈉溶液自發分解制取活性晶種。
上述活化晶種的方法實際上是增大晶種的比表面積,增加活性點,強化溶液與晶體間的傳質;晶種活化對鋁酸鈉溶液分解過程及產品粒度的影響也被廣泛研究[96?99],但大多隨種分進行晶種表面都會快速失去活性,或者對產品的粒度及純度有影響,而且活化晶種的處理往往操作困難,處理時間長,有些活化方法設備投資大,因此均未能得到工業應用。
4.2 添加劑的作用
添加劑具有界面吸附、定向排列、膠束生成以及由此產生的界面張力下降等性質,在種分過程中采用添加劑主要有兩個目的,即改善產品質量和提高分解率。有關采用添加劑改善產品質量的研究比較深入,其中,CGM(Crystal growth modificater)已得到工業應用,但對采用添加劑提高分解率的研究至今還沒有突破性進展。PAULAIME等[94]和 SEYSSIECQ 等[100]的研究表明,有機添加劑在與它接觸的界面上產生選擇定向吸附,一方面增加了晶種表面的潤濕性,另一方面降低了鋁酸鈉溶液的界面張力,此結論在李小斌等[101]的研究中也得到證實;彭志宏等[102]研究了有機添加劑對種分過程的影響,指出一定量的非離子表面活性劑可改變Al(OH)3顆粒表面的Zeta電位,同時使鋁酸鈉溶液的表面張力降低 20~30 mN/m,從而可大幅度降低溶液的穩定性,加快晶體生長速度;ROE和PERISHO[103]、OWEN 和 DAVIS[104]、CHEN 等[105]、吳玉勝等[106]和薛紅等[107]的研究表明,一些有機聚合物和部分表面活性劑可以強化分解,其中,15?冠?5?醚可能是由于有機物分子吸附到晶種表面,降低了鋁酸鈉溶液的穩定性,強化了成核過程[96]。
添加劑的強化作用是通過固?液界面間完成的,然而這些添加劑與晶種或者溶液之間的相互作用關系尚不明確,對添加劑提高分解率的效果和作用機理尚無共識。添加劑與晶體間的固?液界面作用機理主要包括:1) 吸附理論,BRONSWIJK等[108?109]研究發現,一些有機添加劑吸附在固體表面屬于化學吸附,且符合蘭繆爾等溫式;2) 雙電層理論,氫氧化鋁晶種表面帶正電荷,其表面緊密吸附著帶負電荷的OH?,形成雙電層結構,帶負電荷的氫氧化鋁膠團粒子間互相排斥,析晶困難,加入陰離子表面活性劑后,反離子進入滑動面,壓縮雙電層,使ζ電勢變小,從而提高分解率;3) 形成分子間化合物[100],某些有機物與生長基元之間形成了一種分子化合物,這些有機添加劑導致形成的分子化合物只能選擇性的嵌入到特定的晶面上,因而改變了晶體的結晶行為。比如不同的多元羧酸可以改變晶體的生長形貌,其中,草酸會導致晶體主要在(101)和(112)晶面生長,從而導致晶體成片狀結構,DL?蘋果酸, 酒石酸和羥基丙二酸會使晶體在(100)和(101)晶面生長,從而導致晶體成針狀結構。
5 鋁酸鈉溶液分解技術
5.1 冶金級砂狀氧化鋁的工業生產技術
為適應現代鋁電解工業普遍采用的干法凈化技術,要求氧化鋁企業生產砂狀氧化鋁。國外冶金級砂狀氧化鋁生產技術主要有以美鋁公司為首的低堿濃度、低αk條件下的二段分解技術和以法鋁公司為代表的高堿濃度、較高αk條件下的一段分解技術。一段分解流程較簡單,便于掌握和控制,但通常氧化鋁產品的強度較小,且分解過程易出現周期性細化,常需在晶種分解過程中加入結晶助劑[110]。而二段分解產品粒度較均勻,強度高,但種子需分成粗、細兩部分,附聚段結束后溶液需中間降溫,工業生產控制難度較大。國內晶種分解生產砂狀氧化鋁主要以法鋁的一段分解技術為原型,而碳酸化分解生產砂狀氧化鋁則采用中南大學開發的“穩定碳分梯度、細顆粒快速附聚、粗顆粒緩慢修飾”的中州模式[111]。
冶金級砂狀氧化鋁產品除了需滿足其物理性能指標外,對其化學純度同樣有嚴格的要求。冶金級產品化學純度主要取決于產品中雜質堿(Na2O)、硅(SiO2)和鐵(Fe2O3)的含量。其中,雜質堿、硅含量主要由SiO2在溶液中的平衡溶解度所決定[26],因此,無論是晶種分解過程還是碳酸化分解過程,控制分解原液的硅量指數是保證分解產品中雜質堿、硅的含量符合要求的前提[112]。而產品中雜質鐵含量的控制是一個棘手的問題,我國拜耳法處理高硫一水硬鋁石礦的生產實踐表明,當礦石中硫含量大于0.7%時,產品中鐵含量將嚴重超標(高達0.1%,質量分數)。一般認為,溶液中未能過濾的鐵以微小氧化鐵水合物顆粒[113]或以羥基鐵酸根配合離子 F e(OH)-4形態存在;尤其是在高硫鋁土礦溶出過程中,黃鐵礦轉變為硫離子和親水的膠體水合氧化鐵和亞鐵硫化物[114?117],這些膠粒因為硫離子的分散作用而在溶液中變得穩定,難以濾除。此外,硫離子的存在還能促進鐵轉變為溶解度更大的硫鐵配合物Na2[FeS2(OH)2]·2H2O,使鋁酸鈉溶液中鐵含量大幅度增加[118?119]。但總體而言,目前這方面的研究還較少,對于鋁酸鈉溶液中鐵的存在形式、影響因素、析出機理及其抑制措施等急待深入研究。
5.2 改變溶液體系的強化分解技術
為了強化鋁酸鈉溶液的分解過程,曾試圖通過改變溶液體系以實現氫氧化鋁結晶過程的強化。這類方法主要有離子膜電解法、萃取法、醇法和NaHCO3法等。其中,離子膜電解法[120]是在電場和離子膜的復合作用下,陰極析出H2同時產生OH?,并與陽極區遷移過來的Na+結合,在電解槽陰極區產生濃NaOH溶液,而陽極則析出O2同時產生H+;陽極區含H+的料漿送入分解槽進行晶種分解,產出氫氧化鋁。其中,電解的作用類似于碳酸化分解中通入的CO2。該法具有溶液分解速率大、分解率和產出率高等優點,但對離子膜的耐堿性要求甚高,因此該法難以工業應用。萃取法[121]是通過脂肪醇或烷基酚從正常的拜耳法循環母液中萃取 Na(K)OH,使母液苛性比降至 1.4~1.5,再一次進行晶種分解,以提高拜耳法循環中氧化鋁的產出率。萃取油相用水反萃后獲得不含鋁的NaOH濃溶液,用于循環溶出鋁土礦或先溶出赤泥中的氧化鋁再溶出鋁土礦,從而強化晶種分解過程。但該法存在嚴重腐蝕設備、后處理工藝復雜、廢液排放量多等缺點。醇法[122?124]是通過向鋁酸鈉溶液中加入乙醇改變鋁酸鈉溶液的性質,降低溶液的穩定性,增加氫氧化鋁結晶驅動力,達到加速鋁酸鈉溶液分解的目的。ZHANG等[125]的研究表明,添加乙醇強化分解的原因可能是由于乙醇與水化鋁酸根離子中的水能形成穩定的氫鍵,從而促進氫氧化鋁的成核過程。該法主要存在醇難以循環利用的問題。此外,向鋁酸鈉溶液中加入NaHCO3,中和溶液中的游離苛性堿,降低溶液的穩定性,亦可強化溶液的分解過程[126?127],但由于碳酸鈉溶液難以循環,導致其實際應用價值不大。
5.3 析出一水軟鋁石的鋁酸鈉溶液分解技術
為降低氫氧化鋁焙燒工序能耗和整個拜耳法生產氧化鋁的能耗,BALLAS等[128?131]自20世紀80年代以來最先對鋁酸鈉溶液分解析出一水軟鋁石進行了探討,隨后許多學者相繼開展了該方面的研究。PANIAS和 PASPALIARIS[132]和李小斌等[133]分別對 Na2OAl2O3-H2O系進行了熱力學計算和分析,結果表明,從過飽和鋁酸鈉溶液析出一水軟鋁石的溫度取決于溶液組成,適當條件下可在 50 ℃下析出一水軟鋁石物相;PANIAS的理論研究[133]表明,降低溶液pH和增加一水軟鋁石晶種量均有利于提高一水軟鋁石的分解效率。在試驗研究方面,1)常壓下、85 ℃以上時,在鋁酸鈉溶液中添加一水軟鋁石晶種可析出一水軟鋁石,這似乎與SKOUFADIS等[134]的動力學研究結果不一致;2) 分解效率與溶液中氧化鋁的過飽和度有關,低過飽和度有利于一水軟鋁石的析出[135];3) 添加細顆粒、大晶種量的一水軟鋁石晶種,可提高溶液的分解率[135];4) 添加酒石酸等有機添加劑[136],在同等分解條件下可降低一水軟鋁石的析出溫度。此外,在分解溫度為120~130 ℃下,向鋁酸鈉溶液中加入一水軟鋁石凝膠可制備高純一水軟鋁石粉體[137];而向鋁酸鈉溶液中加入 H2O2水溶液,溶液中 98%的鋁將以一水軟鋁石的形式析出[138]。迄今為止,雖然在鋁酸鈉溶液析出一水軟鋁石方面開展了大量研究,但由于同等條件下一水軟鋁石析出速率相比三水鋁石的小2個數量級,且一水軟鋁石似乎不發生顆粒間的附聚,導致產品非常細,不適于流態化焙燒[139],因此,目前鋁酸鈉溶液析出一水軟鋁石的研究離大規模工業應用還相差甚遠。此外,適用于未來低溫(<860 ℃)熔鹽電解的高活性、易溶氧化鋁的制備研究亦應是鋁酸鈉溶液分解技術的重要方向之一[48]。
5.4 鋁酸鈉溶液分解技術研究的最新進展
基于溶液離子結構演變[67,74]、添加劑作用機理[101]和顆粒附聚機理[88]等相關理論研究,中南大學在國家“973計劃”項目的資助下先后提出了“固?液界面協同調控強化鋁酸鈉溶液晶種分解”技術和“成核、附聚?再附聚、長大”碳酸化分解技術。前者是通過外場、晶種促進鋁酸鈉本體溶液中含鋁組元向有利氫氧化鋁生長基元轉變,借助高效結晶助劑改變固?液界面性質,強化生長基元向界面擴散、吸附和疊合,同時通過強化顆粒附聚消除細粒子以提高體系的過飽和度,從而在一定程度上有效解決了分解率與分解產品質量間的矛盾。圖4所示為不同分解率下晶種分解產品的 SEM 像,結果表明,采用耦合調控強化分解技術不僅分解率高,而且產品粒度較粗、分布均勻。而后者則是基于溶液碳酸化分解過程中氫氧化鋁成核、附聚和長大子過程間的互匹配規律,在成核、附聚段,控制適宜的溶液過飽和度變化速率和攪拌強度,使細顆粒充分附聚,獲得粒度適中且分布均勻的高活性晶種;在再附聚、長大段,控制較高過飽和度以提供較粗顆粒附聚所需粘結劑,并控制較小的攪拌速率,使較粗粒子再次發生附聚形成更大顆粒,然后在長大過程中,通過改變分解條件,使顆粒在低過飽和度下完成晶體長大,獲得物理性能優良的砂狀產品(見圖5)。

圖4 現行分解工藝與固?液界面調控強化分解技術所得氫氧化鋁產品的SEM像Fig.4 SEM images of gibbsite products obtained by current industrial precipitation technology and strengthening precipitation technology by regulating solid/liquid interfacial properties: (a) Products of traditional technology, precipitation ratio of 51%; (b) Products of new technology, precipitation ratio of 60%

圖5 不同分解率下獲得的Al(OH)3顆粒的SEM像Fig.5 SEM images of Al(OH)3 obtained at different carbonation rates: (a) Precipitation time of 60 min, precipitation ratio of 88.44% for preparing seed; (b) Precipitation time of 360 min, precipitation ratio of 91.25% for products
6 結語
鋁酸鈉溶液分解是從鋁土礦提取氧化鋁過程中至關重要的工序之一,直接影響產品的物理和化學性能以及分解過程的效率。碳酸化分解以前存在的產品質量相對較差的問題,通過試驗研究和工業生產實踐,現已經基本上得到解決;而對于晶種分解過程存在的分解效率低的問題,雖然在宏觀上的熱力學、動力學、顆粒行為、強化分解技術以及微觀上的離子形態及其演變與調控等方面已開展大量的試驗研究工作,但至今始終未能有任何實質性突破。要實現鋁酸鈉溶液的強化分解,解決當前氧化鋁工業上的技術瓶頸問題,則首先必須在分解理論上尋求突破。本文作者認為,鋁酸鈉溶液分解過程中有利于氫氧化鋁結晶析出的含鋁離子種類的確定、其他含鋁離子與該有利結晶析出離子間的相互轉變規律及其調控手段、體系顆粒分布調控以及氫氧化鋁晶體與鋁酸鈉溶液界面性質的調控將是未來鋁酸鈉溶液分解過程理論研究的重要方向。
REFERENCES
[1] 李旺興. 氧化鋁生產理論與工藝[M]. 長沙: 中南大學出版社,2010: 9.LI Wang-xing. Theory and technics of alumina production[M].Changsha: Central South University Press, 2010: 9.
[2] 陳啟元. 有色金屬基礎理論研究: 新方法與新進展[M]. 北京:科學出版社,2005: 88?95.CHEN Qi-yuan. Fundamental theoretical research of non-ferrous metals—New methods and new progresses[M]. Beijing: Science Press, 2005: 88?95.
[3] RUSSELL A S, EDWARDS J D, TAYLOR C S. Solubility and density of hydrated aluminas in NaOH solutions[J]. Journal of Metals, 1955, 7: 1123?1128.
[4] IKKATAI T, OKADA N. Extractive metallurgy of aluminum[M].New York: Interscience, 1963: 159?173.
[5] APPS J A, NEIL J M. Chemical modeling of aqueous solutions(Ⅱ)[M]. Washington DC: American Chemical Society, 1990:414?428.
[6] POKROVSKII V A, HELGESON H G. Thermodynamic properties of aqueous species and the solubilities of minerals at high pressures and temperatures: The system Al2O3-H2O-NaCl[J].American Journal of Science, 1995, 295: 1255?1342.
[7] VERDES G, GOUT R, CASTET S. Thermodynamic properties of the aluminate ion and of bayerite boehmite, diaspore and gibbsite[J]. European Journal of Mineralogy, 1992, 4(4):767?792.
[8] SCHR?DLE S, K?NIGSBERGER E, MAY P M, HEFTER G.Heat capacities of aqueous sodium hydroxide/aluminate mixtures and prediction of the solubility constant of boehmite up to 300℃[J]. Geochimica et Cosmochimica Acta, 2010, 74(8):2368?2379.
[9] ZHOU Jun, CHEN Qi-yuan, LI Jie, YIN Zhou-lan, ZHOU Xia,ZHANG Ping-min. Isopiestic measurement of the osmotic and activity coefficients for the NaOH-NaAl(OH)4-H2O system at 313.2 K[J]. Geochimica et Cosmochimica Acta, 2003, 67(18):3459?3472.
[10] K?NIGSBERGER E, K?NIGSBERGER L C, HEFTER G,MAY P M. Zdanovskii’s rule and isopiestic measurements applied to synthetic Bayer liquors[J]. Journal of Solution Chemistry, 2007, 36(11/12): 1619?1634.
[11] CAIANI P, CONTI G, GIANNI P, MATTEOLI E. Apparent molar heat capacity and relative enthalpy of aqueous sodium hydroxoaluminate between 323 and 523 K[J]. Journal of Solution Chemistry, 1989, 18(5): 447?461.
[12] MAGALH?ES M C F, K?NIGSBERGER E, MAY P M,HEFTER G. Heat capacities of concentrated aqueous alkaline aluminate solutions at 25 ℃[J]. Journal of Chemical and Engineering Data, 2002, 47(4): 960?963.
[13] WESOLOWSKI D J. Aluminum speciation and equilibria in aqueous solution: I. The solubility of gibbsite in the system Na-K-Cl-OH-Al(OH)4from 0 to 100 ℃[J]. Geochimica et Cosmochimica Acta, 1992, 56(3): 1065?1091.
[14] LI Xiao-bin, LU Wei-jun, FENG Gang-tao, LIU Gui-hua, PENG Zhi-hong, ZHOU Qiu-sheng, MENG Yun. The applicability of Debye-Hücklel model in NaAl(OH)4-NaOH-H2O system[J]. The Chinese Journal of Process Engineering, 2005, 5(5): 525?528.
[15] LI Xiao-bin, LU Wei-jun, LIU Gui-hua, PENG Zhi-hong, ZHOU Qiu-sheng, MENG Yun, REN Wan-neng. Activity coefficient calculation model for NaOH-NaAl(OH)4-H2O system[J].Transactions of Nonferrous Metals Society of China, 2005, 15(4):908?912.
[16] 李小斌, 任萬能, 劉桂華, 彭志宏, 周秋生.NaOH-NaAl(OH)4-H2O體系活度系數的計算模型[J]. 中南大學學報: 自然科學版, 2006, 37(3): 493?497.LI Xiao-bin, REN Wan-neng, LIU Gui-hua, PENG Zhi-hong,ZHOU Qiu-sheng. Activity coefficient calculation model for NaOH-NaAl(OH)4-H2O system[J]. Journal of Central South University: Science and Technology, 2006, 37(3): 493?497.
[17] CHANG B T. Determination of thermodynamic properties of gibbsite from its solubility data in NaOH solutions[J]. Bulletin of the Chemical Society of Japan, 1981, 54: 1960?1963.
[18] LI J, PRESTIDGE C A, ADDAI-MENSAH J. The influence of alkali metal ions on homogeneous nucleation of Al(OH)3crystals from supersaturated caustic aluminate solutions[J]. Journal of Colloid and Interface Science, 2000, 224(2): 317?324.
[19] OKU O, YAMADA. The dissolution rate of quarts and the rate of desilication in Bayer liquor[C]//Warrendale, PA: TMS Light Metals, 1971: 31?45.
[20] 彭志宏, 鄧永春, 周秋生, 劉桂華, 李小斌. 無機鹽雜質對鋁酸鈉溶液晶種分解率的影響[J]. 礦冶工程, 2010, 30(1):317?324.PENG Zhi-hong, DENG Yong-chun, ZHOU Qiu-sheng, LIU Gui-hua, LI Xiao-bin. Influence of inorganic salt impurities on seed decomposition rate in sodium aluminate solutions[J].Mining and Metallurgical Engineering, 2010, 30(1): 317?324.
[21] 彭志宏, 王浩宇, 劉桂華, 周秋生, 李小斌. 二氧化硅在鋁酸鈉溶液中的反應行為[J]. 礦冶工程, 2009, 29(6): 57?60.PENG Zhi-hong, WANG Hao-yu, LIU Gui-hua, ZHOU Qiu-sheng, LI Xiao-bin. Reaction behavior of silica in sodium aluminate solution[J]. Mining and Metallurgical Engineering,2009, 29(6): 57?60.
[22] ADAMSON A N, BLOORE E J, CARR A R. Basic principles of Bayer process design[J]. Journal of Extractive Metallurgy of Aluminum, 1963, 1: 23?58.
[23] CRESSWELL P J. Factors affecting desilication of Bayer process liquor[C]//BARTO A C T. The 12th Australian Chemical Engineering Conference, Chemeca 84. Melbourne: Institute of Chemical Engineering, 1984: 285?292.
[24] JAMIALAHMADI M, MüLLER-STEINHAGEN H.Thermodynamic relationships for the solubility of silica in Bayer process liquor[J]. Aluminum Jahrgang, 1992, 68(3): 230?233.
[25] JAMIALAHMADI M, MüLLER-STEINHAGEN H.Determining silica solubility in Bayer process liquor[J]. Journal of the Minerals, Metals and Materials Society, 1998, 50(11):44?49.
[26] 李小斌, 劉桂華, 彭志宏, 翟玉春. 鋁酸鈉溶液中二氧化硅的平衡濃度[J]. 東北大學學報, 2002, 23(3): 251?254.LI Xiao-bin, LIU Gui-hua, PENG Zhi-hong, ZHAI Yu-chun.Equilibrium concentration of SiO2in aluminate solution[J].Journal of Northeastern University, 2002, 23(3): 251?254.
[27] 李小斌, 李永芳, 劉祥民, 劉桂華, 彭志宏, 翟玉春. 復雜硅酸鹽礦物 Gibbs自由能和焓的一種近似計算法[J]. 硅酸鹽學報, 2001, 29(3): 232?237.LI Xiao-bin, LI Yong-fang, LIU Xiang-min, LIU Gui-hua,PENG Zhi-hong, ZHAI Yu-chun. A simple method of estimation of Gibbs free energy and enthalpy of complicate silicates[J].Journal of the Chinese Ceramic Society, 2001, 29(3): 232?237.
[28] 李小斌, 劉祥民, 茍中入, 彭志宏, 劉桂華, 周秋生, 丁安平,李 明, 劉業翔. 鋁酸鈉溶液碳酸化分解的熱力學[J]. 中國有色金屬學報, 2003, 13(4): 1005?1010.LI Xiao-bin, LIU Xiang-min, GOU Zhong-ru, PENG Zhi-hong,LIU Gui-hua, ZHOU Qiu-sheng, DING An-ping, LI Ming, LIU Ye-xiang. Thermodynamics of carbonization of sodium aluminate solution[J]. The Chinese Journal of Nonferrous Metals,2003, 13(4): 1005?1010.
[29] REYNOLDS J G, CARTER R. Density model for sodium hydroxide-sodium aluminate solutions[J]. Hydrometallurgy,2007, 89(3/4): 233?241.
[30] 彭小奇, 宋國輝, 宋彥坡, 張建智, 劉振國.NaOH-NaAl(OH)4-Na2CO3-H2O體系活度因子的計算模型[J].中國有色金屬學報, 2009, 19(7): 1332?1337.PENG Xiao-qi, SONG Guo-hui, SONG Yan-po, ZHANG Jian-zhi, LIU Zhen-guo. Calculation model of activity coefficients for NaOH-NaAl(OH)4-Na2CO3-H2O system[J]. The Chinese Journal of Nonferrous Metals, 2009, 19(7): 1332?1337.
[31] 謝雁麗. 強化鋁酸鈉溶液分解及粗化產品氫氧化鋁粒度的研究[D]. 沈陽: 東北大學, 2000: 60?66.XIE Yan-li. Studies on the strengthening of seeded precipitation of caustic aluminate solution and coarsening the product particle size[D]. Shenyang: Northeastern University, 2000: 60?66.
[32] van STRATEN H A, SCHOONEN M A A, BRUYN P L D.Precipitation from supersaturated aluminate solution. Ⅲ.Influence of alkali ions with special reference to Li+[J]. Journal of Colloid and Interface Science, 1985, 103(2): 493?507.
[33] MULLIN J W. Crystallization[M]. 4th ed. Oxford: Butterworth-Heinemann, 2001: 108?110.
[34] LI Hui-xin, ADDAI-MENSAH J, THOMAS J C, GERSON A R.The crystallization mechanism of Al(OH)3from sodium aluminate solutions[J]. Journal of Crystal Growth, 2005,279(3/4): 508?520.
[35] LI Hui-xin, ADDAI-MENSAH J, THOMAS J C, GERSON A R.The influence of Al(Ⅲ) supersaturation and NaOH on the rate of crystallization of Al(OH)3precursor particles from sodium aluminate solutions[J]. Journal of Colloid and Interface Science,2005, 286(2): 511?519.
[36] LI Xiao-bin, LIU Zhi-jian, XU Xiao-hui, ZHOU Qiu-sheng, LIU Gui-hua. Model of apparent crystal growth rate and kinetics of seeded precipitation from sodium aluminate solution[J]. Journal of Central South University of Technology, 2005, 12(6):662?666.
[37] ROSSITER D S, FAWELL P D, ILIEVSKI D, PARKINSON G M. Investigation of the unseeded nucleation of gibbsite, Al(OH)3,from synthetic Bayer liquors[J]. Journal of Crystal Growth, 1998,191(3): 525?536.
[38] 李 潔, 陳啟元, 尹周瀾. 過飽和鋁酸鈉溶液中氫氧化鋁自發成核動力學規律的研究[J]. 高等學校化學學報, 2003, 24(9):1652?1656.LI Jie, CHEN Qi-yuan, YIN Zhou-lan. Studies on the kinetics of unseeded nucleation of aluminum trihydroxide from supersaturated sodium aluminate solutions[J]. Chemical Journal of Chinese Universities, 2003, 24(9): 1652?1656.
[39] S?HNEL O. Estimation of electrolyte-crystal-aqueous-solution interfacial tension[J]. Journal of Crystal Growth, 1983, 63(1):174?176.
[40] 李小斌, 陳 濱, 周秋生, 劉桂華, 彭志宏, 劉祥民. 鋁酸鈉溶液碳酸化分解過程動力學[J]. 中國有色金屬學報, 2004,14(5): 848?853.LI Xiao-bin, CHEN Bin, ZHOU Qiu-sheng, LIU Gui-hua, PENG Zhi-hong, LIU Xiang-min. Kinetics of carbonization decomposition of sodium aluminate solution[J]. The Chinese Journal of Nonferrous Metals, 2004, 14(5): 848?853.
[41] MISRA C, WHITE E T. Kinetics of crystallization of aluminium trihydroxide from seeded caustic aluminate solutions[J].Chemical Engineering Progress Symposium Series, 1971, 67:53?65.
[42] KING W R. Some studies in alumina trihydrate precipitation kinetics[C]//Light Metals. Chicago, IL: TMS Light Metals, 1973:551?563.
[43] HALFON A, KALIAGUINE S. Alumina trihydrate crystallization. Part Ⅰ. Secondary nucleation and growth rate kinetics[J]. The Canadian Journal of Chemical Engineering,1976, 54(3): 160?167.
[44] WHITE E T, BATEMAN S H. Effect of caustic concentration on the growth rate of Al(OH)3particles[C]//Light Metals. Phoenix,Arizona: TMS Light Metals, 1988: 157?162.
[45] VEESLER S, BOISTELLE R. Growth kinetics of hydrargillite Al(OH)3from caustic soda solutions[J]. Journal of Crystal Growth, 1994, 142(1/2): 177?183.
[46] FARHADI F, BABAHEIDARY M B. Mechanism and estimation of Al(OH)3crystal growth[J]. Journal of Crystal Growth, 2002,234(4): 721?730.
[47] 周秋生, 李小斌, 彭志宏, 劉桂華, 趙清杰, 吳 潔. 高濃度鋁酸鈉溶液晶種分解動力學[J]. 中南大學學報: 自然科學版,2004, 35(4): 557?561.ZHOU Qiu-sheng, LI Xiao-bin, PENG Zhi-hong, LIU Gui-hua,ZHAO Qing-jie, WU Jie. Kinetics of seeded precipitation from sodium aluminate solution with high concentration[J]. Journal of Central South University: Science and Technology, 2004, 35(4):557?561.
[48] ANICH I, BAGSHAW T, MARGOLIS N, SKILLINGBERG M.Alumina technology roadmap[C]//Light Metals. Warrendale, PA:TMS Light Metals, 2002: 193?198.
[49] MAHIN E G, INGRAHAM D C, STEWART O J. The constitution of aluminates[J]. Journal of the American Chemical Society, 1913, 35(1): 30?39.
[50] MOOLENAAR R J, EVANS J C, MCKEEVER L D. Structure of the aluminate ion in solutions at high pH[J]. Journal of Physical Chemistry, 1970, 74(20): 3629?3636.
[51] LIPPINCOTT E R, PSELLOS J E, TOBIN M C. The Raman spectra and structures of aluminate and zincate ions[J]. Journal of Chemical Physics, 1952, 20: 536?541.
[52] CARREIRA L A, MARONI V A, SWAINE J W, PLUMB R C.Raman and Infrared Spectra and Structures of the aluminate ions[J]. Journal of Chemical Physics, 1966, 45(6): 2216?2220.
[53] KRAUS I P, DEREVYANKIN V A, KUZNETSOV S I. Kinetics of formation and the solubility of hydrated sodium aluminosilicate in aluminate solutions[J]. Tsvetnaya Metally,1968, 41(1): 43?46.
[54] BARCZA L, PáLFALVI-RóZSAHEGYI M. The aluminate lye as a system of equilibria[J]. Materials Chemistry and Physics,1989, 21(4): 345?356.
[55] GALE J D, ROHL A L, WATLING H R, PARKINSON G M.Theoretical investigation of the nature of aluminum-containing species present in alkaline solution[J]. Journal of Physical Chemistry B, 1998, 102(50): 10372?10382.
[56] WATLING H R, FLEMING S D, van BRONSWIJK W, ROHL A L. Ionic structure in caustic aluminate solutions and the precipitation of gibbsite[J]. Journal of the Chemical Society,Dalton Transactions, 1998, 23: 3911?3918.
[57] GUTOWSKY H S, SAIKA A. Dissociation chemical exchange,and the proton magnetic resonance in some aqueous electrolytes[J]. Journal of Physical Chemistry, 1953, 21(10):1688?1694.
[58] ANDERSON G M, CASTET S. Reaction of quartz and corundum with aqueous chloride and hydroxide solutions at high temperatures and pressure[J]. American Journal of Science, 1967,265: 1227?1232.
[59] ANDERSON G M, CASTET S. Feldspar solubility and the transport of aluminum under metamorphic condition[J].American Journal of Science, 1983, 238-A: 283?297.
[60] WATLING H. Spectroscopy of concentrated sodium aluminate solution[J]. Journal of Applied Spectroscopy, 1998, 52(2):250?258.
[61] ZáMBó J. Structure of sodium aluminate liquors, molecular model of the mechanism of their decomposition[C]//Light Metals. New Orleans, Louisiana: TMS, 1986, 2: 199?215.
[62] CHEN Qi-yuan, LI Jie, YIN Zhou-lan, ZHANG Ping-min.Decomposition of supersaturated sodium aluminate solution[J].Transactions of Nonferrous Metals Society of China, 2003, 13(3):649?654.
[63] SIPOS P, CAPEWELL S G, MAY P M, HEFTER G T,LAURENCY G, LUKUKáCS F, ROULET R. Spectroscopic studies of the chemical speciation in concentrated alkaline aluminate solutions[J]. Journal of the Chemical Society, Dalton Transactions, 1998, 18: 3007?3012.
[64] 王雅靜, 翟玉春, 田彥文, 韓躍新, 劉連利. 鋁酸鈉溶液結構改變時的表面張力變化[J]. 過程工程學報, 2003, 3(2):121?124.WANG Ya-jing, ZHAI Yu-chun, TIAN Yan-wen, HAN Yue-xin,LIU Lian-1i. Variation of surface tension of sodium aluminate solution with electrolytic microstructure[J]. The Chinese Journal of Process Engineering, 2003, 3(2): 121?124.
[65] 成瓊文, 李小斌, 彭志宏, 劉桂華, 周秋生. 鋁酸鈉溶液的黏度[J]. 中南大學學報: 自然科學版, 2005, 36(2): 229?233.CHENG Qiong-wen, LI Xiao-bin, PENG Zhi-hong, LIU Gui-hua, ZHOU Qiu-sheng. Viscosity of sodium aluminate solution[J]. Journal of Central South University: Science and Technology, 2005, 36(2): 229?233.
[66] LI J, PRESTIDGE C A, ADDAI-MENSAH J. Viscosity, density,and refractive index of aqueous sodium and potassium aluminate solutions[J]. Journal of Chemical and Engineering Data, 2000,45(4): 665?671.
[67] 李小斌, 王丹琴, 梁 爽, 劉桂華, 彭志宏, 周秋生. 鋁酸鈉溶液的電導率與結構的關系[J]. 高等學校化學學報, 2010,31(8): 1651?1655.LI Xiao-bin, WANG Dan-qin, LIANG Shuang, LIU Gui-hua,PENG Zhi-hong, ZHOU Qiu-sheng. Relationship between electric conductivity and ion structure of sodium aluminate solution[J]. Chemical Journal of Chinese Universities, 2010,31(8): 1651?1655.
[68] HEFTER G, MAY P M, SIPOS P, STANLEY A. Viscosities of concentrated electrolyte solutions[J]. Journal of Molecular Liquids, 2003, 103/104: 261?273.
[69] 孫素琴, 胡鑫堯, 洪 梅, 陳念貽, 張聲俊. 鋁酸鈉溶液碳酸化過程的紅外光譜研究[J]. 光譜與光譜分析, 1996, 16(4):21?23.SUN Su-qin, HU Xin-yao, HONG Mei, CHEN Nian-yi, ZHANG Sheng-jun. Study on the carbonation process of sodium aluminate solution with FT-IR spectroscopy[J]. Spectroscopy and Spectral Analysis, 1996, 16(4): 21?23.
[70] 劉吉波. 超聲波強化鋁酸鈉溶液分解過程機理的研究[D]. 長沙: 中南大學, 2004: 73?77.LIU Ji-bo. Research on decomposition mechanism of sodium aluminate solution intensifying by ultrasonic wave[D]. Changsha:Central South University, 2004: 73?77.
[71] 尹建國, 陳啟元, 尹周瀾, 胡慧萍. 陽離子聚丙烯酰胺強化鋁酸鈉溶液種分附聚過程的機理[J]. 中國有色金屬學報, 2008,18(專輯 1): 134?138.YIN Jian-guo, CHEN Qi-yuan, YIN Zhou-lan, HU Hui-ping.Mechanism of cationic polyacrylamide enhancing seeded agglomeration of sodium aluminate liquors[J]. The Chinese Journal of Nonferrous Metals, 2008, 18(Special 1): 134?138.
[72] RADNAI T, MAY P M, HEFTER G T, SIPOS P. Structure of aqueous sodium aluminate solutions: A solution X-ray diffraction study[J]. Journal of Physical Chemistry A, 1998,102(40): 7841?7850.
[73] COUNTER J A, ADDAI-MENSAH J, RALSTON J. The formation of Al(OH)3crystals from supersaturated sodium aluminate solutions revealed by cryovitrification-transmission electron microscopy[J]. Journal of Colloids and Surfaces A:Physicochemical and Engineering Aspects, 1999, 154(3):389?398.
[74] LI Xiao-bin, WANG Dan-qin, ZHOU Qiu-sheng, LIU Gui-hua,PENG Zhi-hong. Concentration variation of aluminate ions during the seeded precipitation process of gibbsite from sodium aluminate solution[J]. Hydrometallurgy, 2011, 106(1/2): 93?98.
[75] PANIAS D. Role of boehmite/solution interface in boehmite precipitation from supersaturated sodium aluminate solutions[J].Hydrometallurgy, 2004, 74(3/4): 203?212.
[76] LI Xiao-bin, FENG Gang-tao, ZHOU Qiu-sheng, PENG Zhi-hong, LIU Gui-hua. Phenomena in late period of seeded precipitation of sodium aluminate solution[J]. Transactions of Nonferrous Metals Society of China, 2006, 16(4): 947?950.
[77] HERRMANN E, STIPETIC J. Thermodynamic properties of Al(OH)3in Bayer liquors[J]. Inorganic Chemistry, 1950, 262:258?287. (in France)
[78] MYERSON A S, TOYOKURA K. Crystallization as a separations process[M]. Washington DC: American Chemical Society, 1990: 329?343.
[79] 張立川, 陳啟元, 尹周瀾. 過飽和鋁酸鈉溶液中Al(OH)3均相成核機理[J]. 中國有色金屬學報, 2008, 18(8): 1560?1565.ZHANG Li-chuan, CHEN Qi-yuan, YIN Zhou-lan. Mechanism of homogeneous nucleation in supersaturated sodium aluminate solutions[J]. The Chinese Journal of Nonferrous Metals, 2008,18(8): 1560?1565.
[80] BROWN N. Secondary nucleation of aluminum trihydroxide in seeded caustic aluminate solutions[J]. Journal of Crystal Growth,1972, 16(2): 163?169.
[81] LI J, PRESTIDGE C A, ADDAI-MENSAH J. Secondary nucleation of gibbsite crystals from synthetic Bayer liquors:effect of alkali metal ions[J]. Journal of Crystal Growth, 2000,219(4): 451?464.
[82] SEYSSIECQ I, VEESLER S, BOISTELLE R, LAMéRANT J M.Agglomeration of gibbsite Al(OH)3crystals in Bayer liquors.Influence of the process parameters[J]. Chemical Engineering Science, 1998, 53(12): 2177?2185.
[83] SEYSSIECQ I, VEESLER S, MANGIN D, KLEIN J P,BOISTELLE R. Modelling gibbsite agglomeration in a constant supersaturation crystallizer[J]. Chemical Engineering Science,2000, 55(23): 5565?5578.
[84] HALFON A, KALIAGUINE S. Aluminina trihydrate crystallization. Part Ⅱ: A model of agglomeration[J]. The Canadian Journal of Chemical Engineering, 1976, 54: 168?172.
[85] MARCHAL P, DAVID R, KLEIN J P, VILLERMAUS J.Crystallization and precipitation engineering Ⅰ. An efficient method for solving population balance in crystallization with agglomeration[J]. Chemical Engineering Science, 1988, 43(1):59?67.
[86] SAKAMOTO K, KANEHARA M. Agglomeration of crystalline particles of gibbsite during the precipitation in sodium aluminate solution[J]. Japanese Chemical Engineering Society, 1971, 35:481?487.
[87] STEEMSON M L, WHITE E T, MARSHALL R J. Mathematical model of the precipitation section of a Bayer plant[C]//Light Metals. LosAngeles, California: TMS, 1984: 237?253.
[88] ZHOU Qiu-sheng, PENG Dian-jun, PENG Zhi-hong, LIU Gui-hua, LI Xiao-bin. Agglomeration of gibbsite particles from carbonation process of sodium aluminate solution[J].Hydrometallurgy, 2009, 99(3/4): 163?169.
[89] FLEMING S, ROHL A, LEE M, GALE J, PARKINSON G.Atomistic modeling of gibbsite: Surface structure and morphology[J]. Journal of Crystal Growth, 2000, 209(1):159?166.
[90] TEPPEN B J, RASMUSSEN K, BERTSCH P M, MILLER D M,SCH?FER L. Molecular dynamics modeling of clay minerals. 1.Gibbsite, kaolinite, pyrophyllite, and beidellite[J]. Journal of Physical Chemistry B, 1997, 101(9): 1579?1587.
[91] VEESLER S, ROURCE S, BOISTELLE R. About supersaturation and growth rates of hydragillite Al(OH)3in alumina caustic solutions[J]. Journal of Crystal Growth, 1993,130(3/4): 411?415.
[92] ADDAI-MENSAH J, RALSTON J. The influence of interfacial structuring on gibbsite interactions in synthetic Bayer liquors[J].Journal of Colloid and Interface Science, 1999, 215(1): 124?130.
[93] ADDAI-MENSAH J, PRESTIDGE C A, RALSTON J.Interparticle forces, interfacial structure development and agglomeration of gibbsite particles in synthetic Bayer liquors[J].Minerals Engineering, 1999, 12(6): 655?669.
[94] PAULAIME A, SEYSSIECQ I, VEESLER S. The influence of organic additives on the crystallization and agglomeration of gibbsite[J]. Powder Technology, 2003, 130(1/3): 345?351.
[95] 謝雁麗, 李尚明, 畢詩文, 楊毅宏, 王 志. 強化鋁酸鈉溶液晶種分解過程的研究[J]. 輕金屬, 2000(7): 18?24.XIE Yan-li,LI Shang-ming,BI Shi-wen,YANG Yi-hong,WANG Zhi. Study of intensified seed precipitation process of sodium aluminate solution[J]. Light Metals, 2000(7): 18?24.
[96] ZENG Ji-shu, YIN Zhou-lan, CHEN Qi-yuan. Intensification of precipitation of gibbsite from seeded caustic sodium aluminate liquor by seed activation and addition of crown ether[J].Hydrometallurgy, 2007, 89(1/2): 107?116.
[97] MISRA C. Industrial alumina chemicals[M]. Washington DC:American Chemical Society Monograph, 1986: 1?165.
[98] ANDRIJA F. Improved method for recovering alumina from aluminate liquor. Germany Patent, 1123184[P]. 1968?08?14.
[99] CHEN Qi-yuan, YIN Jian-guo, YIN Zhou-lan. Effect of mechanically activated seeds on the agglomeration process of supersaturated sodium aluminate liquors[C]//Light Metals,Orlando, Florida: TMS Light Metals, 2007: 157?161.
[100] SEYSSIECQ I, VEESLER S, PèPE G, BOISTELLE R. The influence of additives on the crystal habit of gibbsite[J]. Journal of Crystal Growth, 1999, 196(1): 174?180.
[101] 李小斌, 閻 麗, 周秋生, 彭志宏, 劉桂華. 醚類添加劑 B35對鋁酸鈉溶液晶種分解過程的影響[J]. 中國有色金屬學報,2011, 21(2): 459?464.LI Xiao-bin, YAN Li, ZHOU Qiu-sheng, PENG Zhi-hong, LIU Gui-hua. Effect of ethers additive B35 on seeded precipitation of sodium aluminate solution[J]. The Chinese Journal of Nonferrous Metals, 2011, 21(2): 459?464.
[102] 彭志宏, 劉燕庭, 周秋生, 劉桂華, 李小斌. 非離子型表面活性劑對鋁酸鈉溶液晶種分解的影響[J]. 中國有色金屬學報,2008, 18(10): 1909?1913.PENG Zhi-hong, LIU Yan-ting, ZHOU Qiu-sheng, LIU Gui-hua,LI Xiao-bin. Effect of nonionic surfactant on seeded precipitation of sodium aluminate solution[J]. The Chinese Journal of Nonferrous Metals, 2008, 18(10): 1909?1913.
[103] ROE W J, PERISHO J L. Use of polymers in alumina precipitation in the Bayer process of bauxite beneficiation. US Patent, 4608237[P]. 1986?08?26.
[104] OWEN D O, DAVIS D C. Use of surfactants in alumina precipitation in the Bayer process. United States Patent,0286034[P]. 1988?03?31.
[105] CHEN Feng, ZHANG Ban-yan, BI Shi-wen, XIE Yan-li. Effect of anionics-oily additive on seed precipitation from sodium aluminate solution[J]. Journal of Northeastern University, 2004,25(6): 606?609.
[106] 吳玉勝, 于海燕, 楊毅宏, 畢詩文. 添加劑對鋁酸鈉溶液晶種分解過程附聚及二次成核的影響[J]. 化工學報, 2005, 56(12):2434?2439.WU Yu-sheng, YU Hai-yan, YANG Yi-hong, BI Shi-wen.Effects of additives on agglomeration and secondary nucleation in seed precipitation in sodium aluminate solution[J]. Journal of Chemical Industry and Engineering, 2005, 56(12): 2434?2439.
[107] 薛 紅, 畢詩文, 謝雁麗, 王希慧, 姜小凱, 劉鑄戰. 添加劑強化拜耳法鋁酸鈉溶液分解[J]. 中國有色金屬學報, 1998,8(增刊 2): 415?417.XUE Hong, BI Shi-wen, XIE Yan-li, WANG Xi-hui, JIANG Xiao-kai, LIU Zhu-zhan. The intensifying effect of additives on the seeded precipitation of gibbsite from sodium aluminate solution[J]. The Chinese Journal of Nonferrous Metals, 1998,8(Supple 2): 415?417.
[108] van BRONSWIJK W, WATLING H R, YU Z. A study of the adsorption of acyclicpolyols on hydrated alumina[J]. Journal of Colloids and Surfaces A: Physicochemical and Engineering Aspects, 1999, 157(1/3): 85?94.
[109] SMITH P G, WATLING H R, CREW P. The effects of model organic compounds on gibbsite crystallization from alkaline aluminate solutions: Polyols[J]. Journal of Colloids and Surfaces A: Physicochemical and Engineering Aspects, 1996, 111(1/2):119?130.
[110] WATLING H, LOH J, GATTER H. Gibbsite crystallization inhibition Ⅰ. Effects of sodium gluconate on nucleation,agglomeration and growth[J]. Hydrometallurgy, 2000, 55(3):275?288.
[111] 劉祥民. 燒結法生產砂狀氧化鋁的理論與工藝研究[D]. 長沙:中南大學, 2004: 91?92.LIU Xiang-min. Study on the fundamentals and technology of sandy alumina production by sinter process[D]. Changsha:Central South University, 2004: 91?92.
[112] 李小斌, 周小淞, 周秋生, 彭殿軍, 劉 偉. 高濃度鋁酸鈉溶液碳酸化分解產品中 Na2O含量的控制[J]. 過程工程學報,2008, 8(5): 945?948.LI Xiao-bin, ZHOU Xiao-song, ZHOU Qiu-sheng, PENG Dian-jun, LIU Wei. Control of Na2O content in aluminum hydroxide from carbonization of sodium aluminate solution with high alumina concentration[J]. The Chinese Journal of Process Engineering, 2008, 8(5): 945?948.
[113] CALDEIRA C L,CIMINELLI V S T, DIAS A, OSSEO-ASARE K. Pyrite oxidation in alkaline solutions: Nature of the product layer[J]. International Journal of Mineral Processing, 2003,72(1/4): 373?386.
[114] 孫水裕, 王淀佐, 龍翔云. 硫化礦?溶液界面電子轉移的前線分子軌道理論討論[J]. 北京礦冶研究總院學報, 1994, 3(1):34?39.SUN Shui-yu, WANG Dian-zuo, LONG Xiang-yun. Frontier molecular orbital theory consideration for alectron transfer process across sulfide mineral-solution interface[J]. Journal of Bgrimm, 1994, 3(1): 34?39.
[115] 曲啟恒, 秦美云, 薛紅進. 硫化堿中鐵的存在形式及除鐵機理探討[J]. 無機鹽工業, 1998, 30(1): 27?28.QU Qi-heng, QIN Mei-yun, XUE Hong-jin. Study on existing form and removing mechanism of iron in sodium sulfide[J].Chinese Journal of Inorganic Chemicals Industry, 1998, 30(1):27?28.
[116] AHLBERG E. The surface oxidation of pyrite in alkaline solution[J]. Journal of Applied Electrochemistry, 1990, 20(6):1033?1039.
[117] RIMSTIDT J D, VAUGHAN D J. Pyrite oxidation: A state-ofthe-art assessment of the reaction mechanism[J]. Geochimica et Cosmochimica Acta, 2003, 67(5): 873?880.
[118] GRACHEV V V, KUZNETSOV S. Influence of different sulfur compounds on the solubility of iron in alkaline and aluminate solutions[J]. Nonferrous Metallurgy, 1974(3): 63?67. (in Russian)
[119] KUZNETSOV S, GRACHEV V V, TYURIN N G. Interaction of iron and sulfur in alkaline aluminate solutions[J]. Zhurnal Prikladnoi Khimii, 1975, 48(4): 748?750. (in Russian)
[120] LI Yuan-gao, CHEN Qi-yuan, WANG Song-sen, YIN Zhou-lan,ZHANG Ping-min. Preparation of Al(OH)3by ion membrane electrolysis and precipitation of sodium aluminate solution with seeds[J]. Transactions of Nonferrous Metals Society of China,2008, 18(4): 974?979.
[121] 陳念貽, 陸文聰, 張良苗, 顧松青, 齊利娟, 白萬全. 萃取拜耳法及其物理化學基礎研究[J]. 中國稀土學報, 2006, 24(專輯): 78?81.CHEN Nian-yi, LU Wen-cong, ZHANG Liang-miao, GU Song-qing, QI Li-juan, BAI Wan-quan. Liquid-liquid extraction modified Bayer process and its physico-chemical basis[J].Journal of the Chinese Rare Earth Society, 2006, 24(Special Issue): 78?81.
[122] ANDRIJA F. Improved method for recovering alumina from aluminate liquor. Germany Patent, 1 123 184[P]. 1968?08?14.
[123] WILHELMY R B. Control of form of crystal precipitation of aluminum hydroxide using co-solvents and varying caustic concentration. United States Patent, 4 900 537[P]. 1990?02?13.
[124] 王 雪, 鄭詩禮, 張 懿. 甲醇溶析鋁酸鈉制備氫氧化鋁[J].過程工程學報, 2008, 8(1): 72?77.WANG Xue, ZHENG Shi-li, ZHANG Yi. Preparation of aluminum hydroxide with dissolution of sodium aluminate in methanol-water solvent[J]. The Chinese Journal of Process Engineering, 2008, 8(1): 72?77.
[125] ZHANG Ying, ZHENG Shi-li, DU Hao, XU Hong-bin, WANG Shao-na, ZHANG Yi. Improved precipitation of gibbsite from sodium aluminate solution by adding methanol[J].Hydrometallurgy, 2009, 98(1/2): 38?44.
[126] LI Yan, ZHANG Yi-fei, YANG Chao, ZHANG Yi. Precipitating sandy aluminium hydroxide from sodium aluminate solution by the neutralization of sodium bicarbonate[J]. Hydrometallurgy,2009, 98(1/2): 52?57.
[127] LI Yan, ZHANG Yi-fei, CHEN Fang-fang, YANG Chao,ZHANG Yi. Polymorphic transformation of aluminum hydroxide precipitated from reactive NaAl(OH)4-NaHCO3solution[J]. Crystal Growth and Design, 2011, 11(4):1208?1214.
[128] BALLAS D, COPPIETERS A, KALAITZOGLOU K,KONTOPOULOS A, PANOU G, RIGAS G. Process for production of monohydrate alumina from supersaturated aluminate solutions. European Patent, 996590[P]. 1998?12?30.
[129] PANIAS D, PASPALIARIS I, AMANATIDIS A, SCHMIDT H W, HOLLNAGEL A. Boehmite process: An alternative technology in alumina production[C]//Light Metals. Warrendale,PA: TMS, 2001: 97?103.
[130] PANIAS D, KRESTOU A. Effect of synthesis parameters on precipitation of nanocrystalline boehmite from aluminate solutions[J]. Powder Technology, 2007, 175(3): 163?173.
[131] PANIAS D, ASIMIDIS P, PASPALIARIS I. Solubility of boehmite in concentrated sodium hydroxide solutions: Model development and assessment[J]. Hydrometallurgy, 2001, 59(1):15?29.
[132] PANIAS D, PASPALIARIS I. Thermodynamic determination of the stability area of boehmite (γ-AlOOH) in Al2O3-Na2O-H2O and Al2O3-H2O systems[J]. Erzmetall, 1999, 52(11): 585?595.
[133] 李小斌, 潘 軍, 劉桂華, 彭志宏, 周秋生. 從鋁酸鈉溶液中析出一水軟鋁石的實驗研究[J]. 中南大學學報: 自然科學版,2006, 37(1): 25?30.LI Xiao-bin, PAN Jun, LIU Gui-hua, PENG Zhi-hong, ZHOU Qiu-sheng. Boehmite precipitation from sodium aluminate solution[J]. Journal of Central South University: Science and Technology, 2006, 37(1): 25?30.
[134] SKOUFADIS C, PANIAS D, PASPALIARIS I. Kinetics of boehmite precipitation from supersaturated sodium aluminate solutions[J]. Hydrometallurgy, 2003, 68(1/3): 57?68.
[135] DASH B, TRIPATHY B C, BHATTACHARYA I N, DAS S C,MISHRA C R, PANI B S. Effect of temperature and alumina/caustic ratio on precipitation of boehmite in synthetic sodium aluminate liquor[J]. Hydrometallurgy, 2007, 88(1/4):121?126.
[136] DASH B, TRIPATHY B C, BHATTACHARYA I N, DAS S C,MISHRA C R, MISHRA B K. Precipitation of boehmite in sodium aluminate liquor[J]. Hydrometallurgy, 2009, 95(3/4):297?301.
[137] MISRA C, SIVAKUMAR T J. Boehmite production by precipitation from sodium aluminate solution at elevated temperatures. United States Patent, 4595581[P]. 1986?06?17.
[138] EL-KATATNY E A, HALAWY S A, MOHAMED M A, ZAKI M I. A novel synthesis of high-area alumina via H2O2-precipitated boehmite from sodium aluminate solutions[J].Journal of Chemical Technology and Biotechnology, 1998, 72(4):320?328.
[139] LOH J, VERNON C, LOAN M, BRODIE G. Boehmite and gibbsite precipitation[C]//Light Metals. San Francisco, CA: TMS,2005: 203?208.
Research progress in theory and technology of gibbsite precipitation from sodium aluminate solution
LI Xiao-bin, ZHAO Dong-feng, WANG Dan-qin, YAN Li
(School of Metallurgical Science and Engineering, Central South University, Changsha 410083, China)
The precipitation of sodium aluminate solution is the key process for alumina refinery by alkaline method. The research progress in theory and technology of the precipitation process was summarized. Five important aspects,including the thermodynamics and macrokinetics, aluminium-bearing species present in the aluminate solution and the species evolution, the behavior of aluminum trihydroxide particles, the interaction regulation of the interface between gibbsite particles and aluminate solution and the strengthening techniques for gibbsite precipitation, were discussed. It is held that the aluminate species favoring gibbsite precipitation is A l(OH)-4and thus the ways of converting other complex aluminate species to A l(OH)-4would increase the precipitation rate, and that the key of improving the precipitation rate is to increase the smallest particle size in the late period of precipitation. It is also held that it is the research fundamental of seeded precipitation to study the principle and method for coordinately regulating physicochemical properties of aluminate solution, ion structure and the interaction of the interface between gibbsite particle and aluminate solution.
sodium aluminate solution; seeded precipitation; mechanism; technology; research progress
TF821
A
1004-0609(2011)10-2577-17
國家重點基礎研究發展計劃資助項目(2005CB6237)
2011-04-30;
2011-07-30
李小斌,教授,博士;電話:0731-88830454;傳真:0731-88830453;E-mail: X.B.Li@csu.edu.cn
(編輯 龍懷中)
李小斌教授簡介
李小斌,1962年出生,博士,中南大學教授,博士生導師,享受國務院政府特殊津貼。中國有色金屬學會輕金屬學術委員會委員、氧化鋁專業委員會副主任。長期從事氧化鋁生產技術與理論、工業結晶和冶金廢渣金屬資源化等領域的研究。先后承擔了國家“八五”、“九五”重點科技攻關項目、國家“973”項目課題、國家自然科學基金項目以及中國鋁業、ALCOA(美國鋁業公司)等企業技術開發項目,取得了多項研究成果。先后在國內外公開發表學術論文160余篇;申報國家發明專利12項,已獲授權發明專利9項,多項技術在工業生產中得以應用;主持的“強化燒結法生產氧化鋁新工藝”獲2006年度國家科技發明二等獎和2003年度國家發明專利金獎,作為主要骨干參與的“鋁資源高效利用與高新能鋁材制備的理論與技術”獲2007年度國家科技進步一等獎。由于對企業的突出貢獻,2003年獲中國鋁業公司首屆科技大會科技合作獎。

