超聲處理對大豆分離蛋白溶解性和乳化活性的影響
孫燕婷 黃國清 肖軍霞 仇宏偉
超聲處理對大豆分離蛋白溶解性和乳化活性的影響
孫燕婷 黃國清 肖軍霞 仇宏偉
(青島農業大學食品科學與工程學院,青島 266109)
采用超聲波處理大豆分離蛋白,觀察對其溶解性和乳化活性的影響。結果表明,超聲處理時的溫度和時間、NaCl濃度以及大豆分離蛋白濃度均會影響其溶解性和乳化活性。0.01 g/mL的大豆分離蛋白溶液調節pH 6.0,在室溫(23~25℃)下采用500 W超聲功率處理5 min時,其溶解度最大達1 023μg/mL,是未超聲處理(805.9 μg/mL)的1.3 倍,乳化活性達18.3 mL/g,是未超聲處理(11.9 mL/g)的 1.5 倍。超聲處理可以顯著提高SPI的溶解性和乳化活性,這為拓寬其在食品工業中的應用提供了理論依據。
大豆分離蛋白 超聲處理 溶解性 乳化活性
大豆分離蛋白(Soy protein isolate,SPI)因具有較高的營養價值和功能特性而成為食品加工中的重要原料。但生產過程中采用堿溶酸沉的提取方法,造成部分蛋白質變性而降低或喪失某些功能特性[1-2],如溶解性和乳化性,這在一定程度上限制了它的應用范圍。對SPI進行功能特性的改善是目前研究的熱點,國內外學者主要是通過物理或化學手段來改善其溶解性和乳化性能,包括加熱、酸沉、酶改性、磷酸化和乙酰化等方法[3-6],但這些方法反應激烈、副產物多,效果不太理想,而超聲波是一種物理改性方法,通過改變蛋白質的次級結構來改變蛋白質的理化性能,從而達到改善或者加強蛋白質功能的目的。
超聲波處理的主要原理是超聲波在液體中能產生空化作用,超聲空化是指在超聲場中液體中的微小氣泡隨聲壓變化而產生強烈振蕩,膨脹及崩潰的一系列動力學過程,該過程所產生的瞬時強壓力和局部溫度升高能對溶液中懸浮的粒子產生強烈聲化學效果[7]。本研究主要觀測超聲處理對SPI溶解性及乳化活性的影響,擬找到提高大豆分離蛋白溶解性和乳化活性的方法,從而拓寬其在食品工業中的應用范圍。
1 材料與方法
1.1 材料與試劑
SPI(純度為90%):食品級,青島天新食品添加劑有限公司;福臨門大豆色拉油:食用級,中糧東海糧油工業(張家港)有限公司;牛血清蛋白:天津市巴斯夫化工有限公司;考馬斯亮藍G-250(AR):天津市巴斯夫化工有限公司;十二烷基磺酸鈉(AR):煙臺市三和化學試劑有限公司;其他試劑均為分析純。
1.2 儀器與設備
KQ-500B型超聲波清洗器(功率為500 W):昆山市超聲儀器有限公司;LG10-2.4A高速離心機:北京醫用離心機廠;UV-2000分光光度計:上海尤尼科儀器有限公司;DK-98-II型恒溫水浴鍋:天津市泰斯特儀器有限公司;90-3型雙向定時恒溫磁力攪拌器:上海瀘西分析儀器廠有限公司;迷你多功能漩渦混合振蕩器:上海人和科學儀器有限公司;萬分之一分析天平:上海方瑞儀器廠。
1.3 試驗方法
1.3.1 SPI溶液的超聲處理
在超聲功率500 W下,配制一定濃度的SPI溶液,設置試驗需要的不同超聲處理條件包括處理時間,處理溫度等,將盛有SPI溶液的錐形瓶放入超聲波清洗器中,使SPI溶液面浸入清洗器液面約2~3 cm進行超聲處理。
1.3.2 牛血清白蛋白標準曲線的繪制
采用考馬斯亮藍G250染色法[8]。取6支10 mL的帶塞試管,分別加入1 000μg/mL的牛血清白蛋白溶液 0、0.1、0.2、0.3、0.4、0.5 mL 后補足蒸餾水到 1 mL,從而得到0~500μg/mL的牛血清白蛋白稀釋溶液,取各濃度的稀釋液0.1 mL置另外6支帶塞試管中,分別加入5 mL 100μg/mL的考馬斯亮藍G250溶液,漩渦振蕩混勻,2 min后測定595 nm下各試管的吸光值,并繪制標準曲線。
1.3.3 溶解度的測定
參考1.3.2的方法,測定SPI溶液中可溶性蛋白質的濃度,用每毫升水溶液中溶解的SPI的微克數來表示溶解度[9-10]。將不同條件下得到的SPI溶液搖勻,10 000 r/min離心10 min,取上清液0.1 mL 于10 mL帶塞試管中加入5 mL 100μg/mL的考馬斯亮藍G250溶液,漩渦振蕩混勻,2 min后以考馬斯亮藍G250溶液調零,在595 nm下測定其吸光值。
1.3.4 乳化活性的測定
SPI的乳化性可用乳化活性EAI來表示,采用Molina[11]及 Tang[12]的方法測定乳化活性(EAI),取一定體積一定質量濃度的SPI溶液,加入1/3體積的大豆色拉油,以10 000 r/min的速度高速攪拌5 min后,取1 mL乳化液加入9 mL蒸餾水稀釋,另取1 mL稀釋液與9 mL 1 g/kg的十二烷基磺酸鈉(SDS)溶液混合均勻,用SDS(1 g/kg)做空白對照在500 nm下測吸光值。按下列公式計算:
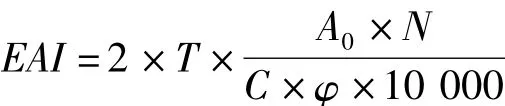
式中,EAI為乳化活性/mL/g;T=2.303;C為乳化液形成前蛋白質水溶液中蛋白濃度/g/mL;φ為乳化液中油的體積分數;N為稀釋倍數。
1.4 數據處理
試驗平行測定3次,采用SAS8.1對數據進行顯著性及相關性分析。
2 結果與分析
2.1 牛血清白蛋白標準曲線
牛血清白蛋白標準曲線如圖1所示。該標準曲線的線性方程為:y=0.000 9x+0.014 3,回歸系數R2=0.991 6,線性良好,因此可通過該標準曲線計算出SPI溶液中蛋白質的濃度。
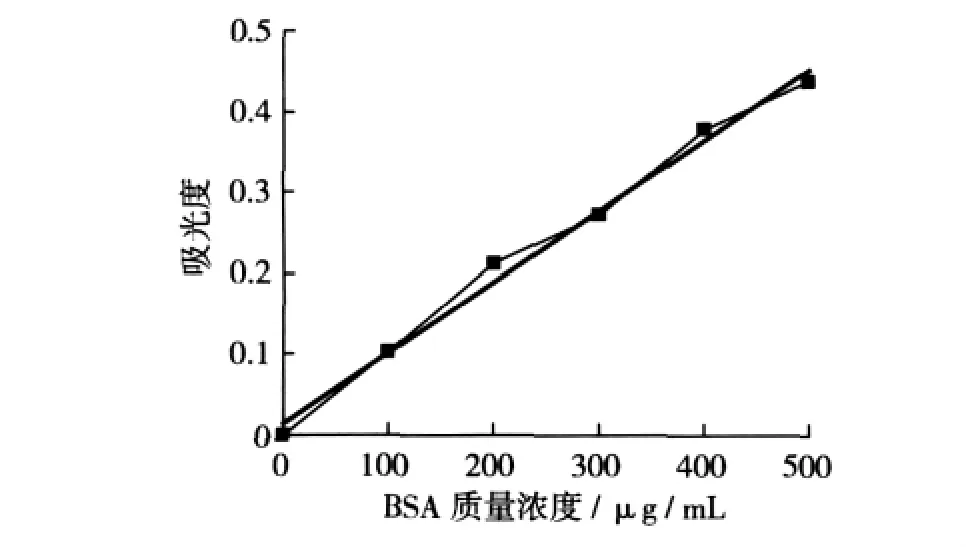
圖1 牛血清白蛋白標準曲線
2.2 未經超聲處理時pH對SPI溶解性及乳化活性的影響
室溫(23~25℃)下配制0.008 g/mL的SPI溶液7份,每份20 mL,分別調節到不同pH,不同pH對SPI溶解度和乳化活性的影響見圖2。由圖2可知,各pH組之間SPI溶液的溶解度都呈極顯著差異(P<0.01),說明pH嚴重影響到SPI的溶解性。pH 1、pH 3、pH 4.5、pH 5 組之間的 SPI乳化活性呈極顯著差異(P<0.01)。SPI在等電點4.5時其溶解性和乳化活性最低,與其他pH組都呈極顯著性差異(P<0.01),這主要是因為蛋白質在等電點剛好呈電中性,分子之間缺乏靜電推斥力,因疏水相互作用導致蛋白質的聚集和沉淀,降低了此條件下蛋白質的溶解性[13]。在pH 4.5以上,隨著 pH 的升高 SPI的溶解度和乳化活性同時增加,SPI在弱酸性環境中的溶解度和乳化活性偏低,限制了在食品工業中的應用范圍,提高SPI在弱酸性條件下溶解度和乳化活性是亟待解決的問題,因此以下試驗環境選用SPI溶液的pH 為 6.0。
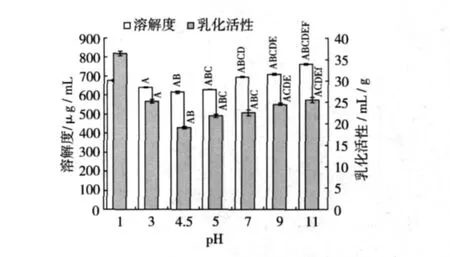
圖2 pH對SPI溶解性及乳化活性的影響
2.3 超聲處理對SPI溶解性及乳化活性的影響
2.3.1 超聲處理時間對SPI溶解性及乳化活性的影響
室溫下配制0.008 g/mL的SPI溶液8份,每份20 mL,調節pH 6.0,在功率為500 W下分別超聲處理不同時間測定其溶解度及乳化活性,結果如圖3所示。當超聲處理5 min時SPI的溶解度和乳化活性分別最大達928.9μg/mL和22.3 mL/g,且與其他組比較均具有極顯著性差異(P<0.01)。原因可能是超聲處理產生強有力的空化和機械作用打斷了可溶蛋白成分的四級結構,短時間內釋放出的小分子亞基或肽分散到溶劑中,使溶解度出現最大值,當處理時間過長時,超聲浸提完全后能量不足以將原有的小分子繼續打斷,從而溶解度變化不大,而此時乳化能力下降后趨于平穩,這可能是由于溶液經超聲處理后,蛋白質三級結構破壞較完全且充分溶解,形成足夠的界面來穩定油滴所致[10]。因此以下試驗過程選用超聲處理時間為5 min。
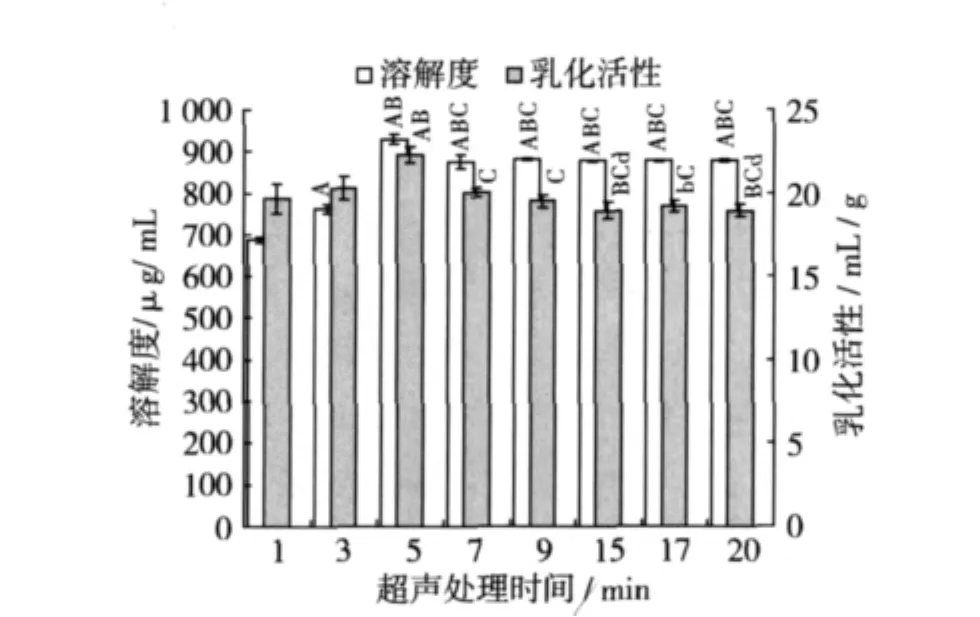
圖3 超聲處理時間對SPI溶解性及乳化活性的影響
2.3.2 超聲處理溫度對SPI溶解性及乳化活性的影響
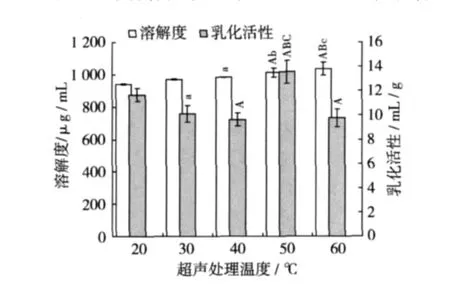
圖4 超聲處理溫度對SPI溶解性及乳化活性的影響
配制0.008 g/mL的SPI溶液5份,每份20 mL,調節pH 6.0,在功率為500 W下以不同溫度超聲處理5 min,冷卻至室溫后測定溶解度及乳化活性,結果如圖4所示,溫度對溶解度和乳化活性的影響程度不一致。SPI的溶解度隨著溫度升高而不斷增加,60℃時SPI的溶解度最大,但與50℃組比較沒有顯著性差異。當處理溫度為50℃時,SPI溶液的溶解度達1 013μg/mL,與20℃、30℃組比較分別呈極顯著(P <0.01)、顯著(P <0.05)性差異;50 ℃時乳化活性最大達13.6 mL/g,與低溫組(20、30、40 ℃)比較呈極顯著性差異(P<0.01),但相對于室溫下只超聲處理5 min的樣品來說,乳化活性卻明顯降低了,考慮到溫度太高容易導致SPI的熱變性影響其溶解性和乳化活性[14],所以以下試驗選用室溫。
2.3.3 超聲處理下NaCl濃度對SPI溶解度和乳化活性的影響
室溫下配制0.008 g/mL的SPI溶液5份,每份10 mL,調節 pH 6.0,分別向其中加入 0.05、0.10、0.15、0.20、0.30 g 的 NaCl,充分溶解,在超聲功率500 W的條件下超聲處理5 min,并與未經超聲處理的樣品組進行對照比較,結果如圖5,圖6所示。超聲處理前后SPI的溶解度和乳化活性都隨NaCl的變化呈先增加后降低的趨勢。經超聲處理后,0.015 g/mL NaCl的SPI溶液的溶解度和乳化活性均取得最大值,并與其他各組相比都呈極顯著性差異(P <0.01),此時 SPI的溶解度達 587.4 μg/mL,是未超聲處理(318.6μg/mL)的1.8倍;而乳化活性達9.1 mL/g,是未超聲處理(7.6 mL/g)的 1.2 倍。0.008 g/mL的SPI溶液中不含有NaCl時,在同樣條件下,其溶解性和乳化活性分別是928.9μg/mL和22.3 mL/g。由此可知,0.015 g/mL NaCl降低了 SPI的溶解性和乳化活性,而超聲處理雖然可以提高其溶解性和乳化活性,但相比不經過NaCl處理的SPI溶液,其溶解性和乳化活性還是偏低。這說明SPI溶液中的NaCl濃度偏高,大部分水分子與NaCl牢固的結合,使之不能滿足SPI溶劑化所需水分子的要求,因此,SPI-SPI的相互作用比SPI-水的相互作用更強,這樣便導致SPI分子聚集,從而使SPI的溶解度和乳化活性降低[4]。

圖5 NaCl濃度對SPI溶解性及乳化活性的影響
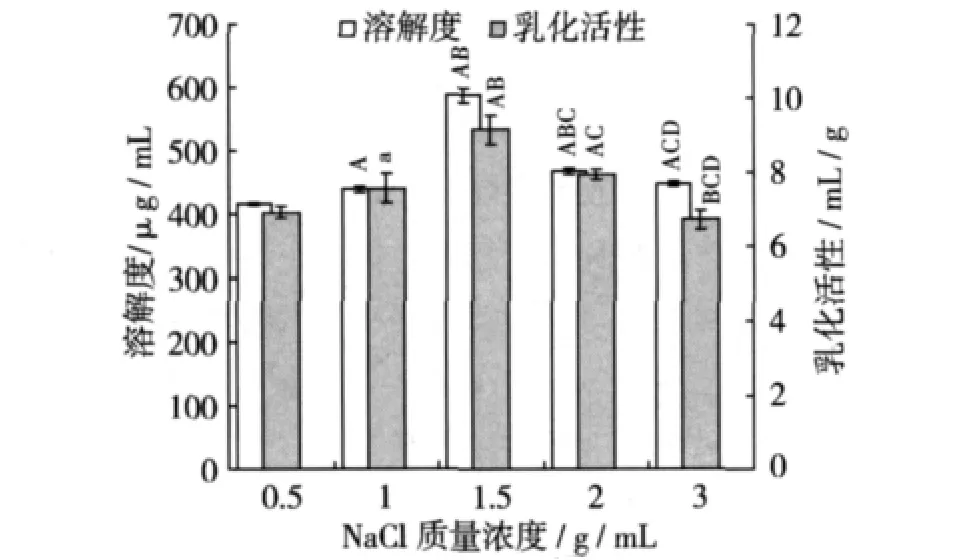
圖6 超聲處理下NaCl濃度對SPI溶解性及乳化活性的影響
2.3.4 超聲處理下SPI濃度對其溶解度和乳化活性的影響
室溫下配制不同濃度的SPI溶液6份,每份10 mL,調節pH 6.0,在超聲功率500 W的條件下超聲處理5 min,與未經超聲處理的樣品組進行對照比較,結果如圖7,圖8所示。在試驗濃度范圍以內,SPI的溶解性都隨其濃度的增加而增加,且各組之間都呈極顯著性的差異(P<0.01)。未經超聲處理的SPI溶液乳化活性在濃度為0.002 g/mL時最大,隨著SPI濃度的增加,乳化活性呈下降趨勢,這說明低濃度時蛋白質分子彼此靠在一起形成膠束,此時膠束的形成有利于乳化活性的提高,但乳化液達到臨界膠束濃度(CMC)時,油水界面上的乳化劑不隨濃度增加而增多,以至乳化活性不再升高 。經超聲處理的SPI溶液乳化活性隨其濃度的變化而變化,0.008 g/mL溶液的乳化活性最大,但與 0.01 g/mL SPI比較沒有顯著差異。當SPI為0.01 g/mL時,超聲處理后的SPI溶解度最大達1 023μg/mL,是未超聲處理(805.9 μg/mL)的 1.3 倍,乳化活性達 18.3 mL/g,是未超聲處理(11.9 mL/g)的 1.5 倍,這說明超聲處理可以顯著提高SPI的溶解性和乳化活性。
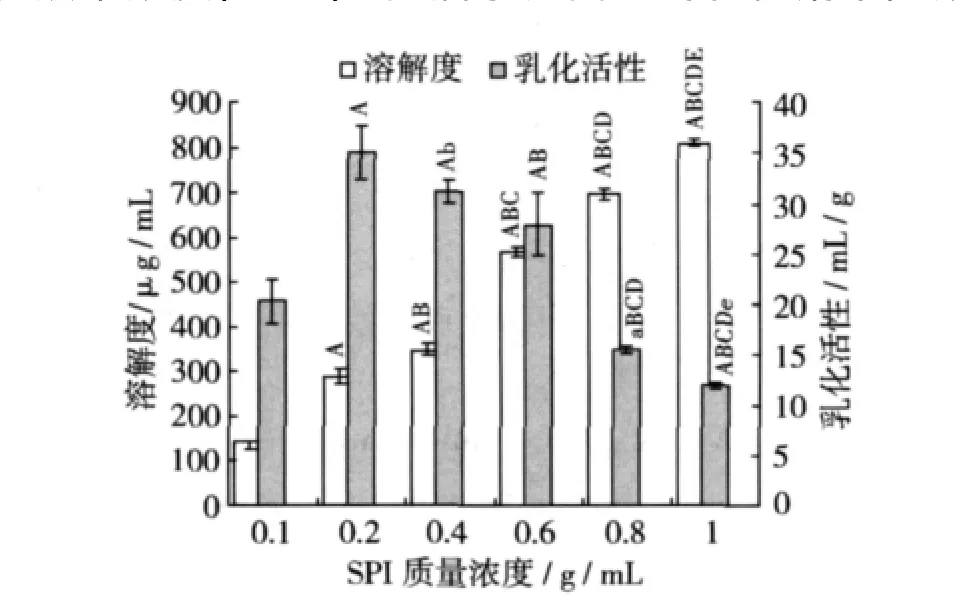
圖7 SPI 濃度對其溶解性及乳化活性的影響
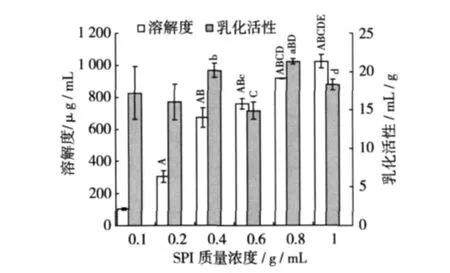
圖8 超聲處理下SPI濃度對其溶解性及乳化活性的影響
3 結論
SPI在蛋白質等電點時,其溶解度和乳化活性最小。隨著pH的升高SPI的溶解度和乳化活性同時增加。為了提高SPI在pH 6.0弱酸性條件下溶解度和乳化活性,采用功率為500 W的超聲波處理不同條件下的SPI溶液,觀察其溶解度和乳化活性的變化情況。結果表明,在超聲處理5 min時,SPI的溶解度和乳化活性取得最大值,且與其他各組均具有極顯著性差異(P<0.01),因此確定最佳超聲時間為5 min;而當超聲處理溫度為50℃時,雖然SPI的溶解度和乳化活性相比于低溫度組差異顯著,但與室溫下只經過超聲處理5 min的樣品相比較,溶解性變化不大,乳化活性卻明顯降低了,選用室溫經超聲處理仍然符合試驗的要求。
0.008 g/mL的SPI溶液,室溫下采用500 W超聲功率處理5 min,0.015 g/mL NaCl降低了 SPI的溶解性和乳化活性;當SPI濃度在0.001~0.01 g/mL時,室溫下采用500 W超聲功率處理5 min時,SPI的溶解性都隨其濃度的增加而增加,且各組之間都呈極顯著性的差異(P<0.01);而SPI乳化活性隨其濃度的變化而變化,0.008 g/mL SPI溶液的乳化活性最大,但與0.01 g/mL SPI比較沒有顯著差異;SPI在0.01 g/mL時,溶解度和乳化活性分別達1 023μg/mL和18.3 mL/g,分別是未超聲處理的1.3倍和1.5倍,這說明超聲處理可以顯著提高SPI的溶解性和乳化活性,該研究為SPI在酸性食品中的應用提供了理論基礎。
[1]Delia A S,Jorge R W.Comparative study of foaming properties of whey and isolate soybean protein[J].Food research international,2002,35:721 -729
[2]謝良,王璋,蔡寶玉.大豆分離蛋白的組成與功能性質[J].中國糧油學報,2000,12(6):6 -10
[3]周瑞寶,周兵.蛋白質的生物和化學改性[J].中國油脂,2000,25(6):181 -185
[4]李秀川,遲玉杰.大豆分離蛋白溶解性能與水解度相關的研究[J].中國糧油學報,2009,24(7):38-40
[5]海日罕,遲玉杰.微波輔助磷酸化改性提高大豆分離蛋白乳化性的研究[J].中國糧油學報,2009,24(6):37 -39
[6]Liu C,Wang X S,Mah,et al.Functional properties of protein isolates from soybeans stored under various conditions[J].Food Chem,2008,111(1):29 -37
[7]鄭家豐.大豆蛋白的功能特性研究[J].中國糧油學報,1996(4):21-24
[8]張水華.食品分析[M].北京:中國輕工業出版社,2004:164
[9]朱建華,楊曉泉,鄒文中,等.超聲處理對大豆分離蛋白功能特性的影響[J].食品科學,2004,25(7):58
[10]袁道強,楊麗.超聲波改性提高大豆分離蛋白酸性條件下溶解性的研究[J].糧食與飼料工業,2008,1:28
[11]Molina E,Papadopoulou A,Ledward D A.Emulsifying properties of high pressure treated soy protein isolate and 7Sand 11Sglobulins[J].Food Hydrocolloids,2001(15):263-269
[12]Tang Chuanhe,Yang Xiaoquan,Chen Zhong,et al.Physicochemical and structural characteristics of sodium caseinate biopolymers induced by microbial transglutaminase[J].Journal of Food Biochemistry,2005,29(4):402 -421
[13]楊帆,童正明,戴杏云.大豆分離蛋白的性質分析與改性研究[J].食品研究與開發,2006,27(7):87-89
[14]郭鳳仙,熊幼翎,何志勇,等.熱處理對大豆分離蛋白功能特性的影響[J].食品與機械,2009,25(6):55-57
[15]張根生,岳曉霞,李繼光,等.大豆分離蛋白乳化性影響因素的研究[J].食品科學,2006,27(7):49.
Effects of Ultrasonic Exposure on the Solubility and Emulsifying Properties of Soy Protein Isolate
Sun Yanting Huang Guoqing Xiao Junxia Qiu Hongwei
(College of Food Science and Engineering,Qingdao Agricultural University,Qingdao 266109)
The objective of this paper is to explore the effect of ultrasonic exposure on the solubility and emulsifying properties of soy protein isolate(SPI).The results showed that ultrasonic treatment temperature,duration,and NaCl and SPIconcentration significantly influenced the solubility and emulsifying properties of SPI.The maximum solubility was obtained in the SPI concentration 0.01 g/mL,pH 6.0,ultrasonic power 500 W,and exposure duration 5 min in room temperature(23 ~25 ℃),which reached up to 1 023 μg/mL,1.3 times higher than untreated SPI(805.9 μg/mL).Under these conditions,the emulsion capacity reached 18.3 mL/g,1.5 times higher than untreated SPI(11.9 mL/g).Hence,ultrasonic exposure can significantly improve the solubility and emulsifying properties of SPI.This paper has provided a theoretical basis for the application of ultrasonic treatment in the food processing industry.
soy protein isolate,ultrasonic Tech-nology,solubility,emulsifying property
TS201
A
1003-0174(2011)07-0022-05
山東省自然科學基金(6210a7)
2010-08-13
孫燕婷,女,1986年出生,碩士,食品科學
肖軍霞,女,1977年出生,副教授,碩士生導師,功能性成分與微囊化

