新型混配配合物雙(3,5-二甲基吡唑)和2,6-吡啶二甲酸合鋅的合成及其晶體結構*
朱萬仁, 丁樹紅, 李家貴, 陳 淵, 劉國聰, 朱宇林, 黃肇宇
(玉林師范學院 化學與生物系,廣西 玉林 537000)
吡唑類化合物具有良好的除草、殺蟲、殺菌活性,因其高效、低毒,以及吡唑環上取代基可以多方位變換,在農藥領域得到廣泛應用[1~5];對一些吡唑與其它雜環相連的化合物的研究已成為成為當今農藥界的熱點之一[6]。
多取代吡唑的研究相對較少,為了有效地研制殺蟲劑或殺菌劑,本文合成了新型配合物雙(3,5-二甲基吡唑)和2,6-吡啶二甲酸合鋅[1, Zn(C7H3NO4)(C5H8N2)2],其結構經1H NMR, IR, 元素分析和X-射線單晶衍射分析表征。
1 實驗部分
1.1 儀器與試劑
WRS-1B型數字熔點儀(溫度計未校正);Bruker AVANCE-500型核磁共振儀(CDCl3為溶劑,TMS為內標);Nicolet-460型紅外光譜儀(KBr壓片);PE-2400Ⅱ型元素分析儀;Bruker Smart-1000 CCD型X-射線衍射儀。
2,6-吡啶二甲酸,自制;其余所用試劑均為分析純或化學純。
1.2 合成
(1) 配體3,5-二甲基吡唑的合成[7]
在三頸燒瓶中加入乙酰丙酮6.0 g(60 mmol)的95%乙醇(25 mL)溶液,攪拌下滴加80%水合肼4.8 g(72 mmol)的95%乙醇(15 mL)溶液, 回流反應4 h。旋蒸濃縮至約15 mL,冷卻析晶,抽濾,濾餅用50%乙醇重結晶,干燥得無色片狀晶體3,5-二甲基吡唑4.26 g,產率74.1%, m.p.106 ℃~107 ℃;1H NMRδ: 11.20(s, 1H, NH), 2.37(s, 3H, CH3), 2.79(s, 3H, CH3), 5.89(s, 1H, ArH); IRν: 3 212, 1 596, 1 484, 1 428, 1 306 cm-1; Anal. calcd for C5H8N2: C 62.47, H 8.39, N 29.14; found C 61.89, H 8.54, N 28.85。
(2) 1的合成
在三頸燒瓶中依次加入3,5-二甲基吡唑385 mg(4 mmol)的無水乙醇(5 mL)溶液,2,6-吡啶二甲酸334 mg(2 mmol)和碳酸鈉212 mg的水(3 mL~5 mL)溶液,無水醋酸鋅367 mg(2 mmol)的水(3 mL~5 mL)溶液,攪拌下回流反應30 min。冷卻,過濾,濾液移至三角瓶(25 mL)中,用保鮮膜封口,扎兩個小孔以利于溶劑揮發,貼上標簽,靜置培養晶體14 d得無色晶體1。IRν: 3 256, 3 152, 1 602, 1 597, 1 482, 1 426, 1 306, 544, 485 cm-1; Anal.calcd for C17H19N5O4Zn: C 48.30, H 4.53, N 16.57; found C 47.92, H 4.16, N 16.39。
1.3 1的晶體結構測定
取0.25 mm×0.15 mm×0.12 mm的1單晶置于X-射線單晶衍射儀上,用石墨單色化的Mo Kα輻射為光源,于2.65°≤θ≤23.46°收集6 436個強反射數據,其中1 724個為獨立衍射點(Rint=0.036 2)。晶體結構由直接法解出,非氫原子的坐標是在以后的數輪差值Fourier合成中陸續確定的,對全部非氫原子的坐標及各向異性參數用SHELXL-97程序以最小二乘法精修F2。
2 結果與討論
2.1 1的IR分析
在1的IR譜圖中,位于3 256 cm-1處的吸收峰歸屬為吡唑環的N-H鍵伸縮振動;在3 152 cm-1附近出現吡唑環的C-H伸縮振動吸收;在1 602 cm-1處出現C=O雙鍵的伸縮振動,但已經明顯紅移;在544 cm-1出現一個振動吸收峰,這主要是鋅與吡唑環上的氮形成配位鍵的伸縮振動產生的吸收[8],這些都說明形成了配合物。
2.2 1的晶體結構解析
1的部分鍵長和鍵角見表1;分子結構圖,沿c軸方向晶胞圖和晶胞堆積圖見圖1~圖3。
晶體結構解析表明,偏差因子R1=0.036 3,wR2=0.098 6。1(C17H19N5O4Zn, Mr=422.76)屬單斜晶系,空間群C2/c,晶胞參數a=13.976(5) ?,b=9.541(3) ?,c=14.238(7) ?,α=90.000°,β=111.386(3)°,γ=90.000°,Z=4,V=1 767.8(12) ?3,Dc=1.588 g·cm-3,μ=1.424 mm-1,F(000)=872。差值電子密度最高和最低峰為293 e·nm-3和-279 e·nm-3。
由圖1和表1可見,1中吡唑環的各鍵長:C5-N3, C7-N2, C5-C6, C6-C7, N2-N3在1.334(4) ?~1.390(4) ?,各鍵長非常接近,介于單雙鍵之間;且吡唑環內角C5-N3-N2, N3-C5-C6, C5-C6-C7, N2-C7-C6, C7-N2-N3在105.5(2)°~111.7(2)°,與五邊形內角108° 基本接近,表明此五元環還具有良好的共平面性和共軛性。
由圖1和表1還可以看出,1由2個3,5-二甲基吡唑,1個2,6-吡啶二羧基,1個中心Zn(Ⅱ)

圖 1 1的分子結構圖
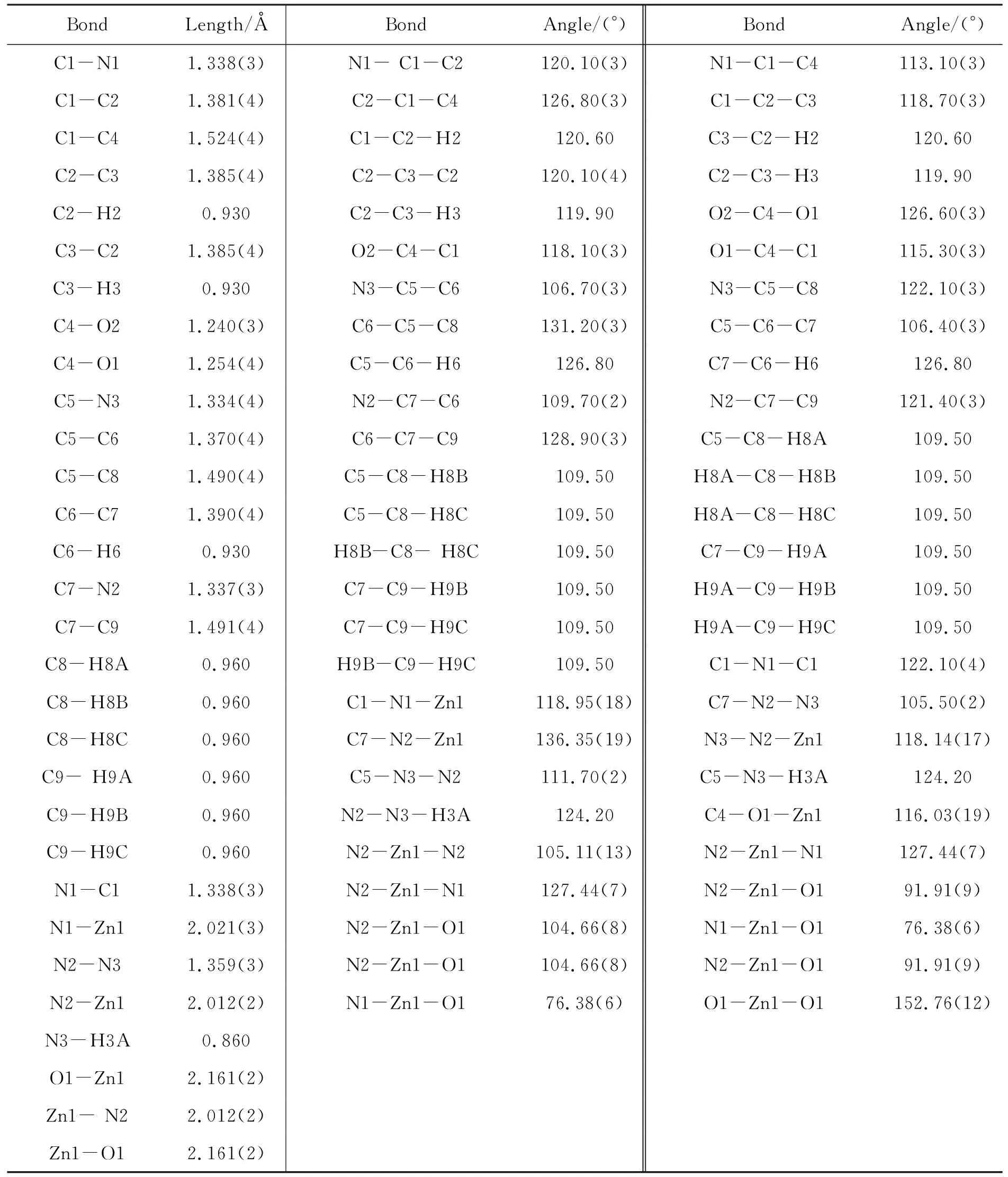
表 1 1的部分鍵長和鍵角
離子組成,中心離子Zn(Ⅱ)與2,6-吡啶二羧基形成鹽,再分別與2個3,5-二甲基吡唑的N2配位,形成四面體結構。配位鍵鍵長O1-Zn1和N2-Zn1分別為2.161(2) ?和2.012(2) ?; 鍵角N2-Zn1-N2, N2-Zn1-N1, N2-Zn1-O1, N2-Zn1-O1, N1-Zn1-O1,O1-Zn1-O1分別為105.11(13)°, 127.44(7)° , 91.91(9)°, 104.66(8)°, 76.38(6)°和152.76(12)。其中鍵角O1-Zn1-O1最大,接近153°,是鍵角N1-Zn1-O1(較小,略微受到擠壓)的兩倍。
從晶胞堆積圖(圖3)可以看出,1晶體主要是靠分子間作用力形成的。從圖2和圖3還能看出,晶體內存在氫鍵O┈H┈N,這對于穩定整個晶體結構起到了重要的作用, 通過氫鍵使晶體結構擴展形成三維體型結構。
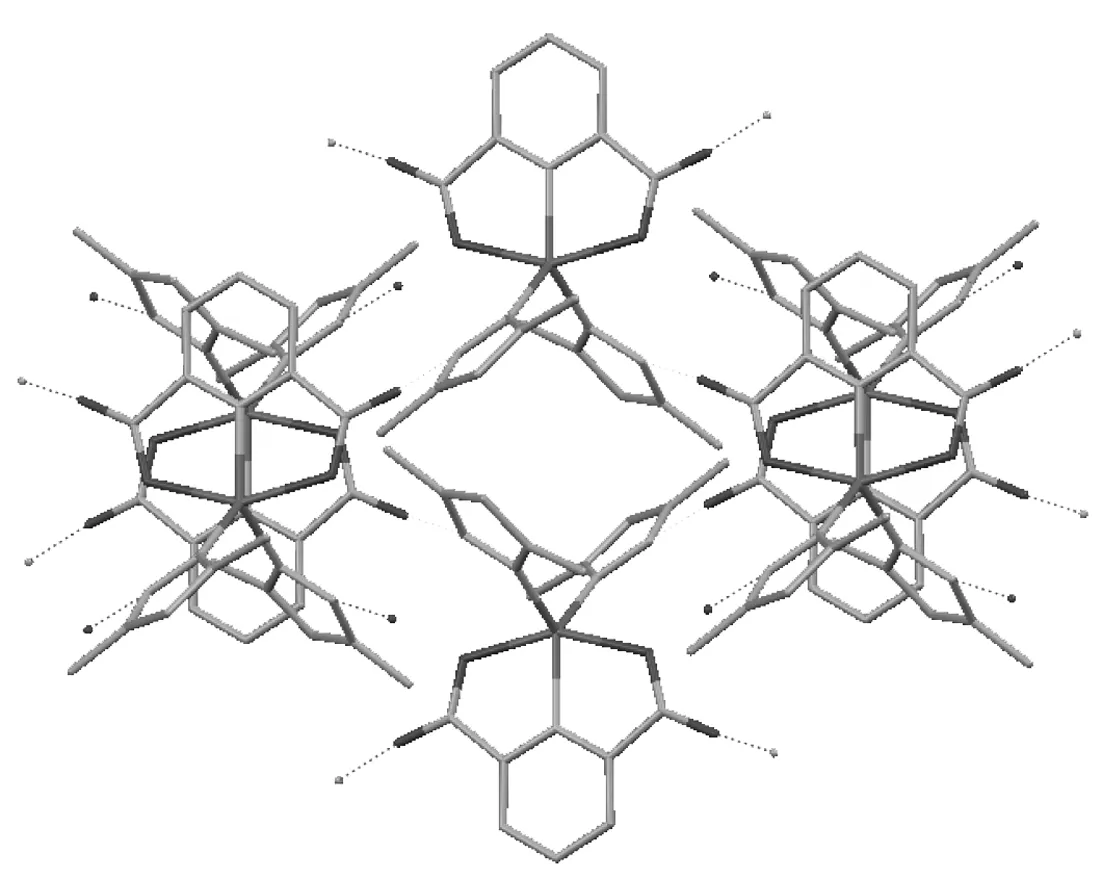
圖 2 沿c軸方向1的晶胞圖

圖 3 1的晶胞堆積圖
3 結論
通過2,6-吡啶二甲酸和3,5-二甲基吡唑為配體,合成了混配配合物1。1屬單斜晶系,空間群為C2/c。1中鋅離子位于變形六面體的中心,變形六面體的5個頂點分別由來自于2個配體2,6-吡啶二羧基吡啶環上的氮原子和2個甲酸根上的氧原子,以及兩個吡唑環上各自一個N原子,組成3N+20型的五配位環境,每個吡唑環均以單齒方式參與配位,而2,6-吡啶二甲羧基作為二雙齒配體參與配位,與鋅離子發生配位形成混配配合物1。通過氫鍵使晶體結構擴展形成三維體型晶體結構。
[1] Jennifer A Townes, Adam Golebiowski, Michael P,etal. The development of new bicyclic pyrazole-based cytokine synthesis inhibitors[J].Bioorg Medi Chem Lett,2004,14(19):4945-4948.
[2] Sharp S, Boxall K, Matthews T,etal. Biological evaluation of a novel,synthetic pyrazole class of Hsp90 inhibitors[J].Euro J of Cancer Supplements,2004,2(8):105-108.
[3] 鄒小毛,程永浩,任雪玲,等. 新型吡唑腙類化合物的合成[J].有機化學,2005,25(5):554-557.
[4] 劉長令,雷新,劉武成,等. 新型吡唑甲酰脲類化合物的合成及其生物活性[J].合成化學,1997,5:394-398.
[5] 田官榮,房立真,吳明根,等. 稻田除草劑吡唑特的合成和除草效果[J].殺蟲劑,2005,44:205-207.
[6] 李梅,王振寧,宋寶安,等. 吡唑類衍生物殺菌活性研究進展[J].農藥,2008,47:391-397.
[7] 朱萬仁,胡培植,李美英,等. 2,6-吡啶二甲酰雙吡唑衍生物的合成[J].合成化學, 2004,12(1): 28-30.
[8] 馬衛興,錢保華,李善忠,等. 混配配合物[Zn(CF3)2(C7H6NS)2]的合成、晶體結構及表征[J].無機化學學報,2006,22(10):1925-1928.

