有機(jī)小分子催化的不對稱胺化反應(yīng)的研究進(jìn)展*1
李艷春, 明俊男, 王斐英, 付記亞, 王琪琳, 徐小英, 王立新
(1. 中國科學(xué)院 成都有機(jī)化學(xué)研究所 手性技術(shù)與不對稱合成四川省重點(diǎn)實(shí)驗(yàn)室,四川 成都 610041; 2. 中國科學(xué)院 研究生院,北京 100039)
手性含氮化合物廣泛存在于自然界中[1],不對稱C-N鍵形成反應(yīng)是構(gòu)建含氮化合物的重要方法,如亞胺[2~5]、硝基烯[6~8]、氰基化合物[7~11]、偶氮二羧酸酯[RO2CN=NCO2R(1a~1d, R=Et, Bn,t-Bu,i-Pr)][12~15]等參與的不對稱反應(yīng)。其中1參與的不對稱催化反應(yīng)是形成C-N鍵的重要方法之一,催化劑主要包括金屬催化劑及有機(jī)小分子催化劑。近年來,有機(jī)小分子催化的不對稱胺化反應(yīng)得到了很大的發(fā)展,各種不同的有機(jī)小分子催化劑被用于催化不對稱胺化反應(yīng)。
本文根據(jù)催化劑的類型并結(jié)合其反應(yīng)機(jī)理,介紹近幾年來以1作氮源的有機(jī)小分子催化的不對稱胺化反應(yīng)的研究進(jìn)展。
1 脯氨酸及其衍生物作催化劑
J?rgensen[12]和List[13]報道了L-脯氨酸(L-proline)催化的醛(2)與1a,1b或1c的不對稱胺化反應(yīng)(Scheme 1),取得了很好的收率(57%~92%)和對映選擇性(89%ee~95%ee)[12]。

Chart 1
基于胺化產(chǎn)物的絕對構(gòu)型,作者提出了反應(yīng)的過渡態(tài)模型如Chart 1所示: L-proline的仲胺與醛形成烯胺,活化醛;L-proline的羧基質(zhì)子與1的氮形成氫鍵,活化1。該不對稱胺化反應(yīng)可以由廉價易得的原料和催化劑方便地得到手性氨基醛、氨基醇、氨基酸等。
J?rgensen等[14]研究發(fā)現(xiàn),L-proline也能很好地催化酮(3)與1a的反應(yīng)(Scheme 2),高收率(67%~92%)和高對映選擇性(79%ee~99%ee)地得到亞甲基胺化產(chǎn)物4。
Br?se等[15]采用L-proline催化大位阻的支鏈醛(5)與1a或1b的反應(yīng)構(gòu)建季碳中心的含氮化合物。以二氯甲烷為溶劑,于室溫反應(yīng),但結(jié)果并不理想(Scheme 3),反應(yīng)時間較長。他們[16,17]進(jìn)一步研究發(fā)現(xiàn),以乙腈為溶劑,在微波條件下于60 ℃反應(yīng),反應(yīng)時間明顯縮短,且收率(52%~99%)和對映選擇性(52%ee~90%ee)都有提高。
Barbas等[18]發(fā)現(xiàn)L-proline也能很好的催化醛,丙酮和1b的不對稱串聯(lián)反應(yīng),反應(yīng)取得了較好的收率(75%~85%)和對映選擇性(99%ee)(Scheme 4)。作者將該反應(yīng)用于合成腎素抑制劑氨基二醇。在前面研究的基礎(chǔ)上,他們[19]發(fā)現(xiàn)L-proline還能很好地催化2,3-二氫-1H-茚-1-甲醛(8)的不對稱胺化反應(yīng),高選擇性地得到胺化產(chǎn)物9(Scheme 5),9是一類重要的藥物骨架結(jié)構(gòu)(如代謝型谷氨酸受體拮抗劑AIDA, APICA)。
Adolfsson等[20]合成了一系列脯氨酸衍生的仲胺砜類催化劑,用來催化醛與1的不對稱胺化反應(yīng),通過催化劑的篩選,10a(Chart 2)的催化效果最好,最高得到87%ee的胺化產(chǎn)物。
Barbas等[21]設(shè)計了仲胺四唑催化劑10b(Chart 2)用于催化支鏈醛(5a, R1=Me, R2=BrC6H4-, Scheme 3)與1b的反應(yīng),得到了80%ee的對應(yīng)胺化產(chǎn)物。Ley等[22]也用10b催化醛與1的不對稱胺化反應(yīng),胺化產(chǎn)物不經(jīng)處理直接與含一個烯丙基的季磷鹽反應(yīng),中間經(jīng)不穩(wěn)定的膦葉立德中間體(11),再發(fā)生分子內(nèi)的Wittig反應(yīng),得到高對映選擇性的1,6-二氫噠嗪類化合物(12, Scheme 6)。
J?rgensen等[23]發(fā)現(xiàn)在脯氨酸硅醚(10c, Chart 3)作用下,α,β-不飽和醛(13)與硫醇(14)發(fā)生1,4-共軛加成,同時,加成產(chǎn)物在10c的活化下與1發(fā)生Michael加成反應(yīng),再經(jīng)還原、環(huán)化得到含兩個手性中心的加成產(chǎn)物15(Scheme 7)。他們還發(fā)現(xiàn)以琥珀酰亞胺(16)為給體時,也可以得到很好的結(jié)果(17, Scheme 8)[24]。其反應(yīng)歷程為:在酸性條件下,10c與13縮合脫水得α,β-不飽和亞胺正離子,再與16發(fā)生1,4-加成得烯胺中間體,隨后再與1a發(fā)生親核加成,催化劑離去得17。他們[25]發(fā)現(xiàn)10c還能很好地催化1對13的γ-胺化反應(yīng),以苯甲酸作添加劑時得到中等收率(40%~58%)和高對映選擇性(88%ee~93%ee, Scheme 9)。通過理論計算和實(shí)驗(yàn)證明了其催化機(jī)理為:10c與底物13形成烯胺二烯體中間體烯胺二烯(19),從而達(dá)到由13的缺電子二烯體轉(zhuǎn)變?yōu)楦浑娮拥?9;19與1會同時發(fā)生[4+2]環(huán)加成和γ-胺基化反應(yīng),但環(huán)加成產(chǎn)物易水解,由動態(tài)平衡最后得到熱力學(xué)穩(wěn)定的18。
2 金雞納堿衍生物作催化劑
2004年,J?rgensen課題組[26]首次報道了金雞納堿類衍生物20(Chart 3)催化的α-腈基取代的酯23的不對稱胺化反應(yīng),1的取代基對反應(yīng)活性及立體控制起關(guān)鍵作用,當(dāng)R為大位阻的t-Bu時反應(yīng)結(jié)果最好,ee值達(dá)到98%。催化劑20對該反應(yīng)有很好的普適性,不論23之Ar的取代基是吸電子的還是供電子的,或者雜原子的噻吩,都能得到很好的反應(yīng)結(jié)果(收率95%~99%, 91%ee~98%ee),而取代基的位置對反應(yīng)結(jié)果影響不大(Scheme 10)。
當(dāng)β-酮酸酯或β-二酮為給體時,也能得到較好的收率(86%~99%)和對映選擇性(83%ee~90%ee)。Deng Li等[27]發(fā)現(xiàn)以金雞納堿類衍生物21c(Chart 3)催化23的胺化反應(yīng)時,可以得到更好的結(jié)果(收率96%~99%, 93%ee~99%ee),21c對該反應(yīng)有更好普適性。
2005年,J?rgensen等[28]設(shè)想用手性有機(jī)堿來活化烯丙基位的碳?xì)滏I,再與親電試劑發(fā)生不對稱反應(yīng)從而得到官能團(tuán)化的烯丙基類化合物。基于此作者采用金雞納堿類催化劑催化α-腈基取代烯丙基化合物24與1的不對稱胺化反應(yīng),經(jīng)過對反應(yīng)條件的系統(tǒng)優(yōu)化,作者發(fā)現(xiàn)催化劑22a(Chart 3)的催化效果最好,對反應(yīng)底物進(jìn)行了擴(kuò)展,發(fā)現(xiàn)22a的使用范圍廣,且當(dāng)?shù)孜餅樗娜〈r,也得到了高達(dá)88%ee的γ-胺化產(chǎn)物25(Scheme 11)。
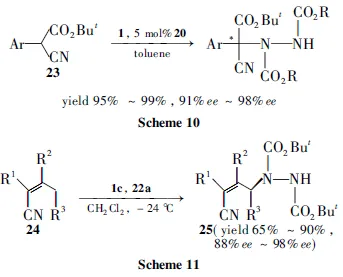
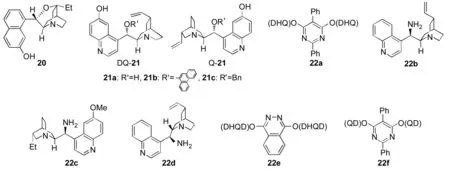
Chart 3
陳應(yīng)春等[29]用金雞納堿類衍生物22b(Chart 3)為催化劑,對大位阻的芳酮3與1的不對稱胺化反應(yīng)進(jìn)行了研究,通過反應(yīng)條件的優(yōu)化發(fā)現(xiàn)以對甲苯磺酸為添加劑、異丙醇為溶劑,室溫下反應(yīng)可以取得很好的收率(39%~77%)和對映選擇性(88%ee~99%ee)。
P Melchiorre課題組[30]也用金雞納堿衍生的手性伯胺22c(Chart 3)為催化劑,以三氟乙酸(TFA)為添加劑催化α-取代的吲哚26,α,β-不飽和醛27與1的cascade反應(yīng),該反應(yīng)是Michael加成反應(yīng)和胺化反應(yīng)的串聯(lián)反應(yīng)(Scheme 12)。用此方法可以有效地得到含有兩個手性中心,且有一個手性中心是季碳的高光學(xué)純的多官能團(tuán)的胺化產(chǎn)物。
Lu課題組[31]發(fā)現(xiàn)以金雞納堿類衍生物22d(Chart 3)為催化劑,樟腦磺酸為添加劑來催化支鏈醛5與1的反應(yīng),可以得到很好的收率(80%~99%)和對映選擇性(68%ee~99%ee)的胺基化產(chǎn)物。
氧化吲哚的不對稱胺化產(chǎn)物是多種生物活性分子和藥物分子的核心骨架。陳擁軍等[32]首次用金雞納堿類衍生物22e(Chart 3)來催化氧化吲哚30與1d的不對稱胺化反應(yīng),取得很好的收率和對映選擇性(Scheme 13)。同時,周建等[33]發(fā)現(xiàn)催化劑22f(Chart 3)也能很好的催化30與1d的不對稱胺化反應(yīng),并且也得到了很好的結(jié)果(收率90%~98%, 82%ee~94%ee)。Barbas研究小組[34]采用22e催化N-取代的氧化吲哚與1d的不對稱胺化反應(yīng),也取得了很高的收率(57%~92%)和對映選擇性(87%ee~98%ee)。

3 相轉(zhuǎn)移催化劑
Maruoka等[35,36]設(shè)計出以聯(lián)萘為手性骨架的新型手性季磷鹽相轉(zhuǎn)移催化劑32(Chart 4),并首次成功地將其用于催化β-酮酸酯33,β-二酮的不對稱胺化反應(yīng)(Scheme 14)。他們[37]還開發(fā)了更為穩(wěn)定的季銨鹽催化劑35a~35c(Chart 4)用于催化該胺化反應(yīng)。當(dāng)為大位阻的叔丁基取代時催化劑35c有更好的立體選擇性,產(chǎn)物的ee值最高達(dá)到97%。該方法可以用來合成羥醛還原酶抑制劑AS-3201的中間體。
4 軸手性胍類催化劑
近年來,胍類催化劑作為有機(jī)小分子催化劑得到了很大的發(fā)展。2006年,Hitoshi Ube課題組[38]首次將手性胍類催化劑36a(Chart 5),用于催化1,3-二羰基化合物37的不對稱胺化反應(yīng)(Scheme 15),取得了很好的反應(yīng)結(jié)果(收率54%~99%, 15%ee~98%ee)。作者認(rèn)為催化機(jī)理如Chart 5所示:胍奪取37之α-H并與其形成多氫鍵活化1,3-二羰基化合物,具有軸手性的聯(lián)萘結(jié)構(gòu)以及與萘環(huán)連接的芳香基團(tuán)的空間位阻來控制立體選擇性,因此萘環(huán)上芳基的位阻對該反應(yīng)的對映選擇選性有很大的影響。隨后,Nakano等[39]將36a用于α-腈基取代的硫代酯與1c的不對稱胺化反應(yīng),得到了高對映選擇性的胺化產(chǎn)物。
5 雙功能硫脲類催化劑
Takemoto課題組[40]報道用叔胺-硫脲雙功能催化劑39a(Chart 6)來催化33與1c的不對稱胺化反應(yīng),反應(yīng)取得了很好的收率(52%~99%)及對映選擇性(80%ee~90%ee)。隨后,Kim課題組[41]發(fā)現(xiàn)用大位阻的叔胺硫脲催化劑39b(Chart 6)催化此反應(yīng),催化效果更好。作者認(rèn)為叔胺可以奪去羰基α-H而使羰基化合物烯醇化后與叔胺形成離子對,而使羰基化合物得到活化,39b與1c的羰基形成雙氫鍵,活化1。Rawal課題組[42]開發(fā)了新型的叔胺芳酸催化劑40(Chart 6),以其催化37與1c的不對稱胺化反應(yīng)。在很溫和的條件下得到了高收率(90%~99%)和高對映選擇選(88%ee~98%ee)的胺化產(chǎn)物(38)。
我們課題組[43,44]用仲胺硫脲催化劑39c(Chart 7)分別催化直鏈醛和大位阻的支鏈醛與1的不對稱胺化反應(yīng),都取得了很好的收率(65%~97%[43], 52%~99%[44])和對映選擇性(77%ee~99%ee[43], 81%ee~97%ee[45])。
6 其它催化劑
Juaristi課題組[45]用簡單易得的苯乙胺衍生的仲胺催化劑41a(Chart 9)來催化23的不對稱胺化反應(yīng),得到最高達(dá)84%ee的胺化產(chǎn)物24。Chen Kwunmin等[46]發(fā)現(xiàn)脯氨醇衍生的仲胺砜類催化劑41b(Chart 7)催化醛的不對稱胺化反應(yīng),得到了很好的收率(79%~95%)和對映選擇性(92%ee~99%ee)。Alexakis等[47]和Wills等[48]分別用脯氨醇衍生的咪唑41c~41e(Chart 7)催化此反應(yīng),都得到了不錯的結(jié)果。我們課題組[49]發(fā)現(xiàn)3-(1-萘基)-L-丙氨酸的鹽酸鹽41f(Chart 7)能很好的催化支鏈醛5與1a或1d的不對稱胺化反應(yīng),得到了不錯的收率(99%)和對映選擇性(97%ee)。
葉松課題組[48]報道了[2+2]環(huán)化反應(yīng)。在N-雜環(huán)卡賓42的催化下,芳基乙烯酮(43)與1發(fā)生[2+2]環(huán)化反應(yīng),生成aza-β-內(nèi)酰胺(44, Scheme 16)。反應(yīng)歷程為:42進(jìn)攻43得到烯醇化中間體45;45再與1發(fā)生親核加成,生成中間體46;46發(fā)生自身合環(huán),催化劑離去得44。
7 結(jié)束語
近年來,報道了很多以偶氮二羧酸酯作氮源的有機(jī)小分子催化的不對稱胺化反應(yīng),為合成手性含氮化合物提供了方法。這些方法具有操作簡單,環(huán)境友好等優(yōu)點(diǎn),許多方法已經(jīng)小規(guī)模應(yīng)用到藥物及天然產(chǎn)物的合成中,具有潛在的工業(yè)應(yīng)用前景。

[1] Genet J P, Greck C, Lavergne D. In modern amination methods[M].Ed R A,Wiley-VCH:Weinheim,2000.
[2] Córdova A, Notz W, Barbas III C F,etal. A highly enantioselective amino acid-catalyzed route to functionalizedγ-amino acids[J].J Am Chem Soc,2002,124:1842-1843.
[3] Nugent B M, Yoder R A, Johnston J N. Chiral proton catalysis:A catalytic enantioselective direct Aza-Henry reaction[J].J Am Chem Soc,2004,126:3418-3419.
[4] Li C Q, Wang C, Xiao J L,etal. Chiral counteranion-aided asymmetric hydrogenation of acyclic imines[J].J Am Chem Soc,2008,130:14450-14451.
[5] Chen Y J, Seki K, Kobayashi S,etal. Catalytic carbon-carbon bond-forming reactions of aminoalkane derivatives with imines[J].J Am Chem Soc,2010,132:3244-3245.
[6] Li H M, Wang B M, Deng L. Enantioselective nitroaldol reation ofα-ketoesters catalyzed by cinchona alkaloids[J].J Am Chem Soc,2006,128:732-733.
[7] Taylor M S, Jacobsen E N. Asymmetric catalysis by chiral hydrogen-bond donors[J].Angew Chem Int Ed,2006,45:1520-1543.
[8] Chen X H, Feng X M. A secondary amine amide organocatalyst for the asymmetric nitroaldol reaction ofα-ketophosphonates[J].Chem Eur J,2008,14:10896-10899.
[9] Li H M, Song J, Deng L,etal. Catalytic enantioselective C-C bond forming conjugate additions with vinyl sulfones[J].J Am Chem Soc,2005,127:8948-8949.
[10] Wang X S, Kitamura M, Maruoka K. New,chiral phase transfer catalysts for effecting asymmetric conjugate additions ofγ-alkyl-γ-cyanoacetates to acetylenic esters[J].J Am Chem Soc,2007,129:1038-1039.
[11] Marini F, Sternativo S, Testaferri L,etal. Enantioselective organocatalytic michael addition ofα-substituted cyanoacetates toα,β-unsaturated selenones[J].Adv Synth Catal,2009,351:103-106.
[13] List B. Direct catalytic asymmetricα-amination of aldehydes[J].J Am Chem Soc,2002,124:5656-5657.
[14] Kumaragurubaran N, Juhl K, Zhuang W,etal. Direct L-proline catalyzed asymmetricα-amination of ketones[J].J Am Chem Soc,2002,124:6254-6255.
[15] Vogt H, Vanderheiden S, Br?se S. Proline-catalysed asymmetric amination ofα,α-disubstituted aldehydes:Synthesis of configurationally stable enantioenrichedα-aminoaldehydes[J].Chem Commun,2003:2448-2449.
[16] Baumann T, B?chle M, Hartmann C,etal. Thermal effects in the organocatalytic asymmetricα-amination of disubstituted aldehydes with azodicarboxylates:A high-temperature organocatalysis[J].Eur J Org Chem,2008:2207-2212.
[17] Hartmann C E, Baumann T, B?chle M,etal. Asymmetric synthesis of deuterated and fluorinated aromaticα,α-disubstituted amino acid derivatives[J].Tetrahedron:Asymmetry,2010,21:1341-1349.
[18] Chowdari N S, Ramachary D B, Barbas III C F. Organocatalytic asymmetric assembly reactions:One-pot synthesis of functionalizedβ-amino alcohols from aldehydes, ketones, and azodicarboxylates[J].Org Lett,2003,5:1685-1688.
[19] Suri J T, Steiner D D, BarbasⅢ C F. Organocatalytic enantioselective synthesis of metabotropic glutamate receptor ligands[J].Org Lett,2005,7:3885-3888.
[20] Dahlin N, Bevig A, Adolfsson H.N-arenesulfonyl-2-aminomethylpyrrolidines——Novel modular ligands and organocatalysts for asymmetric catalysis[J].Adv Synth Catal,2004,346:1101-1105.
[21] Chowdari N S, Barbas Ⅲ C F. Total synthesis of LFA-1 antagonist BIRT-377 via organocatalytic asymmetric construction of a quaternary stereocenter[J].Org Lett,2005,7:867-870.
[22] Oelke A J, Kumarn S, Ley S V,etal. An enantioselective organocatalytic route to chiral 3,6-dihydropyridazines from aldehydes[J].Synlett,2006:2548-2552.
[23] Marigo M, Schulte T, Jrgensen K A,etal. Asymmetric multicomponent domino reactions and highly enantioselective conjugated addition of thiols toα,β-unsaturated aldehydes[J].J Am Chem Soc,2005,127:15710-15711.
[24] Jiang H, Nielsen J B, Jrgensen K A. Organocatalysed asymmetricα-amination and multicomponent syn-selective diamination ofα,β-unsaturated aldehydes[J].Chem Eur J,2007,13:9068-9075.
[25] Bertelsen S, Marigo M, Jrgensen K A,etal. Dienamine catalysis:Organocatalytic asymmetricγ-amination ofα,β-unsaturated aldehydes[J].J Am Chem Soc,2006,128:12973-12980.
[26] Saaby S, Bella M, Jrgensen K A. Asymmetric construction of quaternary stereocenters by direct organocatalytic amination ofα-substitutedα-cyanoacetates andβ-dicarbonyl compounds[J].J Am Chem Soc,2004,126:8120-8121.
[27] Liu X M, Li H M, Deng L. Highly enantioselective amination ofα-substitutedα-cyanoacetates with chiral catalysts accessible from both quinine and quinidine[J].Org Lett,2005,7:167-169.
[28] Poulsen T B, Alemparte C, Jrgensen K A. Enantioselective organocatalytic allylic amination[J].J Am Chem Soc,2005,127:11614-11615.
[29] Liu T Y, Cui H L, Chen Y C,etal. Organocatalytic and highly enantioselective directγ-amination of aromatic ketones[J].Org Lett,2007,9:3671-3674.
[30] Galzerano P, Melchiorre P. Asymmetric organocatalytic cascade reactions withα-substitutedα,β-unsaturated aldehydes[J].Angew Chem Int Ed,2009,48:7892-7894.
[31] Liu C, Zhu Q, Huang K W,etal. Primary amine/CSA ion pair:A powerful catalytic system for the asymmetric enamine catalysis[J].Org Lett,2011,13:2638-2641.
[32] Cheng L, Liu L, Chen Y J,etal. Highly enantioselective and organocatalyticγ-amination of 2-oxindoles[J].Org Lett,2009,11:3874-3877.
[33] Qian Z Q, Zhou F, Zhou J,etal. Asymmetric construction of quaternary stereocenters by direct organocatalytic amination of 3-substituted oxindoles[J].Chem Commun,2009:6753-6755.
[34] Bui T, Borregan M, Barbas III C F. Expanding the scope of cinchona alkaloid-catalyzed enantioselectiveα-aminations of oxindoles:A versatile approach to optically active 3-amino-2-oxindole derivatives[J].J Org Chem,2009,74:8935-8938.
[35] He R J, Wang X S, Maruoka K J. Binaphthylmodified quaternary phosphonium salts as chiral phase transfer catalysts:Asymmetric amination ofβ-keto esters[J].Angew Chem Int Ed, 2008,47:9466-9468.
[36] He R J, Maruoka K J. Binaphthyl-modified quaternary phosphonium salts as chiral phase transfer catalysts:Asymmetric amination ofβ-keto esters[J].Synthesis,2009:2289-2292.
[37] Lan Q, Wang X S, He R J,etal. Highly efficient asymmetric amination ofβ-keto esters catalyzed by chiral quaternary ammonium bromides[J].Tetrahedron Lett,2009,50:3280-3282.
[38] Terada M, Nakano M, Ube H. Axially chiral guanidine as highly active and enantioselective catalyst for electrophilic amination of unsymmetrically substituted 1,3-dicarbonyl compounds[J].J Am Chem Soc,2006,128:16044-16045.
[39] Terada M, Tsushima D, Nakano M. Enantioselective electrophilic amination ofα-cyanothioacetates with azodicarboxylates catalyzed by an axially chiral guanidine Base[J].Adv Synth Catal,2009,351:2817-2821.
[40] Miyabe H, Takemoto Y. The amino thiourea-catalyzed asymmetric nucleophilic reactions[J].Chimia,2007,61:269-275.
[41] Jung S H, Kim Y. Catalytic enantioselective electrophilicα-hydrazination ofβ-ketoesters using bifunctional organocatalysts[J].Tetrahedron Lett,2008,49:5527-5530.
[42] Konishi H, Lam T Y, Malerich J P,etal. Enantioselectiveγ-amination of 1,3-dicarbonyl compounds using squaramide derivatives as hydrogen bonding catalysts[J].Org Lett,2010,12:2028-2031.
[43] Fu J Y, Huang Q C, Wang L X,etal. Highly effective and enantioselectiveα-amination of aldehydes promoted by chiral proline amide-thiourea bifunctional catalysts[J].Tetrahedron Lett,2010,51:4870-4873.
[44] Fu J Y, Xu X Y, Wang L X,etal. Effective construction of quaternary stereocenters by highly enantioselectiveα-amination of branched aldehydes[J].Org Biomol Chem,2010,8:4524-4526.
[45] Liu Y J, Roberto M F, Juaristi E. Enantioselective amination ofα-phenyl-α-cyanoacetate catalyzed by chiral amines incorporating theα-phenylethyl auxiliary[J].J Org Chem 2007,72:1522-1525.
[46] Liu P M, Chang C, Chen K,etal. Remarkable reaction rate and excellent enantioselective directα-amination of aldehydes with azodicarboxylates catalyzed by pyrrolidinylcamphor-derived organocatalysts[J].Eur J Org Chem,2010:42-46.
[47] Quintard A, Belot S, Alexakis A,etal. Aminal-pyrrolidine organocatalysts——highly efficient and modular catalysts forα-functionalization of carbonyl compounds[J].Eur J Org Chem,2010:927-936.
[48] Gosiewska S, Soni R, Wills C,etal. Synthesis and use of a stable aminal derived from TsDPEN in asymmetric organocatalysis[J].Tetrahedron Lett,2010,51:4214-4217.
[49] Fu J Y, Yang Q C, Wang L X,etal. Enantioselective-amination of branched aldehydes promoted by simple chiral primary amino acids[J].J Org Chem,2011,76:4661-4664.
[50] Huang X L, Chen X Y, Ye S. Enantioselective synthesis of aza-β-lactams via NHC-catalyzed [2+2] cycloaddition of ketenes with diazenedicarboxylates[J].J Org Chem,2009,74:7585-7587.

