不同濃度銨態氮對苦草的生理影響
宋 睿,姜錦林,耿金菊,高士祥,王曉蓉(南京大學環境學院,污染控制與資源化研究國家重點實驗室,江蘇南京 210046)
不同濃度銨態氮對苦草的生理影響
宋 睿,姜錦林,耿金菊,高士祥*,王曉蓉**(南京大學環境學院,污染控制與資源化研究國家重點實驗室,江蘇南京 210046)
研究了苦草在不同濃度(0.02,0.05,0.10,0.30,0.60,1.00,3.00mg/L)銨態氮中暴露14d后,其生物量的變化、葉片游離氨基酸態氮、葉綠素、可溶性蛋白含量以及 O2-?信號強度、抗氧化酶活性和丙二醛(MDA)含量的響應.結果表明,各濃度組苦草的生物量無顯著變化,但是各生理指標變化顯著.當銨態氮濃度為0.30mg/L時,苦草葉片中游離氨基酸態氮的含量即開始顯著升高.當銨態氮濃度達到0.60mg/L時,超氧化物歧化酶(SOD)活性顯著升高,表明苦草誘導產生氧化應激但未受到氧化損傷.當銨態氮濃度高于1.00mg/L時,SOD和過氧化物酶(POD)活性顯著升高,O2-?信號強度顯著增強,葉綠素、可溶性蛋白含量顯著降低.當銨態氮濃度為0.02mg/L時,O2-?信號強度顯著增強.綜上,銨態氮濃度低于0.60mg/L苦草生長良好,濃度≥1.00mg/L苦草光合能力受到抑制、代謝受到干擾.苦草對銨態氮最敏感的生理生化指標是葉片中游離氨基酸態氮含量.銨態氮作為沉水植物的一種營養物質,當其含量較低時,植物由于營養缺乏誘導產生自由基.
銨態氮;苦草;氨基酸態氮;葉綠素;可溶性蛋白;自由基;抗氧化酶
藍藻水華生態災害頻發,嚴重威脅了區域水環境生態安全以及人民的健康[1].銨態氮是藍藻水華成災過程中產生的重要代謝衍生物,尤其在藍藻水華暴發后期,大量的銨態氮釋放到水環境中,對水生生態系統中重要的初級生產者——沉水植物產生極大的影響.已有研究表明[2],銨態氮是沉水植物生長所需要的重要營養物質,但是高濃度的銨態氮對沉水植物的生長有抑制作用,甚至會直接導致其消亡.高濃度的銨態氮抑制沉水植物的光合作用、誘導產生氧化應激并且導致植物體內碳氮代謝的不平衡[3-6].目前關于銨態氮對沉水植物生理影響的研究[3-5]大多集中于高濃度,其實驗濃度高達 2~30mg/L.較低濃度銨態氮對沉水植物生理影響的研究鮮為報道.湖泊流域水質通報的監測結果表明,我國湖泊銨態氮的平均濃度≤1mg/L.因此,研究較低濃度銨態氮對沉水植物生理活動的影響,尋找銨態氮對沉水植物的安全濃度,進一步認識銨態氮導致沉水植物衰退的機理,更具有實際意義.
苦草(Vallisneria natans L.)是我國河流湖泊中分布最為廣泛的一種沉水植物,其常被作為富營養化湖泊中沉水植物恢復重建的先鋒種[7].本實驗研究了在實驗室模擬條件下,不同濃度銨態氮對苦草生物量、葉片游離氨基酸態氮、葉綠素、可溶性蛋白含量以及O2-?信號強度、抗氧化酶活性和丙二醛(MDA)含量的影響,為銨態氮對沉水植物的影響提供更多理論依據.
1 材料與方法
1.1 材料與試劑
本實驗所用苦草采自太湖胥口灣,挑選生長良好、株高(20±2)cm、重(6.5±0.5)g的植株移栽到 24個無色玻璃缸(長 15cm、寬 15cm、高25cm)中,每缸4株,玻璃缸底層鋪有厚度5cm的石英砂,加入10%的Hoagland′s營養液預培養7d.
2-(環己胺)-1-乙磺酸(CHES)GR 級;1,2-二羥基-3,5-苯二磺酸二鈉(Tiron)AR級;吐溫-20AR級;氯化銨AR級.
1.2 實驗處理
預培養結束后,將24缸苦草分為8組,設置 7組不同銨態氮(NH4Cl配置)濃度的營養液:0.02,0.05,0.10,0.30,0.60,1.00,3.00mg/L,同時設置一組無氮的對照組(CK).每組3個平行,每缸營養液定容至5L.所用營養液為Hoagland′s營養液去除含氮的部分,均用曝氣 2d的自來水配制.將各組苦草放置于培養室中,控制培養室的溫度(25±1)℃,模擬自然光照強度,光暗時間比為 12h∶12h.每天換水一次,并測定水中銨態氮、亞硝態氮、硝態氮的濃度.控制營養液的pH值7.8±0.2,DO≥4mg/L.14d后,取各組苦草葉片樣品先用自來水沖洗干凈、再用去離子水沖洗3次,用濾紙將苦草葉片表面的水吸干.稱取部分樣品用于自由基捕獲,剩余樣品保存于-80 ℃冰箱進行其余生理生化指標的測定.
1.3 測試指標與方法
1.3.1 O2-?的捕獲與信號強度測定 O2-?的捕獲與強度測定方法參考Lynch等[8]的方法略有修改.分別稱取新鮮苦草葉片 0.1g,置于研缽中,加入適量液氮冷凍后,迅速置于充滿氮氣的密封箱中研磨成粉末,立即加入捕獲劑1mL制成勻漿液,轉移至離心管中.勻漿液在 4℃下,以 10000×g離心15min,轉移上清液于離心管中,迅速于液氮中保存用于電子順磁共振(EPR)測定.上述操作均在無氧條件下進行,并避免水分進入干擾測定.捕獲劑pH 值為 8.6,其中含有0.05m?l/L CHES、0.01m?l/L Tir?n和0.5%吐溫-20.EPR測定在常溫(25℃)下進行,吸取 200μL上清液注入石英扁平槽中,采用Bruker EMX 10/12型EPR儀檢測.檢測條件為中心磁場:3480G;掃瞄寬度:200G;微波功率:20mW;調制頻率:100kHz;調制幅度:1.0G;掃瞄次數:1次.
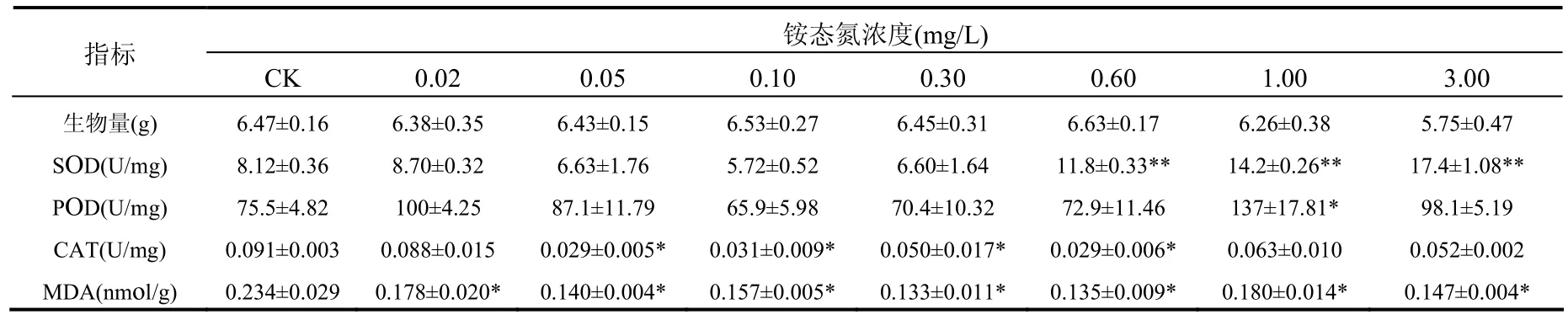
表1 銨態氮濃度對生物量、抗氧化酶活性和MDA含量的影響Table 1 Effect of NH4+-N concentrations on the biomass, activities of antioxidant defenses and contents of MDA
1.3.2 可溶性蛋白含量、酶活性和丙二醛含量測定 粗酶液的提取參照 García-Lim?nes 等[9]的方法略有修改.可溶性蛋白含量測定參照考馬斯亮藍染色法[10],以小牛血清蛋白(BSA)作為標準蛋白.超氧化物歧化酶(SOD)活性測定采用氮藍四唑(NBT)光還原法[11];過氧化物酶(POD)活性的測定采用愈創木酚氧化法[12-13],過氧化氫酶(CAT)活性的測定采用紫外法[14].丙二醛含量的測定采用TBA比色法[15].
1.3.3 葉綠素和游離氨基酸態氮含量測定 葉綠素測定采用丙酮提取法[16].游離氨基酸態氮測定采用茚三酮法[17].
1.3.4 銨態氮、亞硝態氮、硝態氮濃度測定 銨態氮的測定根據標準《水質銨的測定水楊酸分光光度法》(GB7481-1987).亞硝態氮的測定根據標準《水質亞硝酸鹽氮的測定分光光度法》(GB7493-1987).硝態氮的測定根據標準《水質硝態氮的測定分二磺酸分光光度法》(GB7480-1987).
1.3.5 統計分析 實驗結果表示為平均數±標準誤差(Mean±SD).使用 SPSS15.0統計軟件和ANOVA法將實驗組與對照組數據進行顯著性差異分析,使用Origin8.0統計軟件處理自由基數據.
2 結果與分析
2.1 不同濃度銨態氮對苦草生物量的影響
由表 1可見,銨態氮濃度≥1.00mg/L時,14d后,苦草的生物量(鮮重)開始下降,但未出現顯著性差異.當銨態氮濃度為 3.00mg/L時,苦草的生物量下降至對照組生物量的90%左右.
2.2 不同濃度銨態氮對苦草葉片游離氨基酸態氮含量的影響
由圖1可見,隨著銨態氮濃度的升高,苦草葉片中游離氨基酸態氮的含量先略有下降后又顯著升高.當銨態氮濃度達到 0.30mg/L時,其含量已經接近對照組含量的 3倍,出現了顯著性差異(P<0.05).隨著銨態氮濃度進一步升高,其含量顯著上升,出現極顯著性差異(P<0.01).
2.3 不同濃度銨態氮對苦草葉片葉綠素含量的影響
由圖2可見,隨著銨態氮濃度升高,苦草葉片中葉綠素a和b的含量先升高后又顯著下降.當銨態氮濃度為3.00mg/L時,葉綠素a和b的含量均下降到對照組含量的 60%左右,與對照組相比葉綠素a出現顯著性差異(P<0.05);葉綠素b出現極顯著性差異(P<0.01).

圖1 銨態氮濃度對游離氨基酸態氮含量的影響Fig.1 Effect of NH4+-N concentrations on contents of amino acid-nitrogen
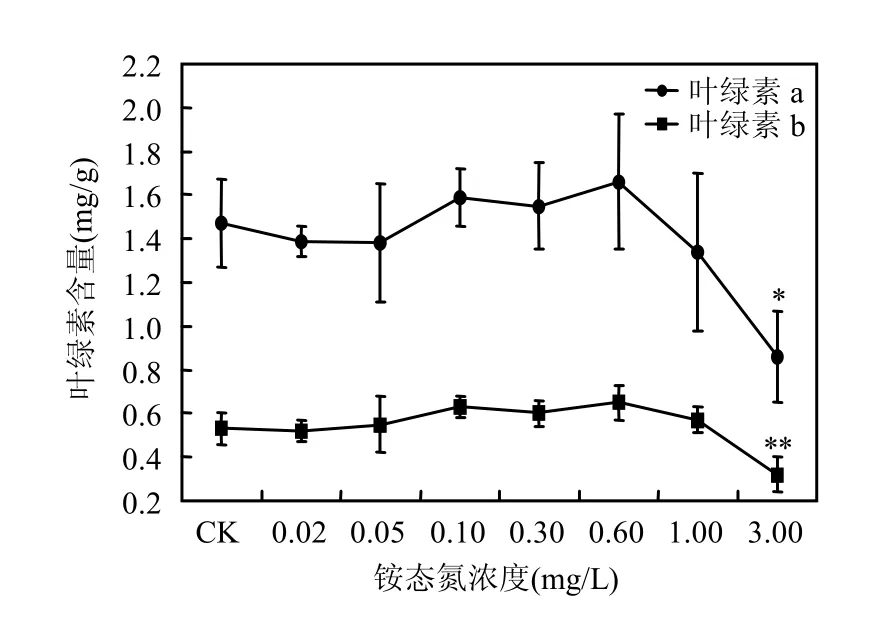
圖2 銨態氮濃度對葉綠素含量的影響Fig.2 Effect of NH4+-N concentrations on contents of chlorophyll
2.4 不同濃度銨態氮對苦草葉片可溶性蛋白含量的影響
由圖3可見,隨著銨態氮濃度的升高,苦草葉片中可溶性蛋白含量先升高后又顯著下降的趨勢.當銨態氮濃度為1.00、3.00mg/L時,苦草葉片可溶性蛋白含量顯著下降,與對照組相比出現顯著性差異(P<0.05).
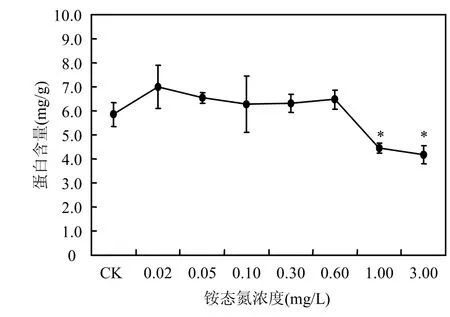
圖3 銨態氮濃度對可溶性蛋白含量的影響Fig.3 Effect of NH4+-N concentrations on contents of soluble protein* P<0.05
2.5 不同濃度銨態氮對苦草葉片 O2-?信號強度的影響
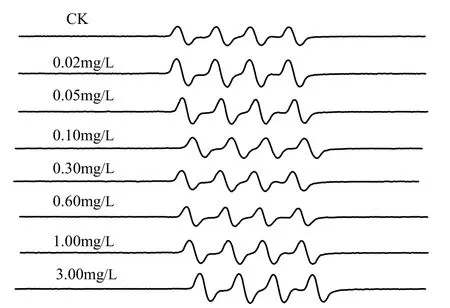
圖4 EPR捕獲不同濃度組O2-?的譜線Fig.4 The EPR spectrum of O2-? of different concentrations
EPR捕獲O2-?譜線如圖 4所示,O2-?信號強度分析結果如圖5所示.由圖5可見,當銨態氮濃度為0.02mg/L時,苦草葉片中O2-?信號強度較對照組顯著增強(P<0.05).隨著銨態氮濃度升高,葉片O2-?信號強度呈先減弱后增強的趨勢,銨態氮濃度0.60mg/L處理組,葉片O2-?信號強度下降到對照組的 40%左右,出現極顯著性差異(P<0.01);隨著銨態氮濃度的升高,其信號強度進一步增強,銨態氮濃度為3.00mg/L處理組,其信號強度是對照組的1.5倍,出現極顯著性差異(P<0.01).

圖5 銨態氮濃度對O2-?自由基信號強度的影響Fig.5 Effect of NH4+-N concentration on O2-? freeradical signal intensity* P<0.05
2.6 不同濃度銨態氮對苦草葉片抗氧化酶活性以及MDA含量的影響
由表 1可見,當銨態氮濃度為 0.02mg/L時,SOD和 POD活性均略有升高但未出現顯著性差異.隨著銨態氮濃度的升高,苦草葉片中SOD和POD的活性均呈現先下降后升高的趨勢.當銨態氮濃度為0.60mg/L時,與對照組相比SOD活性已出現極顯著性差異.隨著銨態氮濃度進一步升高至3.00mg/L時,SOD活性升高至對照組活性的 2倍左右,出現了極顯著性差異(P<0.01).當銨態氮濃度為1.00mg/L時,POD的活性已升高至對照組活性的 2倍左右,出現了顯著性差異(P<0.05).同時還觀察到,銨態氮濃度為 0.05~0.60mg/L時,苦草葉片中CAT活性一直受到顯著性抑制(P<0.05).各實驗組的MDA含量均低于對照組,并出現顯著性差異(P<0.05).
3 討論
銨態氮是沉水植物正常生長發育所需要的營養物質.研究表明[18],當沉水植物缺少氮素營養時,蛋白質合成減少、細胞分裂減慢;而當氮素營養過剩時,也會對其產生傷害.本實驗通過苦草在不同濃度銨態氮中暴露14d后,分析其生物量、葉片中游離氨基酸態氮、葉綠素和可溶性蛋白含量,以及O2-?信號強度、抗氧化酶活性和MDA含量,以期尋找適合苦草生長的銨態氮濃度.
一般來說,當水環境中 NH4+濃度較高時,沉水植物被動吸收大量NH4+之后,主要通過兩條途徑減少NH4+在植物細胞內的積累,一是通過主動運輸并消耗能量將NH4+運出植物細胞,二是合成游離氨基酸[19].本實驗結果表明,從銨態氮濃度為0.30mg/L開始,苦草葉片中游離氨基酸態氮含量顯著升高,表明葉片中積累了大量的游離氨基酸從而減少NH4+的積累、減輕其毒害作用.CaO等[4]的研究得到類似結果,暴露苦草于 1.0mg/L銨態氮培養液中 2個月,發現苦草葉片中積累了大量的游離氨基酸.綜合分析各生理生化指標表明,苦草對銨態氮最敏感的指標是葉片中游離氨基酸態氮的含量.植物葉片的葉綠素和可溶性蛋白含量是與其光合能力相關的重要生理指標.葉綠素a和b是吸收和傳遞光能的主要色素.本實驗中,當銨態氮濃度為3.00mg/L時,葉綠素a和b的含量顯著下降,并且肉眼可觀察到輕微的缺綠病癥狀.盡管植物可以通過主動運輸、氨基酸代謝等途徑減輕 NH4+的壓力,但是過量的 NH4+已經抑制了植物的光合作用、破壞了植物的光合作用系統.Britto等[20]的研究認為,由于過量的NH4+抑制了Mg2+的吸收和運輸,所以造成了植物光合作用受到抑制,其作用機制還有待進一步的研究驗證.植物葉片中的可溶性蛋白大多是參與各種代謝的酶類,其中約 50%是參與光合作用的關鍵酶.因此可溶性蛋白的含量,被廣泛用作衡量葉片光合能力高低和衰亡的指標[21].本實驗得到結果,從銨態氮濃度為1.00mg/L開始,苦草葉片的可溶性蛋白的含量顯著下降,表明植物機體光合能力降低、代謝受到干擾,并且肉眼可觀察到生物量明顯減少、植物受損.
已有研究表明[3-5],高濃度的銨態氮會誘導沉水植物產生氧化應激,誘導植物體內抗氧化酶SOD、POD、CAT等活性發生變化.在高濃度銨態氮的脅迫下,植物體內活性氧水平升高,誘導抗氧化酶類的活性發生變化,從而清除活性氧并抵御脅迫.活性氧的水平超過抗氧化酶類的清除能力,植物體即受到了氧化損傷.SOD作為防御活性氧的第一道防線,主要作用是催化 O2-?轉化為H2O2.CAT和 POD的作用是催化 H2O2分解成H2O和O2,CAT主要位于微粒體中,POD主要位于細胞質、細胞壁、液泡和細胞外空間[3-5].本實驗表明,當銨態氮濃度為 0.60mg/L時,苦草葉片中O2-?信號強度顯著下降,濃度為1.00mg/L時無顯著性變化,主要原因是 SOD 活性顯著升高,清除了一部分O-?.銨態氮濃度為 3.00mg/L時O-?
22信號強度顯著升高,雖然此時SOD的活性仍然顯著升高,但是 O2-?大量蓄積,可能因為自由基產生的速率超過了SOD的清除速率.銨態氮濃度達到1.00mg/L時,POD活性顯著升高,主要是因為SOD催化O2-?轉化產生大量的H2O2,POD活性受到誘導從而催化轉化 H2O2.從銨態氮濃度為0.05~0.60mg/L,CAT活性受到抑制,可能由于積累的H2O2抑制了CAT的活性,但植物體并未受到氧化損傷.同時,結果發現當銨態氮濃度為0.02mg/L時,O2-?信號強度顯著升高,但并未誘導抗氧化酶類活性產生顯著變化,主要因為產生的自由基被及時清除并未誘導植物產生氧化應激.低銨態氮條件下 O2-?含量顯著升高,可能因為植物處于營養缺乏狀態,誘導了自由基的產生.Shin等[22]對擬南芥的研究得到類似結果,他測定了擬南芥在缺乏營養物質氮素的情況下其根部活性氧的水平,結果表明由于氮素的缺乏,擬南芥根部特定區域活性氧濃度升高.Shin等[23]研究了當擬南芥缺乏營養元素鉀時,其根部的活性氧濃度也會升高;并且發現活性氧主要積累在根部鉀離子吸收和轉運較活躍的區域.本實驗的研究證明了上述觀點.MDA是多不飽和脂肪酸氧化的二級終產物,并已用于表征脂質過氧化的程度.在本實驗研究的銨態氮濃度范圍內,苦草葉片中 MDA含量顯著降低.Wang等[3]的研究得到類似結果,他推測植物抗氧化能力提高可以減輕或者防止脂質過氧化反應.Nimptsch等[5]研究結果相似,他在研究銨態氮對沉水植物紅狐尾藻的影響時發現暴露7d后,脂質過氧化產物MDA、4-HNE含量減少.他也認為由于活性氧的增加,植物體抗氧化能力提高,從而提高了分解脂質過氧化產物的能力,所以脂質過氧化產物含量減少.MDA的降低,究竟是由于植物體抗氧化能力提高、還是由于多不飽和脂肪酸含量減少或是沉水植物對銨態氮壓力有不同的適應或防御機制,還需要進一步研究.
綜合分析實驗結果,各銨態氮濃度組生物量沒有出現顯著性變化.但是生理生化指標出現一系列早期響應,其結果表明銨態氮濃度≥1.00mg/L,苦草光合能力受到抑制、代謝受到干擾.
4 結論
4.1 銨態氮濃度低于 0.60mg/時苦草生長良好,濃度大于或等于1.00mg/L時苦草的光合能力受到抑制、代謝受到干擾.
4.2 苦草對銨態氮最敏感的生理生化指標是葉片中游離氨基酸態氮含量.
4.3 銨態氮作為沉水植物的一種營養物質,當其含量較低時,植物由于營養缺乏誘導產生自由基.
[1] 吳慶龍,謝 平,楊柳燕,等.湖泊藍藻水華生態災害形成機理及防治的基礎研究 [J]. 地球科學進展, 2008,23(11):1050-1055.
[2] Brun F G, Hernandez I, Vergara J J, et al. Assessing the toxicity of ammonium pulses to the survival andgrowth of Zostera noltii [J].MEPS, 2002,225:177-187.
[3] Wang C, Zhang S H, Wang P F, et al. Metabolic adaptations to ammonia-induced oxidative stress in leaves of the submerged macrophyte Vallisneria natans [J]. Aquatic Toxicology, 2008,87:88-98.
[4] Cao T, Xie P, Li Z Q, et al. Physiological stress of high NH4+concentration in water column on the submersed macrophyte Vallisneria Natans [J]. Bulletin of Environmental Contamination and Toxicology, 2009,82:296-299.
[5] Nimptsch J, Pflugmacher S. Ammonia triggers the promotion of oxidative stress in the aquatic macrophyte Myriophyllum mattogrossense [J]. Chemosphere, 2007,66:708-714.
[6] Ni L Y. Effects of water column nutrient enrichment on the growth of Potamogeton maackianus A. Been [J]. Journal of Aquatic Plant Management, 2001,39:83-87.
[7] 尹 穎,孫媛媛,郭紅巖,等.芘對苦草的生物毒性效應 [J]. 應用生態學報, 2007,18(7):1528-1533.
[8] Lynch D V, Thompson J E. Lipoxygenase-mediated production of superoxide anion in senescing plant tissue [J]. FEBS Letters,1984,173:251-254.
[9] García-Limones C, Hervás A, Navas-Cortés J A, et al. Induction of an antioxidant enzyme system and other oxidative stress markers associated with compatible and incompatible interactions between chickpea (Cicer arietinum L.) and Fusarium oxysporumf.sp. Ciceris [J]. Physiological and Molecular Plant Pathology,2002,61:325-337.
[10] Bradford M M. Arapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding [J]. Analytical Biochemistry, 1976,72:248-254.
[11] Dhindsa R S, Dhinsa P P, Thorpe T A. Leaf senescence correlated with increased levels of membrane permeability and lipid-peroxidati?n and decreased levels of superoxide dismutase and catalase [J]. Journal of Experimental Botany, 1980,32:127-132.
[12] Kochhar S, Kochhar V K, Khanduja S D. Changes in the pattern of isoperoxidases during maturation of grape berries cv. Gulabi as affected by ethephon [J]. American Journal of Enology and Viticulture, 1979,30:275-277.
[13] 陳建勛,王曉峰.植物生理學實驗指導 [M]. 廣州:華南理工大學出版社, 2002:120-121.
[14] Xu J B, Yuan X F, Lang P Z. Determination of catalase activity and catalase inhibition by ultraviolet spectrophotometry [J].China Environmental Chemistry, 1997,16:73-76.
[15] 羅 義,施華宏,王曉蓉,等.2,4-二氯苯酚誘導鯽魚肝臟自由基的產生和脂質過氧化 [J]. 環境科學, 2005,26(3):29-32.
[16] 中國科學院上海植物生理研究所,上海市植物生理學會.現代植物生理學實驗指南 [M]. 北京:科學出版社, 2004:95-96.
[17] 中國科學院上海植物生理研究所,上海市植物生理學會.現代植物生理學實驗指南 [M]. 北京:科學出版社, 2004:138-139.
[18] 焦雯珺,閔慶文,林 焜,等.植物氮素營養診斷的進展與展望[J]. 中國農學通報, 2006,22(12):351-355.
[19] Rabe E. Stress physiology-the function significance of the accumulation of nitrogen-containing compounds [J]. Journal of Horticultural Science, 1990,65:231-243.
[20] Britto D T, Kronzucker H J. NH4+toxicity in higher plants: a critical review [J]. Plant Physiology, 2002,159:567-584.
[21] 李雁鳴,梁振興,梅 楠.冬小麥葉片衰亡及其形態生理變化 [J].北京農學院學報, 1988,3(2):58-66.
[22] Shin R, Schachtman D P. Hydrogen peroxide mediates plant root cell response to nutrient deprivation [J]. PNAS, 2004,23:8827-8832.
[23] Shin R, Berg R H, Schachtman D P. Reactive oxygen species and root Hairs in arabidopsis root response to nitrogen, phosphorus and potassium deficiency [J]. Plant and Cell Physiology, 2005,46:1350-1357.
Physiological effect of Vallisneria natans L. under different concentrations of ammonia.
SONG Rui, JIANG Jin-lin, GENG Jin-ju, GAO Shi-xiang*, WANG Xiao-rong**(State Key Laboratory of Pollution Control and Resources Reuse,School of Environment, Nanjing University, Nanjing 210046, China). China Environmental Science, 2011,31(3):448~453
The effects of biomass, nitrogen in free amino acids, chlorophyll, soluble proteins and malondialdehyde(MDA),intensities of O2-? and antioxidant enzyme activities in the leaves of Vallisneria natans L. exposed to different concentrations of NH4+-N (0.02,0.05,0.10,0.30,0.60,1.00,3.00mg/L) after 14 days were investigated. No significant changes were observed for the biomass of leaves in the studied exposing level, while the physiological signals showed different trends. Intensities of O2-? increased at the lowest concentration of ammonia(0.02mg/L). The nitrogen contents in the free amino acids started to increase significantly from 0.30mg/L NH4+-N. When the NH4+-N reached 0.60mg/L, SOD activities were significantly induced, indicating oxidative stress to the plant without oxidative damage. When the ammonia concentrations were higher than 1.00mg/L, the signal intensities of free radicals and activities of SOD and POD significantly increased, while the contents of chlorophyll and soluble protein decreased, indicating oxidative damage might happen. Generally, the plants grew well when the NH4+-N concentration was below 0.60mg/L and stress and growth disturbance happened when it was above 1.00mg/L. Among all those physiological parameters measured, the nitrogen content in the free amino acids in the plant leaves was the most sensitive indicator. Results also suggested that deficiency of nutrient at a low level of ammonia may cause the induction of free radicals in submerged plant leaves.
ammonia;Vallisneria natans L.;amino acid-nitrogen;chlorophyll;soluble protein;free radical;antioxidant enzymes
X503.23
A
1000-6923(2011)03-0448-06
2010-07-16
國家“973”項目(2008CB418102);水體污染控制與治理科技重大專項(2009zx07316-004)
* 責任作者, 教授, ecsxg@nju.edu.cn
** 責任作者, 教授, ekxr@nju.edu.cn
宋 睿(1986-),女,江蘇淮安人,碩士研究生,主要從事環境毒理學研究.發表論文1篇.

