組合法廢稀鹽酸濃縮工藝
吳振玉,高瑞昶,白 鵬,劉偉明,肖 穎,李 瑩
(天津大學化工學院,天津 300072)
應用技術
組合法廢稀鹽酸濃縮工藝
吳振玉,高瑞昶,白 鵬,劉偉明,肖 穎,李 瑩
(天津大學化工學院,天津 300072)
進行了加鹽解吸-氣體吸收-加鹽精餾組合法提濃稀鹽酸的實驗研究。分別研究了鹽濃度、吸收劑流量、塔釜加料量對該過程的影響。小試實驗裝置中采用解吸釜與吸收塔相連,分別以20%鹽酸作為解吸液和吸收液。結果表明:解吸液中加鹽濃度為0.3g/mL MgCl2時,高濃度HCl解吸氣經吸收液吸收可獲得濃度為32.80%的濃鹽酸;將解吸釜內解吸至6.5%鹽酸釜殘液繼續進行間歇加鹽精餾,其中首先從塔頂采出的20%稀鹽酸可作為解吸液或吸收液循環使用。該方法適用于間歇法小規模稀鹽酸提濃處理。
廢稀鹽酸;加鹽解吸;氣體吸收;加鹽精餾
鹽酸是化工和制藥領域常用的酸洗劑及原料,同時在這些生產過程中也會排放大量的低濃度廢鹽酸。由于鹽酸通常會形成最高共沸物,共沸組成含氯化氫20.24%(質量分數),用普通精餾的方法無法得到濃度較高的鹽酸溶液。而目前國內外應用比較成熟的大規模稀鹽酸處理工藝主要有常規解吸法、壓差法和催化劑法等。常規解吸法只適用于濃度高于20.24%的鹽酸的解吸過程;壓差法[1]對設備的要求較高;催化劑法又分為硫酸法[2]和氯化鈣法[3]。而Hála等[4-5]的研究成果表明,加鹽對溶液氣液平衡具有十分顯著的影響。因此在該理論的支持下,加鹽精餾過程正成為許多學者研究的熱點[6-8]。鹽酸加鹽精餾過程會產生大量的氯化氫不凝氣,降低了氯化氫的回收率,同時也很難在塔頂得到較高濃度的鹽酸溶液。針對這一情況,本文作者提出了吸收與加鹽解吸過程耦合的方法進行間歇小規模稀鹽酸的提濃,避免了單純加鹽精餾存在的缺陷。
1 工藝原理
根據鹽效應理論[9],在稀鹽酸溶液中加入鹽可以改變組分的相對揮發度,破壞鹽酸與水的恒沸組成。但由于在加鹽精餾過程會產生大量HCl不凝氣,使得塔頂無法得到濃度較高的鹽酸產品。因此,本研究采用向塔釜加入20%鹽酸進行加熱解吸,同時以一定量20%鹽酸作為吸收劑對解吸出的HCl進行吸收,吸收結束后可以得到濃度大于30%的鹽酸溶液。之后,再對解吸所產生的稀鹽酸釜殘液進行加鹽精餾,最后在塔頂可以得到濃度大于20%的鹽酸,而在塔釜溶液的濃度接近于純水。實驗原理見圖 1所示。
2 吸收與加鹽解吸耦合提濃鹽酸
2.1 工藝概述
本實驗主要研究了塔釜加鹽量、塔釜解吸液加料量、吸收劑流率對耦合過程的影響,評價參數包括:達到平衡時吸收液中HCl濃度、塔釜解吸液中HCl濃度、HCl的吸收率以及達到平衡所用的時間等。具體流程見圖2所示。
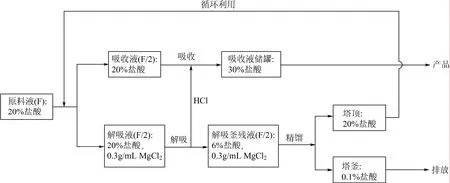
圖1 組合法稀鹽酸提濃工藝原理示意圖

圖2 解吸-吸收組合法實驗裝置示意圖
向塔釜加入一定濃度的鹽溶液MgCl2,當塔釜加熱到一定溫度后加入20%的鹽酸溶液,同時在塔頂也加入一定量的20%鹽酸作為吸收劑。塔釜加鹽解吸出的HCl和水蒸氣進入冷凝器,水蒸氣冷凝后回到塔釜增加HCl的分壓有利于解吸,而冷卻后的HCl在吸收塔中被塔頂噴淋而下的20%鹽酸進行充分地吸收。吸收之后的鹽酸溶液又重新回到塔頂作為吸收劑,循環操作直至解吸與吸收過程達到平衡。最后在吸收液儲槽中得到質量分數高于30%的鹽酸溶液。
2.2 實驗結果與分析
2.2.1 塔釜加鹽量對耦合過程產生的影響
本實驗配制質量分數為20%的鹽酸1000 mL,其中500 mL用于塔釜解吸,另外500 mL作為吸收劑加入塔頂儲罐。塔釜加入氯化鎂質量濃度分別取0.1 g/mL、0.2 g/mL、0.3 g/mL,考察不同鹽濃度下對平衡時吸收液中HCl濃度、塔釜解HCl濃度、HCl的吸收率及平衡時間這4個參數的影響。不同鹽濃度下吸收液鹽酸濃度隨時間變化見圖3。
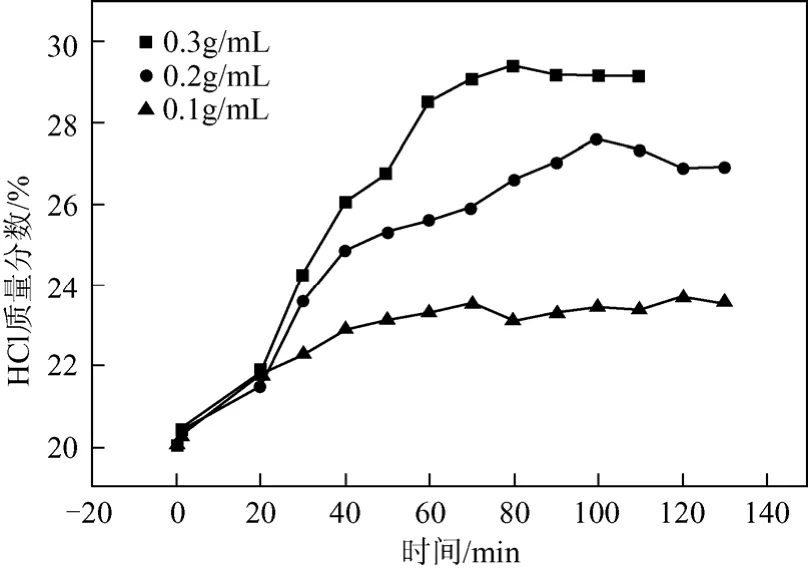
圖3 不同鹽濃度下吸收液鹽酸濃度隨時間變化圖
從圖3對比分析可以看出,實驗的初始階段由于溫度較低,塔釜鹽濃度對吸收液平均組成沒有明顯影響。隨著塔釜溫度升高,HCl解吸量加大,鹽濃度對吸收液濃度的影響開始顯現。當實驗進行到20 min后,塔釜鹽濃度0.3 g/mL時吸收液濃度 > 0.2 g/mL時吸收液濃度 > 0.1 g/mL時吸收液濃度。這是因為,當塔釜鹽濃度增加后,由于同離子效應的作用,HCl的解吸量和解吸速率增加,使得氣相氯化氫分壓增大,進而增大了吸收液的平衡濃度。
本實驗中,HCl的吸收率和操作時間也是比較重要的考察指標。由于塔高和吸收液流率的限制,吸收液不能將解吸出的HCl氣體完全吸收。HCl的吸收率是指吸收劑吸收的HCl量占解吸出HCl 量的百分比。
從表1中可以看出,塔釜氯化鎂的加入量越大,操作時間越短, HCl吸收率越低。這是由于當塔釜氯化鎂濃度增加時,HCl氣體的解吸速率和解吸量都會增加,從而使操作時間縮短,HCl吸收率降低。
2.2.2 塔釜加料量對耦合過程產生的影響
當塔釜加料量發生變化時,鹽酸解吸速率與解吸量都會發生變化,從而影響吸收液和塔釜解吸液的平衡濃度。本實驗中,在塔頂吸收液加入量(500 mL)、加入速率(15 mL/min)及塔釜鹽濃度(0.3 g/mL)保持不變的前提下,研究了塔釜加料量分別為500 mL、600 mL、700 mL時對吸收液和解吸液的平衡濃度、操作時間以及HCl吸收率的影響。不同塔釜加料量對吸收液鹽酸濃度的影響見圖4。

表1 塔釜加鹽量對操作時間、HCl吸收率的影響
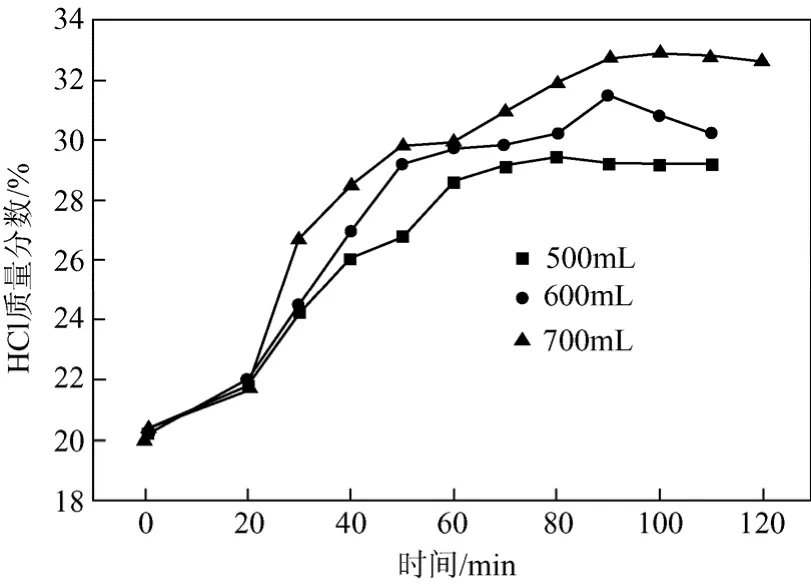
圖4 不同塔釜加料量時吸收液濃度隨時間變化圖
從圖 4對比分析可以看出,當實驗進行到 20 min后,塔釜加料700 mL時吸收液濃度 > 600 mL時吸收液濃度 > 500 mL時吸收液濃度。這是因為,在鹽濃度保持相同的情況下,塔釜加料量增加后解吸出更多的氯化氫氣體再進一步被充分吸收,從而增大了吸收液濃度。塔釜加料量的增加對操作時間和HCl吸收率也會產生一定的影響,塔釜加料量對操作時間和HCl吸收率的影響見表2。
從表2中可以看出,操作時間隨塔釜加料量的增加而增加,這是由于在相同鹽濃度條件下,增加塔釜進料量會使HCl的解吸量增加,相應的操作時間也會增長。HCl的吸收率隨塔釜進料量的增加而降低,這是由于加料量的增加使解吸的HCl量增加,在吸收劑加入量和流率保持不變的情況下,HCl的吸收效率相對降低。
2.2.3 吸收劑流率對耦合過程產生的影響
吸收劑用量L或液氣比L/V在吸收塔的設計計算和塔的操作調節中是一個很重要的參數。當V值一定時,吸收劑用量L增大,相應的傳質推動力會增大,結果就會使吸收劑的出塔濃度降低。但是由于本實驗中吸收劑是循環使用的,在傳質推動力增大的情況下,吸收劑的出塔濃度并不會降低。本實驗中,在塔頂吸收劑加入量(500 mL)、塔釜進料量(600 mL)、進料塔釜溫度(50 ℃)及塔釜鹽濃度(0.3 g/mL)保持不變的前提下,研究了吸收劑流率分別為10 mL/min、15 mL/min、20 mL/min時對各評價參數產生的影響。不同吸收劑流率對吸收液濃度的變化如圖5所示。

表2 塔釜加料量對操作時間、HCl吸收率的影響

圖5 不同吸收劑流率下吸收液濃度隨時間變化圖
從圖5可以看出,實驗開始階段吸收劑流率越小吸收液鹽酸濃度越高。其中吸收劑流量為10mL/min時吸收液濃度最高升至34.11%,隨后濃度開始下降。隨著實驗的進行,當吸收達到平衡時,吸收液流量為20 mL/min時吸收液濃度 >15 mL/min時吸收液濃度 > 10 mL/min時吸收液濃度。這是由于塔釜加料量一定,當吸收劑流率增大時,液氣比增大,吸收效率提高,進而增大了吸收液的平衡濃度。
吸收劑流率增加對HCl吸收率也會產生一定的影響,不同吸收劑流率下HCl吸收率如表3所示。
由表3可以看出,HCl的吸收率隨吸收劑流率的增加而增大,這是由于當吸收劑流率較小時,達到平衡所需的HCl量越小,從而使HCl的損失量增加。
3 間歇精餾處理鹽酸釜殘液
3.1 流程簡述
以鹽酸釜殘液為原料進行間歇加鹽精餾,分別研究了塔釜鹽濃度、回流比對塔頂、塔釜鹽酸濃度的影響,以便找出合適的操作條件,實現鹽酸的深度脫吸。具體流程見圖6。

表3 吸收劑流率對HCl吸收率的影響

圖6 間歇加鹽精餾實驗裝置示意圖
在實驗開始之前,首先要對釜殘液的鹽酸濃度進行調整,將鹽酸濃度統一調整到 6%,以便于對實驗結果進行對照分析。鹽酸濃度調整之后,再向釜殘液中加入一定量的氯化鎂,進行60 min的全回流操作,使全塔處于穩定狀態。全回流操作結束后,控制回流比在一定值,采出餾分。最后,用標準氫氧化鈉溶液對釜殘液以及采出樣品的鹽酸濃度進行標定。
3.2 結果討論與分析
3.2.1 塔釜鹽濃度對間歇精餾過程產生的影響
本實驗在回流比(全采出)及其它實驗條件不變的前提下,研究了塔釜鹽濃度(氯化鎂)分別為0.1 g/mL、0.2 g/mL、0.3 g/mL時塔頂、塔釜產品鹽酸濃度隨時間變化的情況。塔頂鹽酸濃度隨時間變化曲線如圖7所示。

圖7 不同加鹽量時塔頂鹽酸濃度隨時間變化曲線
從圖7對比分析可以看出,塔釜鹽濃度不同時,塔頂產品鹽酸濃度變化過程存在很大差別。當氯化鎂濃度為0.3 g/mL時,塔頂一開始就可以采出濃度較高的產品,隨后濃度逐漸降低;而當氯化鎂濃度為0.2 g/mL和0.1 g/mL時,塔頂開始階段采出液幾乎為純水,隨后濃度逐漸升高;氯化鎂濃度為 0.3 g/mL時,可以采出濃度為 20%的鹽酸;而氯化鎂濃度為0.2 g/mL、0.1 g/mL時,塔頂餾出液鹽酸濃度都達不到20%。塔釜鹽濃度不同時,操作時間也不同,氯化鎂濃度為0.3 g/mL時,實驗需70 min達到終點;而當氯化鎂濃度為0.1 g/mL時,實驗需120 min達到終點。綜合各因素,可以看出氯化鎂濃度為0.3 g/mL時,實驗結果較為理想。
3.2.2 回流比對間歇精餾過程產生的影響
回流比的大小對精餾過程的分離效果和經濟性有著重要的影響。在常規物系的分離中增大回流比,可以提高產品純度,但也會增加能耗。鹽酸-水物系屬于特殊物系,HCl為揮發性電解質,在塔頂會形成不凝氣不能被冷凝器冷卻,因此回流比對鹽酸-水物系的影響不同于常規物系。本實驗在塔釜鹽濃度為0.3 g/mL的前提下,研究了無回流及回流比為0.5、1時塔頂鹽酸濃度隨時間的變化情況見圖8。
從圖8對比分析可以看出,當回流比不同時,塔頂餾出液鹽酸濃度變化趨勢基本相同,但塔頂產品的初始濃度不同,回流比越大鹽酸濃度越低。這主要是因為,當回流比增大時,塔頂HCl不凝氣增多,不被吸收的HCl氣體將從塔頂逸出,使得塔頂產品濃度降低。當實驗進行到第30 min時,塔頂產品鹽酸濃度均接近20%,但由于回流比不同,濃度為20%的鹽酸采出量也不同,回流比越大,采出量越小。綜合各因素考慮,回流比為0時實驗結果較為理想。

圖8 不同回流比下塔頂濃度隨時間變化曲線
本實驗20%鹽酸原料液經加鹽解吸-氣體吸收-加鹽精餾組合法提濃后,最后在吸收劑儲罐中得到了質量分數大于30%的鹽酸,在精餾塔頂得到質量分數接近20%的鹽酸,而在塔釜濃度近乎為純水。不同濃度的鹽酸收率見表4。

表4 不同鹽酸濃度的產品收率
4 結 語
(1)在本實驗中,當 20%鹽酸解吸液的鹽MgCl2濃度達到 0.3 g/mL時,可解吸降低濃度至6.50%,與此同時,20%鹽酸吸收液可增大濃度達到32.80%。
(2)增大吸收劑流量可以明顯提高吸收效率,當吸收劑流量為20 mL/min時,HCl的吸收率可以達到75.12%。
(3)對于釜殘液間歇加鹽精餾而言,當釜殘液加入 0.3 g/mL MgCl2鹽溶液時,塔頂可以采出20%鹽酸74 mL,鹽酸的平均濃度為17.25%,而釜液HCl濃度低于0.1%。
相對于目前工業大規模稀鹽酸的處理工藝,本文所提出并研究的加鹽解吸-氣體吸收-加鹽精餾組合法提濃鹽酸的過程,是適用于間歇小規模廢稀鹽酸的處理。其主要針對在化工制藥領域中產生的廢稀鹽酸,是出于環保和資源循環利用的角度來考慮的。但本研究只是驗證該處理工藝在技術上是基本可行的,還處于研究的初步階段。今后還需要進一步研究塔釜加入固體鹽的控制方法以及塔釜加壓量對鹽酸解吸過程的影響;同時可以建立合適的模型對實驗過程進行模擬,從模擬的角度對實驗條件進行優化。
[1]仇曉豐,吳春森,伍明霞,等. 淺談氯化氫吸收與鹽酸脫吸技術[J].氯堿工業,2004(1):32-36.
[2]唐涌濂. 稀廢鹽酸半連續萃取蒸餾制取濃鹽酸的方法:中國,200410017364.7[P]. 2004-04-01.
[3]佐佐木正和,冨田知道,大池東久雄,等. 氯化氫的生產方法:中國,00105343.4[P]. 2000-03-31.
[4]Hála E. Excess free energy of dilution and the mean rational activity coefficients of ions[J].Collection Czech. Chem. Commun.,1963,28:1780.
[5]Hála E,Boublik T. Correlation of equilibrium data in three- and more component systems[J].Collection Czech. Chem. Commun.,1964,29:2412.
[6]趙林秀,王小燕,崔建蘭,等. 加鹽萃取精餾分離乙酸甲酯-甲醇二元恒沸物[J]. 石油化工,2005,34(2):144-147.
[7]許新樂. 雜醇油加鹽萃取精餾提取低水乙醇的研究[J]. 青海大學學報,2001,19(4):26-28.
[8]陳小平,張珠. 加鹽萃取精餾分離乙酮-水恒沸物的研究[J]. 煙臺大學學報,2002,15(2):128-132.
[9]Furter W F. Salt distillation review[J].Can. J. Chem. Eng.,1978,25(5):33-38.
Concentrating dilute hydrochloric acid by combined method
WU Zhenyu,GAO Ruichang,BAI Peng,LIU Weiming,XIAO Ying,LI Ying
(School of Chemical Engineering and Technology,Tianjin University,Tianjin 300072,China)
In this work,the combination of salt desorption,gas absorption and salt-added distillation was used to conduct experimental research of concentrating dilute hydrochloric acid. The influence of salt concentration,absorbent flow rate,still capacity on the process was investigated. For the lab experiment,the desorption still was connected directly with the absorption tower,and hydrochloric acid(20%) was used as both desorption solution and absorbent. It was shown that when 0.3 g/mL MgCl2was added in the desorption solution,hydrochloric acid enriched gas from the solution could be absorbed by the absorbent,whose concentration then increased to 32.80%. After that,salt-added distillation was carried out to deal with the residue hydrochloric acid(6.5%)in the desorption still. Hydrochloric acid(20%),which was recycled in the experiment as both desorption solution and absorbent,could be wihdrawn from the top of the distillation tower. The method mentioned in this work is suitable for small scale batch operation of concentrating dilute hydrochloric acid.
dilute hydrochloric acid;salt desorption;gas absorption;salt distillation
TQ 028.1+7
A
1000-6613(2011)08-1862-06
2010-12-23;修改稿日期2011-01-29。
吳振玉(1986—),女,碩士研究生,研究方向為制藥化工分離過程。E-mail wuzhenyu0723@163.com。聯系人:白鵬,教授。E-mail baipengtju@gmail.com。

