溶劑萃取-差示脈沖溶出伏安法測定橘皮中的鄰苯基苯酚
李 靜,李紅波,,*,杜 詩,任艷艷,胡效亞
(1.鹽城工學院化學與生物工程學院,江蘇 鹽城 224051;2.揚州大學化學化工學院,江蘇 揚州 225002)
溶劑萃取-差示脈沖溶出伏安法測定橘皮中的鄰苯基苯酚
李 靜1,李紅波1,2,*,杜 詩2,任艷艷2,胡效亞2
(1.鹽城工學院化學與生物工程學院,江蘇 鹽城 224051;2.揚州大學化學化工學院,江蘇 揚州 225002)
建立溶劑萃取-差示脈沖溶出伏安法測定橘皮中的鄰苯基苯酚(OPP)的方法。為避免橘皮中大量抗壞血酸和香精油等物質的影響,采用甲苯萃取橘皮中的OPP,在優化實驗條件下,運用差示脈沖溶出伏安法測定橘皮中OPP含量。結果表明,OPP氧化峰電流與其濃度在2.0×10-9~4.0×10-6mol/L范圍內呈良好的線性關系,檢出限達到8.1×10-10mol/L,回收率為106.7%~112.2%。該法操作簡單、快速、靈敏、準確。
電化學;溶劑萃取;鄰苯基苯酚;橘皮
鄰苯基苯酚,又名2-羥基聯苯(OPP),是一種強有效的殺真菌劑,在蔬菜和水果特別是柑橘類水果的儲存、運輸和配送過程中起殺真菌作用的活性成分。由于它能夠抑制收后果實因微生物菌而腐爛,所以可以用作為果實箱的消毒劑[1]。OPP被認為可能是一種潛在的致癌物,在動物體內的實驗[2]證明它誘發并干擾生物體的生長,降低產量,損壞腎臟。GB 2760—96《食品添加劑使用衛生標準》規定,OPP作為食品添加劑最大允許殘留量為12mg/kg。
目前,已經有若干種檢測OPP在柑橘類水果中殘留量的方法,如帶有熒光檢測器(FLD)的液相色譜法(LC)[3-7]、質量選擇檢測器(MSD)液相色譜檢測法[8-9]、紫外(UV)高效液相色譜法(HPLD)[10]和二極管陣列檢測器[11]液相色譜法;氣相色譜法(GC)(有時會衍生使用火焰離子化檢測器[12-13]、質譜選擇檢測器[14-16]),以及光譜法[17-18]等。但是已報道的檢測方法具有耗時長、儀器昂貴、靈敏度較低等缺點。本實驗為避免橘皮中大量抗壞血酸和香精油等物質對電化學法測定OPP的影響,故采用溶劑(甲苯)萃取-差示脈沖溶出伏安法測定橘皮中的OPP,以期為鄰苯基苯酚測定方法的建立提供一定的參考。
1 材料與方法
1.1 材料、試劑與儀器
橘子 超市采購。
OPP(純度99.5%) 鹽城華業醫藥化工有限公司;鱗片石墨 上海國藥試劑有限公司。OPP標準溶液的配制:將OPP溶于95%乙醇配成濃度為1.0×10-3mol/L的溶液,保存于容量瓶中并放置黑暗處,使用之前再用緩沖溶液稀釋至所需濃度。不同pH值磷酸鹽緩沖溶液(由不同比例的 0.1mol/L Na2HPO4、NaH2PO4和 H3PO4配制而成)。所有試劑均為分析純;實驗用水均為二次蒸餾水。
CHI760D電化學分析儀(三電極體系:工作電極為石墨電極,參比電極為飽和甘汞電極(SCE),對電極為鉑絲電極) 上海辰華儀器有限公司;KQ118型超聲波清洗器 中國昆山市超聲波儀器有限公司;pHS-25精密pH計 中國上海雷磁儀器廠。
1.2 方法
1.2.1 樣品中鄰苯基苯酚的提取
將橘皮切成碎末,然后稱取其1.0g 碎末于容量瓶中,加入甲苯100mL(分5次萃取),每次超聲振蕩1h后抽濾,將濾液集中到梨形瓶中旋轉蒸發。蒸發結束后,用95%乙醇潤洗梨形瓶3次,將潤洗液倒入容量瓶中并定容為100mL供樣品分析使用。
1.2.2 伏安法測定
在0.3~1.0V區間內以100mV/s的掃速對稀釋后的OPP分別作循環伏安(CV)和差示脈沖溶出伏安測試。采用差示脈沖伏安法進行OPP的定量及樣品分析,其工作條件為:振幅為0.05V;脈沖持續時間為0.05s;脈沖周期為0.2s。
2 結果與分析
2.1 橘皮中鄰苯基苯酚提取方法的選擇
橘皮中含有大量的抗壞血酸和香精油等物質,其中大量存在的抗壞血酸和部分香精油成分對電化學測定OPP有干擾,因此避免其干擾成為用電化學法測定橘皮中OPP的關鍵問題。綜合考慮到抗壞血酸的水溶性、香精油成分的較低沸點和OPP具有微溶于水而易溶于有機溶劑且具有一定極性等特點。本實驗采用合適極性的非水溶劑甲苯作為萃取溶劑,使得橘皮中含有大量的香精油等物質溶于其中,而水溶性的大量抗壞血酸則可以被隔離出萃取劑中。5次萃取后,通過旋轉蒸發使甲苯和較低沸點的香精油得到回收。整個萃取過程由氣相色譜-質譜跟蹤以保證待測物得到完全萃取。蒸發結束后,用95%乙醇潤洗梨形瓶3次,將潤洗液倒入容量瓶中并定容為100mL供分析使用。
2.2 緩沖溶液及其pH值的選擇
考察乙酸-乙酸鈉、檸檬酸-檸檬酸鈉和磷酸鹽緩沖液,發現在磷酸鹽緩沖液中峰電流最大且峰形好。圖1為pH3.0~8.0時的磷酸鹽緩沖液循環伏安圖。由圖2可見,pH值與峰電位呈線性關系,隨著pH值的增大峰電流達到最大然后逐漸變小,說明電化學過程伴隨著質子參與反應;當pH8.0時,體系中質子數最少,因此在電極表面發生氧化反應的OPP濃度就最小。其中,pH 4.0時峰電流最大;因此,本實驗選擇pH4.0的磷酸鹽緩沖液為底液。
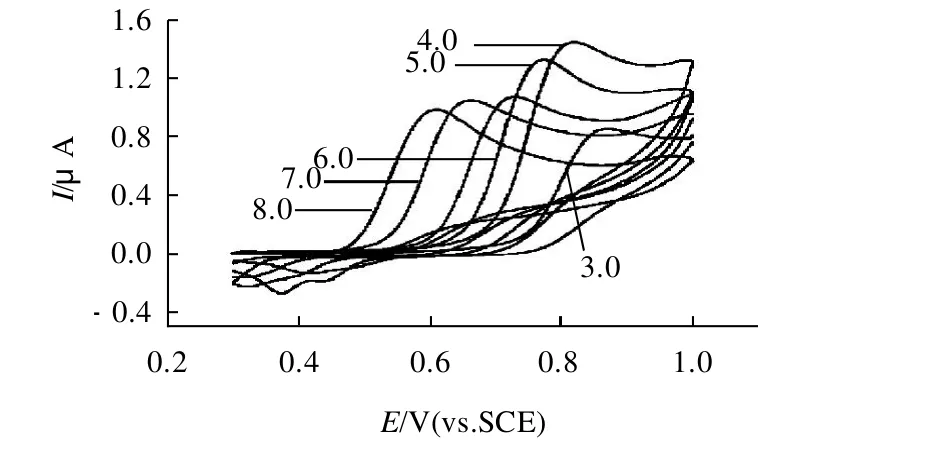
圖1 pH3.0~8.0磷酸鹽緩沖溶液中鄰苯基苯酚的循環伏安曲線Fig.1 Circulated voltammery curve of OPP in PBS buffer at a pH ranging from 3.0 to 8.0
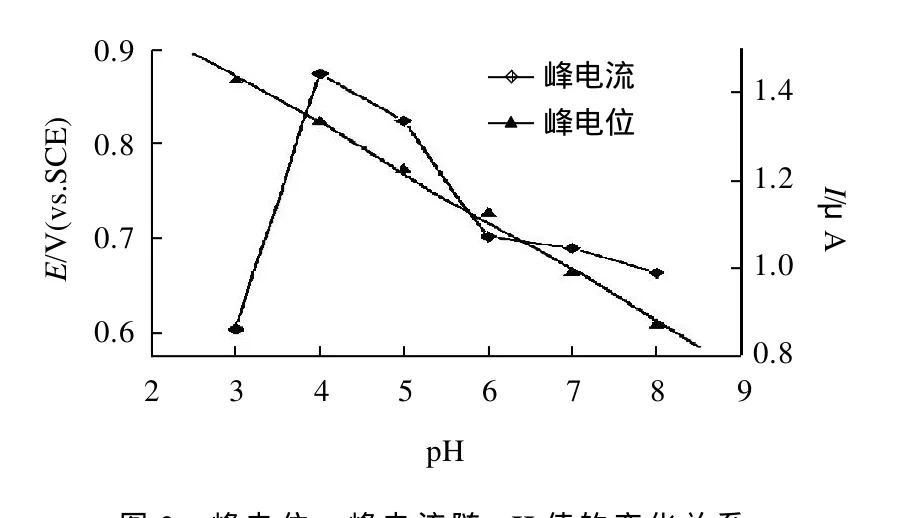
圖2 峰電位、峰電流隨pH值的變化關系Fig.2 Effect of pH on peak potential and peak current
2.3 差示脈沖溶出伏安測定橘皮的鄰苯基苯酚
2.3.1 富集電位和富集時間的確定
當pH4.0時,1.0×10-9mol/L的OPP于電極上的最佳富集電位和富集時間分別為0V和120s。在富集電位為0V時考察富集時間(60、80、100、120、160、240s)對峰電流的影響,結果發現,120s后OPP氧化峰電流變化不大;在富集時間為1 20 s時,考察富集電位(-0.2、-0.1、0、0.1、0.2、0.3V)對峰電流的影響,結果發現,隨著富集電位的增大,峰電流隨著增大,當富集電位大于0V時,峰電流逐漸減小,因此,0V和120s作為電極富集的最佳條件。
2.3.2 線性范圍和檢出限
在優化的實驗條件下,應用差示脈沖溶出伏安法對OPP進行測定。圖3為不同濃度的OPP在石墨電極上的差分脈沖伏安曲線,可看出OPP濃度與峰電流的線性關系。OPP的氧化電流Ip/μA與OPP的濃度/(mol/L)在2.0×10-9~4.0×10-6mol/L范圍內呈良好的線性關系,線性方程為Ipa=113.8156+0.9523c,r= 0.9924;檢出限為8.1×10-10mol/L,比氣相色譜法[3]報道的檢出限低一個數量級。對含有5.0×10-9mol/L OPP的PBS緩沖液,連續9次測定,相對標準偏差(RSD)為3.54%,表明該檢測方法重現性好。
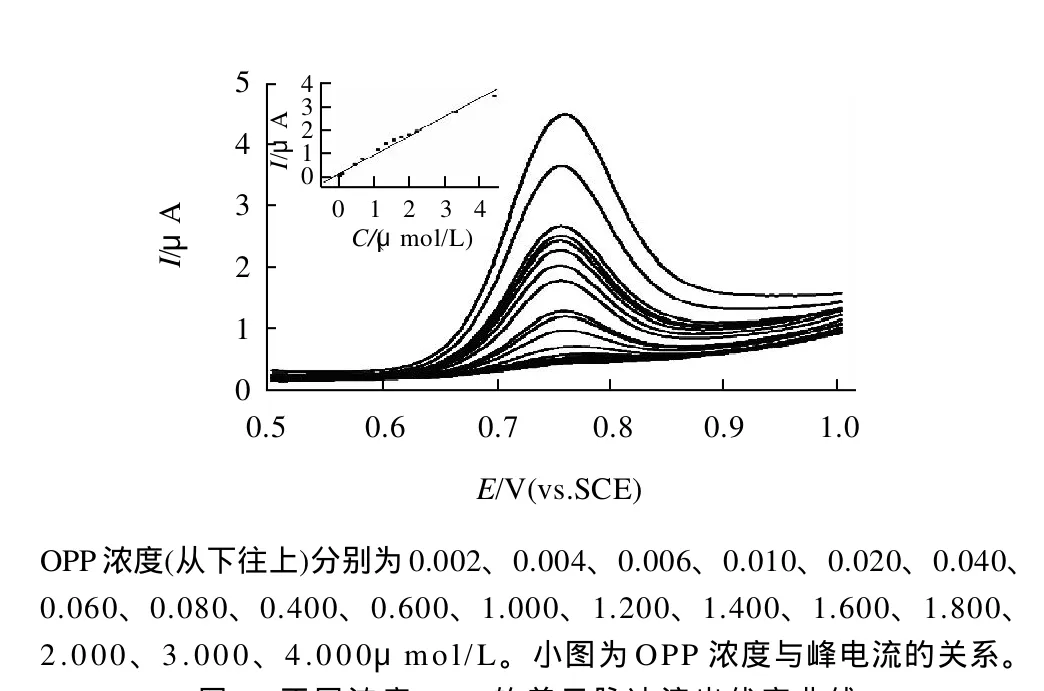
圖3 不同濃度OPP的差示脈沖溶出伏安曲線Fig.3 Differential pulse stripping voltammetry curves of OPP at various concentrations
2.3.3 樣品的測定及回收率實驗
對橘皮萃取液用PBS緩沖液適當稀釋后,用本法對其進行測定;為了驗證本方法的可行性,進一步地做了回收率實驗(表1)。結果表明,回收率106.7%~112.2%,本方法可以用來測定橘皮中的OPP。
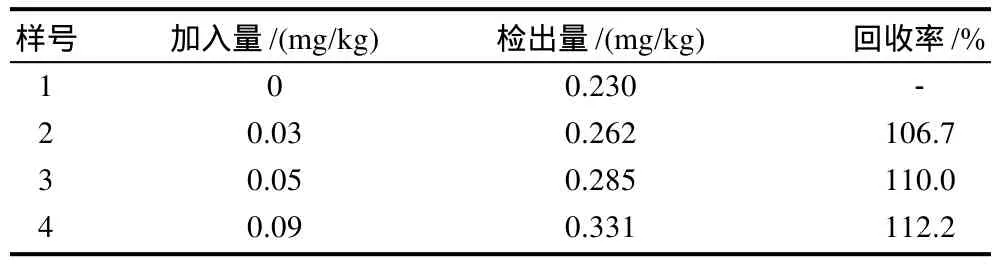
表1 橘皮中鄰苯基苯酚的回收率Table 1 Recovery rate of OPP in orange peel
3 結 論
運用甲苯萃取橘皮中的OPP避免了橘皮中大量抗壞血酸和香精油等物質對電化學法測定該物質的影響;差示脈沖溶出伏安法測定橘皮中OPP含量具有試樣用量少、靈敏度高、檢出限低、反應速度快、穩定性好和操作簡單等特點。這為橘皮中OPP的痕量檢測提供了一種新方法。
[1] CAPITAN-VALLVEY L F, DEHEIDEL M K A, AVIDAD R. Solidphase spectrophosphorimetric determination of the pesticideophenylphenol in water and vegetables[J]. Anal Bioanal Chem, 2003, 375(5): 685-691.
[2] APPEL K E. The carcinogenicity of the biocide ortho-phenylphenol[J].Archives of Toxicology, 2000, 74(2): 61-71.
[3] KOLBE N, ANDERSSON J T. Simple and sensitive determination ofo-phenylphenol in citrus fruits using gas chromatography with atomic emission or mass spectrometric detection[J]. J Agric Food Chem, 2006,54(16): 5736-5741.
[4] SAAD B, HANIFF N H, SALEH M I, et al. Determination of orthophenylphenol, diphenyl and dphenylamine in apples and oranges using HPLC with fluorescence detection[J]. Food Chem, 2004, 84(2): 313-317.
[5] YAMAZAKI Y, NINOMIYA T. Determination of benomyl, diphenyl,o-phenylphenol, chlorpyrifos, methidathion, and methyl parathion in oranges by solid-phase extraction, liquid chromatography[J]. J AOAC Int, 1999, 82(6): 1474-1478.
[6] MOTOHASHI N, NAGASHIMA H, MEYER R. High-performance liquid chromatography of fungicides in citrus fruits[J]. J Liq Chromatogr,1991, 14(19): 3591-3602.
[7] ZAMORA T, HIDALGO C, LOPEZ F J, et al. Determination of fungicide residues in fruits by coupled-column liquid chromatography[J]. J Sep Sci, 2004, 27(9): 645-652.
[8] BLASCO C, PICO Y, FONT G. Monitoring of five postharvest fungicides in fruit and vegetables by matrix solid-phase dispersion and liquid chromatography/mass spectrometry[J]. J AOAC Int, 2002, 85(3): 704-711.
[9] YOSHIOKA N, AKIYAMA Y, TERANISHI K. Rapid simultaneous determination ofo-phenyphenol, diphenyl, thiabendazole, imazalil and its major metabolite in citrus fruits by liquid chromatography-mass spectrometry using atmospheric pressure photoionzation[J]. J Chromatogr A, 2004, 1022(1/2): 145-150.
[10] PROUSALIS K P, POLYGENIS D A, SYROKOU A, et al. Determination of carbendazim, thiabendazole, ando-phenylphenol residues in lemons by HPLC following sample clean-up by ion-pairing[J]. Anal Bioanal Chem, 2004, 379(3): 458-463.
[11] 牛增元, 包艷, 葉曦雯, 等. 高效液相色譜法測定水性涂料中的酚類防霉劑[J]. 分析試驗室, 2008, 27(3): 48-51.
[12] WOOD R. MAFF validated methods for the analysis of foodstuffs No.V4. Biphenyl and 2-hydroxybiphenyl in citrus fruits[J]. J Assoc Public Anal, 1992, 28(1): 43-49.
[13] HERNANN T S, POST A A. Quamtitative determination of traces of indole ando-phenylphenol by direct aqueous-injection gas chromatography[J]. Anal Chem, 1968, 40(10): 1573-1576.
[14] JOHNSON G D, HARSY S G, Geronimo J, et al. Orthophenol and phenylhydroquinone residues in citrus fruit and processed citrus products after postharvest fungicidal treatments with sodium orthophenylphenate in California and Florida[J]. J Agric Food Chem,2001, 49(5): 2497-2502.
[15] YU L, SCHOEN R, DUNKIN A, et al. Determination ofo-phenylphenol,diphenylamine, and propargite pesticide residues in selected fruits and vegetables by gas chromatography/mass spectrometry[J]. J AOAC Int,1997, 80(3): 651-656.
[16] BARTELS M J, BRZAK K A, BORMETT G A. Determination of ortho-phenylphenol in human urine by gas chromatography-mass spectrometry[J]. J Chromatogr B, 1997, 703(1/2): 97-104.
[17] CAULFIED P H, ROBINSON R J. Spectrophotometric determination ofo-phenylphenol with titanium sulfate[J]. Anal Chem, 1953, 25(6):982-983.
[18] GARCIA REYES J F, LLORENT MARTINEZ E J, ORTEGA BARRALES P, et al. Continuous flow separation and pre-concentration coupled on-line to solid-surface fluorescence spectroscopy for the simultaneous determination ofo-phenylphenol and thiabendazole[J]. Anal Bioanal Chem, 2004, 378(2): 429-437.
Determination ofO-Phenlyphenol in Orange Peel by Solvent Extraction Coupled with Differential Pulse Stripping Voltammetry
LI Jing1,LI Hong-bo1,2,*,DU Shi2,REN Yan-yan2,HU Xiao-ya2
(1. College of Chemical and Biological Engineering, Yancheng Institute of Technology, Yancheng 224051, China;2. College of Chemistry and Chemical Engineering, Yangzhou University, Yangzhou 225002, China)
The solvent extraction-differential pulse stripping voltammetry method was developed to determineO-phenlyphenol(OPP) in orange peel. In order to avoid the influence of ascorbic acid and essential oil, OPP was extracted by toluene from orange peel. Under the optimal conditions, differential pulse stripping voltammetry was used to determine OPP in orange peel. The results demonstrated that the oxidative peak current of OPP was linearly correlated with the OPP concentrations in the range of 2.0 × 10-9- 4.0 × 10-6mol/L. The detection limit and recovery rate of this developed method were 8.1 × 10-10mol/L and 106.7%-112.2%, respectively. Therefore, this developed method is characteristics of simple operation, fast detection, high sensitivity and accuracy.
electrochemistry;solvent extraction;O-phenlyphenol;orange peel
O657. 1
A
1002-6630(2011)06-0195-03
2010-06-16
國家自然科學基金項目(20875081;21075107);鹽城工學院自然科學基金項目(XKY2009009)
李靜(1978—),女,講師,碩士,主要從事重金屬離子檢測研究。E-mail:hnzklhz@yahoo.com.cn
*通信作者:李紅波(1979—),男,講師,博士研究生,主要從事食品電化學檢測研究。E-mail:lhbchem@163.com
- 食品科學的其它文章
- 超臨界CO2萃取紫蘇葉揮發油的工藝優化
- 超臨界CO2流體萃取-GC-MS分析南北五味子揮發油成分
- 沙蔥籽油的超臨界CO2萃取及成分分析
- Central Properties of the Metabolites ofHouttuynia cordataThunb.Populations from Different Altitudes in Guizhou
- Effects of Deformation Rate and Degree of Compression on Texture Profile Analysis of Hard-boiled Egg
- 紫薯色素兩種提取方法的比對研究

