桑枝總黃酮的抗氧化活性研究
章丹丹, 高月紅, Jessica Tao Li, 潘一峰, 卞 卡,3*
(1.上海中醫藥大學穆拉德中藥現代化研究中心,上海 201203;2.上海現代中醫藥技術發展有限公司,上海 200051;3.美國德克薩斯大學休斯頓醫學院綜合生物及藥理學系,德克薩斯大學分子醫學研究所,休斯頓TX 77030)
桑枝Mori Ramulus是桑科植物桑Morus albaL.的干燥嫩枝,是中醫常用的傳統藥物,有祛風活絡、通利關節、燥濕利水之功效,臨床多用于肩臂關節腫痛麻木,風濕痹證等多種疾病[1]。桑枝含有多種黃酮成分,具有抗炎抗氧化、降糖降脂以及提高機體免疫功能等多種藥效[2]。桑枝作為保健物品,其皮的醇提物具有較好的2,2-diphenyl-picrylhydrazyl radical(DPPH)自由基清除作用,不同桑枝品種總黃酮的總抗氧化能力、清除自由基能力及清除超氧陰離子能力各有不同,且總抗氧化能力與總黃酮含量呈正相關關系[3]。目前尚無應用多種化學和細胞模型對桑枝精制總黃酮進行綜合抗氧化活性研究的報道。
本實驗考察了利用有機溶劑及大孔樹脂純化富集的桑枝總黃酮于體外3種抗氧化無細胞系統和2種細胞炎癥模型中的抗氧化活性。
1 材料和儀器
1.1 藥材和試劑 桑枝購自上海養和堂中藥飲片有限公司。D-101樹脂,天津南開大學化工廠。蘆丁標準品,購自上海中藥標準化研究中心。人臍靜脈內皮細胞株(ECV304)購自武漢大學中國典型培養物保存中心。小鼠巨噬細胞 RAW264.7購自ATCC公司。RPMI 1640、胎牛血清購自Gibco公司。Trolox、DPPH、2,4,6-Tris(2-pyridyl)-s-triazine(TPTZ)、2,2'-azinobis-(3-ethylbenzothiazoline-6-sulphonic acid(ABTS)、肌紅蛋白(Mb)、血管緊張素(Ang II)、二甲基亞砜(DMSO)、脂多糖(lipopolysaccharide LPS)、Griess reactin試劑均購自Sigma公司。Bio-rad蛋白測定試劑購自Bio-rad公司。鼠重組IFN-γ購自BD公司。其它試劑均為分析純。
1.2 儀器 旋轉蒸發儀(瑞士Buchi公司);酶標儀(美國MD公司);D278532高速冷凍離心機(德國Hettich公司);超低溫冰箱(美國 Thermo公司);UV21700紫外分光光度計(日本島津公司);超聲波細胞粉碎機(寧波新芝生物科技股份有限公司)。
2 方法
2.1 桑枝總黃酮(TFMR)的制備 桑枝飲片用75%乙醇80℃回流提取3次,合并提取液,過濾后減壓回收乙醇。得到的乙醇提取物用石油醚脫脂,直至石油醚層近無色。脫脂提取物加水溶解,離心后取上清液,用乙酸乙酯萃取多次至乙酸乙酯層無色,合并乙酸乙酯萃取液,減壓濃縮至小體積,D-101樹脂柱吸附,繼而以蒸餾水、10%乙醇預洗脫,70%乙醇洗脫樹脂柱,收集70%乙醇洗脫液,減壓回收乙醇,濃縮物真空干燥得桑枝總黃酮。
2.2 桑枝總黃酮的測定 準確稱取21.5 mg蘆丁置于100 mL量瓶中,用95%乙醇溶解,再用30%乙醇定容至刻度。準確吸取此標準液0、1.0、2.0、3.0、4.0、5.0、6.0 mL 置25 mL 量瓶,分別加30%乙醇至 10 mL,搖勻,加 5%NaNO21.0 mL,搖勻,放置6 min,加10%Al2(NO3)31.0 mL,搖勻,放置6 min,再加1 mol/L NaOH 10 mL,用30%乙醇定容后搖勻,放置15 min,以0管作為空白,于510 nm處測吸收值A,以濃度C對吸光值A回歸,A=2.435 1C-0.002 8,R2=0.998 7。將桑枝總黃酮樣品稀釋一定濃度,精密吸取1 mL于25 mL量瓶,平行3管,分別加30%乙醇至10 mL,以下同標準曲線方法測吸光值A,代入標準曲線方程計算桑枝樣品液的總黃酮量為59.28%。
2.3 桑枝總黃酮的直接抗氧化能力測定
2.3.1 Ferric reduction ability power(FRAP)法245 μL新鮮配制的FRAP溶液,加入5 μL樣品,靜置10 min后,593 nm測定樣品和標準對照Trolox對還原Fe3+的能力。FRAP溶液:0.3 mol/L醋酸鹽緩沖液(pH 3.6)、10 mmol/L TPTZ(溶于 40 mmol/L HCl)和20 mmol/L FeCl3以10∶1∶1(v/v)混合。結果用mmol/L Trolox相對值表示。
2.3.2 DPPH 法 245 μL 0.1 mmol/L DPPH 甲醇溶液中加入5 μL樣品,室溫靜止放置30 min,于517 nm處測定樣品和標準對照Trolox對DPPH自由基的清除能力,結果用mmol/L Trolox相對值表示。
2.3.3 2,2-azinobis-[3-ethylbenzothiazoline-6-sulfonic]acid(ABTS)法 385 μL PBS(5 mmol/L,pH 7.4),加入 50 μL Mb(45 μmol/L)和10 μL 樣品,再加55 μL ABTS(1.8 mmol/L),精確3 min 后,在734 nm測量樣品及標準對照對ABTS的清除能力。結果用mmol/L Trolox相對值表示。
2.4 桑枝總黃酮干預細胞炎癥模型
2.4.1 Griess法考察桑枝總黃酮對巨噬細胞炎癥模型亞硝酸鹽含量的影響 RAW264.7細胞株培養于含體積分數為10%胎牛血清的RPMI 1640培養基中,在37℃和CO25%條件下培養。細胞懸液以每孔1×105個細胞接種于96孔板,培養過夜。桑枝總黃酮以0.1 g/L終濃度預孵育6 h。空白組采用含0.1%DMSO的RMPI 1640培養細胞。模型組采用 LPS(100 μg/L)和 IFN-γ(1 ×104U/L)協同刺激細胞。刺激維持24 h后,吸取96孔板中的培養液100 μL,加入等體積的Griess試劑,室溫反應10 min,用酶標儀讀取540 nm處光吸收值。以亞硝酸鹽標準曲線計算桑枝總黃酮干預后細胞上清液中亞硝酸鹽的含量及其抑制率。
2.4.2 ABTS和FRAP法考察桑枝總黃酮對內皮細胞炎癥模型中抗氧化活性的影響 人臍靜脈內皮細胞培養于含10%胎牛血清的RPMI-1640完全培養基中,于5%CO237℃的培養箱中培養,以0.25%胰蛋白酶消化傳代。終濃度0.1 g/L的桑枝總黃酮和人血管內皮細胞(ECV304)預孵育1 h后加入終濃度為 0.02 μmol/L Ang II,作用 24 h 后,收集細胞蛋白,Lowry法測定細胞蛋白質水平后取蛋白上清液,應用ABTS和FRAP法進行抗氧化檢測,細胞結果以mmol/L Trolox當量/g蛋白表示。
2.5 統計學處理 實驗數據以均數±標準差表示,差異顯著性檢驗采用t檢驗。
3 結果
3.1 桑枝總黃酮的直接抗氧化能力 實驗結果顯示,桑枝總黃酮清除ABTS自由基的能力為0.623個Trolox當量(1 mmol/L Trolox的清除自由基能力),DPPH自由基的能力為0.245個Trolox當量,而對鐵離子的還原能力為0.181個Trolox當量。其中,桑枝總黃酮對ABTS自由基的清除能力>對DPPH自由基的清除能力>對鐵離子的還原能力(見表1)。

表1 桑枝總黃酮的抗氧化能力(mmol/L Trolox當量,n=3)Tab.1 Antioxidants activities of TFMR(m mol/L Trolox equivalent,n=3)
3.2 桑枝總黃酮干預對LPS協同IFN-γ刺激細胞模型中亞硝酸鹽量的影響 桑枝總黃酮干預LPS協同IFN-γ刺激細胞模型后,模型組亞硝酸鹽量顯著增高,較對照組提高了12.948倍(P<0.01),給藥組與模型組相比,亞硝酸鹽量下降了31.405%(P<0.05),抑制率達51.890%(見表2)。

表2 桑枝總黃酮對亞硝酸鹽量的影響(n=6)Tab.2 Nitrite accumulation of TFMR by LPS plus IFN-γ stimulated cell inflammatory model(n=6)
3.3 桑枝總黃酮干預Ang II誘導的細胞炎癥模型 Ang II刺激細胞后,模型組總抗氧化能力和還原能力均下降(P<0.05),桑枝總黃酮干預細胞后,無論采用FRAP法還是ABTS法,細胞蛋白的總抗氧化水平均顯著高于模型組(P<0.05)(見表3)。
4 討論
自由基生物學研究認為眾多疾病如心腦血管疾病、糖尿病、癌癥等與過量的自由基如活性氧/活性氮(ROS/RNS)引起的氧化應激,對DNA、蛋白質及生物膜產生損傷密切有關。炎癥是以上疾病共有的病理機制,其發生發展過程中存在著氧化應激[4]。Ang II能引起血管壁的炎癥反應,用血管緊張素-轉換酶抑制劑(ACEIs)和Ang II拮抗劑等對腎素-血管緊張素系統進行阻斷,可減少血管炎性細胞。LPS協同IFN-γ是經典的炎癥刺激物,對巨噬細胞的誘導炎癥模型已廣泛應用于炎癥性疾病的分子病理機制的研究。
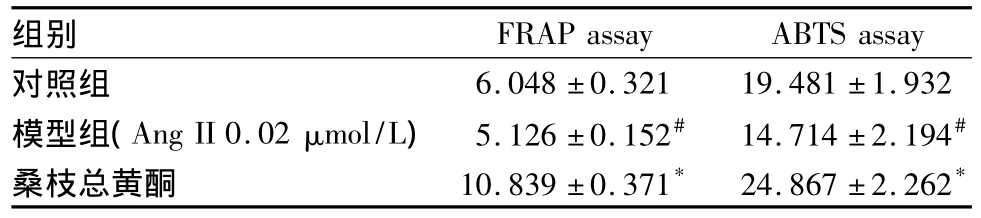
表3 桑枝總黃酮在Ang II模型中的抗氧化能力(mmol/L Trolox當量/g蛋白,n=3)Tab.3 Antioxidant capacity of TFMR by AngII stimulated cell inflammatory model(mol/L Trolox/g protein,n=3)
自由基的清除是抗氧化劑發揮抗氧化作用的主要機制[5]。ABTS法和DPPH法都是檢測樣品對自由基的清除能力,當ABTS由過硫酸銨氧化產生ABTS·+自由基,它與ferryl-肌紅蛋白在734 nm處形成相對穩定的藍綠色發色基團,當有抗氧化劑和氫供體存在時,抑制發色基團形成,抑制程度取決于樣品的抗氧化活性和濃度[6]。DPPH法利用了抗氧化劑清除DPPH·時與其孤對電子配對而使其在517 nm處的吸光值降低的原理[7]。而FRAP法基于氧化還原反應的比色法,在酸性條件下三價鐵被抗氧化劑還原成二價鐵在593 nm處有強吸收,從而檢測抗氧化劑的還原能力[8]。Griess法是利用檢測試劑與自由基一氧化氮的穩定產物亞硝酸鹽形成的紫紅色物質在540 nm處有強吸收來檢測樣本對亞硝酸鹽的清除能力[9]。Trolox是一種類似于VE的水溶性物質,常常作為自由基反應的參比物,評價被測樣品的總抗氧化能力及被測樣品間的橫向比較。
本實驗采用了細胞學實驗和體外化學實驗相結合的方法綜合評價桑枝總黃酮的抗氧化活性。桑枝總黃酮顯示較強的自由基清除能力,且對ABTS自由基的清除能力優于DPPH自由基的清除能力,具有良好的還原能力。在細胞炎癥模型中對ABTS自由基的清除能力優于對鐵離子的還原能力,并能清除亞硝酸鹽。對桑枝總黃酮的抗氧化能力檢測提示其作用機制側重于清除自由基能力。
桑枝總黃酮作為天然抗氧化劑提高細胞清除自由基能力,在抗氧化、對抗衰老及防癌方面具有一定的作用,作為抗氧化藥物具有進一步開發的價值。
[1]國家藥典委員會.中華人民共和國藥典:2010年版一部[S].北京:中國醫藥科技出版社,2010:280.
[2]廖森泰,何雪梅,鄒宇曉,等.廣東桑枝條黃酮含測定及抗氧化活性研究[J].北方蠶業,2005,26(106):37-38.
[3]馬永雷,張雨青,周麗霞,等.桑枝皮醇提物的抗氧化和對α-糖苷酶活性的抑制作用[J].蠶業科學,2010,36(1):143-147.
[4]Bian K,Ke Y,Kamisaki Y,et al.Proteomic modification by nitric oxide[J].J Pharmacol Sci,2006,101(4):271-279.
[5]劉志東,郭本恒,王蔭榆.抗氧化活性檢測方法的研究進展[J].天然產物研究與開發,2008,20:563-567.
[6]Said T M,Kattal N,Sharma R K,et al.Enhanced Chemiluminescence AssayvsColorimetric Assay for Measurement of the Total Antioxidant Capacity of Human Seminal Plasma[J].J Androl.2003,24(5):676-680.
[7]Gorinstein S,Martin-Belloso O,Katrich E,et al.Comparison of the contents of the main biochemical compounds and the antioxidant activity of some Spanish olive oils as determined by four different radical scavenging tests[J].J Nutr Biochem,2003,14(3):154-159.
[8]Boxin O,Dejian H,Maureen H W,et al.Analysis of Antioxidant Activities of Common Vegetables Employing Oxygen Radical Absorbance Capacity(ORAC)and Ferric Reducing Antioxidant Power(FRAP)Assays:A Comparative Study[J].J Agric Food Chem,2002,50(11):3122-3128.
[9]Hong C H,Hur S K,Oh O J,et al.Evaluation of natural products on inhibition of inducible cyclooxygenase(COX-2)and nitric oxide synthase(iNOS)in cultured mouse macrophage cells[J].J Ethnopharmacol,2002,83(1-2):153-159.

