體外誘導分化的多能成體祖細胞移植到帕金森病大鼠模型后的形態學觀察
周輝,盛漢松,張弩,林堅,尹波
(溫州醫學院附屬第二醫院 神經外科,浙江 溫州 325027)
帕金森病(Parkinson’s disease,PD)是一種常見的神經系統變性疾病,以中腦黑質多巴胺能神經元變性壞死和紋狀體區多巴胺(DA)水平減少為主要病理生理特點[1]。多能成體祖細胞(MAPCs)的許多特性也使其逐漸成為了細胞移植治療中理想的細胞資源之一。有研究表明,骨髓間質MAPCs在體外培養環境中能夠增殖并可以分化為各種譜系的細胞,如神經細胞等[2-4]。本實驗將體外純化、標記處理的骨髓間質MAPCs移植到PD大鼠腦內,觀察MAPCs的腦內存活和神經分化情況,對移植大鼠采用免疫組化技術、免疫電鏡等方法鑒定和分析MAPCs在大鼠腦組織內神經元樣細胞分化的形態學,分析MAPCs神經元樣細胞分化和修復神經功能的可能作用機制。
1 材料和方法
1.1 材料
1.1.1 動物:成年SD大鼠,雌雄各半,體質量80~100 g 4只(用于提取骨髓)和體質量180~200 g 70只(用于建立PD大鼠模型),由華中科技大學同濟醫學院實驗動物中心提供。實驗過程中對動物的處置符合動物倫理學標準。經行為學測試確認無震顫、嗅探及旋轉等異常行為后,將動物置于鼠箱內,給予充足的水和飼料。
1.1.2 實驗試劑:低糖的Dulbecco改良eagle培養基(L-DMEM,GIBCOBRL公司),胎牛血清(FCS,Hyclone公司),100 ng/mL LIF,Ficoll-paque液(Ficoll-paque density gradient centrifugation,Sigma公司);Buffer液(Miltenyi Biotec公司);堿性成纖維細胞生長因子(bFGF)、腦源性神經營養因子(BDNF)、成纖維細胞生長因子-8(FGF-8)、Triton X-100 液、鼠單克隆抗體(NSE和MAP-2)、羅達明標記的羊抗鼠抗體(Rhodamine-labeled affinity purified antibody to mouse IgG)、熒光素標記的羊抗鼠抗體(fluorescein-labeled affinity purified antibody to mouse IgG)購自Sigma公司;青霉素、鏈霉素、胰蛋白酶(GIBCOBRL公司);氯化氨、碳酸氫鈉、肝素、PBS、多聚甲醛、二甲苯、乙醇等。
1.1.3 主要儀器:細胞培養皿、細胞培養瓶、細胞培養板購于晶美生物工程有限公司;微量加樣器(上海高欣玻璃儀器廠);Olympus倒置顯微鏡(日本);Nikon熒光顯微攝像系統(日本);透射電鏡(EM-10C型,德國Opton公司);細胞培養箱;低溫超速離心機(XL-100型,美國Deckman公司);CD45-Gly-A-cell isolation kit、MACS高強磁場、MACS陰性選擇柱(Miltenyi Biotec公司);腦立體定位儀(西北光學儀器廠)等。
1.2 方法
1.2.1 建立PD大鼠模型:健康SD大鼠用水合氯醛(400 mg/kg)腹腔注射麻醉。參照Paxinos and Watson《The Rat Brain》圖譜,選擇黑質致密部(SNpc,坐標:前囟后4.8 mm,中逢左旁開2.0 mm,硬膜下8.0 mm)和中腦被蓋部腹側區(VTA,坐標:前囟后4.8 mm,中逢左旁開1.2 mm,硬膜下8.2 mm)為注射點,每點注射6-羥多巴(6-OHDA)4μL(2 μg/μL, Sigma)。14 d后,大鼠腹腔注射阿樸嗎啡(1 mg/kg,Sigma)后,誘發大鼠產生向左旋轉行為,記錄30 min內的旋轉圈數,恒定向左轉,轉速≥210 r/30 min定為成功的PD模型。行為學檢測成功的PD模型60只(其中6只大鼠未達到PD模型的要求,4只在手術過程中死亡)被選擇用于移植研究。
1.2.2 MAPCs的分離、培養:參考Snykers等[5]的方法獲取骨髓有核細胞。將分離出的骨髓有核細胞用標準Buffer液制成細胞懸液分離MAPCs,使用CD45-Gly-A-磁珠分離法,具體步驟參考其使用手冊。將分離出的CD45-Gly-A-細胞接種到細胞培養六孔板內,接種密度為5~10×103個CD45-Gly-A-細胞/mL,置于37 ℃、5% CO2飽和濕度的培養箱內培養,培養基為含10% FCS、100 ng/mL LIF、100 U青霉素/mL和100 U鏈霉素/mL的L-DMEM。在第12天時向培養液中加入5μmol/L 5-溴-2-脫氧尿核苷(BrdUrd)。培養14 d后,培養細胞用0.25%胰酶室溫消化5 min,用PBS沖洗3次后制成細胞懸液。
1.2.3 動物分組與處理:PD大鼠隨機分為對照組(n=30)和MAPCs組(n=30)。MAPCs組:PD大鼠經10%水合氯醛5 mL/kg腹腔注射麻醉后,固定于腦立體定位儀,手術方法同PD模型制備,選取左側紋狀體2個坐標點(前囟后0.6 mm,矢狀縫右側4.0 mm,硬膜下5.0 mm)和(前囟前0.7 mm,矢狀縫右側3.0 mm,硬膜下5.0 mm),各注入制備的MAPCs懸液5μL(即每只鼠共移植2×105個細胞,注射速度為0.5μL/min,注射完畢留針(5 min),術后用牙科乳膠覆蓋鉆孔,縫合皮膚、筋膜,常規消毒。術后大鼠包被保暖清醒后置籠喂養,注意補水,并連續1周腹腔注射青霉素3萬U/d預防感染。對照組:操作過程與MAPCs組相同,在腦內注射磷酸鹽緩沖液兩處各5μL。
1.2.4 免疫組織化學染色:3個月后用4%多聚甲醛經心臟灌注固定大鼠,方法為:用水合氯醛(400 mg/kg)腹腔注射麻醉大鼠,剪開胸壁,暴露心臟,經升主動脈插管,用少量0.9%氯化鈉溶液(內含0.01%的肝素)沖洗血管,隨即用冰冷的4%多聚甲醛灌注,灌注壓力略高于大鼠的收縮壓,即輸液瓶的液面距大鼠心臟約高1 m,灌注量為400~800 mL,1 h內灌注完成,灌注后將取出的腦組織置于4%的多聚甲醛后固定3 h,經0.9%氯化鈉溶液洗滌后在70%酒精中過夜,次日經升度酒精脫水(80%、90%、95%酒精各30 min,100%酒精30 min×2次),以損傷側的黑質和紋狀體為中心制成標準石蠟包埋塊。然后在切片機上連續切成5μm厚的冠狀切片。切片用相應的熒光染料染色后,在免疫熒光和共聚焦顯微鏡下識別MAPCs起源的細胞。染色步驟:石蠟切片經脫蠟處理后,在0.1% Triton X-100中孵育,室溫10 min;5%的羊血清孵育,室溫30 min;在I抗(NSE 1:500、BrdUrd 1:300或TH 1:200)中孵育,置于冰箱內(4 ℃)濕盒中24 h;隨后在II抗(rhodamine、fluores-cein或CY2標記的羊抗鼠IgG 1:100)中孵育1 h;上述每一步后均用PBS徹底洗滌(10 min×2次),成色反應完成后經PBS洗滌、脫水、透明和封片。
1.2.5 免疫電鏡染色:采用上述方法用4%多聚甲醛經心臟灌注固定大鼠,分離損傷側的黑質和紋狀體并置于2.5%戊二醛緩沖固定液中,預固定5~10 min,待組織稍變硬后改為1 mm3大小,然后按以下步驟進行:2.5%戊二醛緩沖固定液固定2h→0.1 mol/L PBS洗滌(20 min×2次)→振動切片→ABC法染色→1%鋨酸后固定30~120 min→0.1 mol/L PBS洗滌→按50%、70%、90%乙醇、90%乙醇丙酮→90%、100%丙酮(5 min×2次)梯度脫水→丙酮和環氧樹脂1:1混合液浸透2 h→純環氧樹脂包埋劑浸透2 h→包埋→聚合(80 ℃恒溫箱內10 h)→修塊→超薄切片→染色(醋酸雙氧鈾、枸櫞酸鋁雙重染色各10 min)→透射電子顯微鏡觀察。
2 結果
2.1 MAPCs的體外培養 體外培養的CD45-GLY-A-細胞在14 d左右出現“集落樣”生長,細胞形態一致,成“類纖維樣細胞”形態。
2.2 MAPCs腦內存活 MAPCs經大鼠紋狀體定向注射3個月后。MAPCs移植組大鼠,免疫熒光雙重標記顯示損傷側黑質和紋狀體區部分MAPCs分化為神經元樣細胞(MAPCs標記物BrdUrd染色陽性,綠色;神經細胞標記物NSE染色陽性,紅色)(圖1A)。MAPCs移植組大鼠,免疫熒光雙重標記顯示損傷側黑質和紋狀體區部分MAPCs分化為多巴胺能神經元(MAPCs標記物BrdUrd染色陽性,綠色;多巴胺能神經元標記物TH染色陽性,藍色)(圖1B)。對照組大鼠損傷側腦組織未發現BrdUrd染色陽性細胞,神經細胞標記物NSE染色陽性(圖1C)。對照組大鼠損傷側腦組織未發現BrdUrd染色陽性細胞,多巴胺能神經元標記物TH染色陽性(圖1D)。
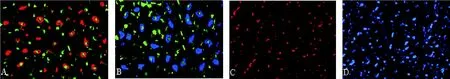
圖1 MAPCs(5×106)移植入6-羥多巴誘導的PD大鼠體內3個月后腦組織的免疫熒光染色分析(A.×200;B.×200;C.×100;D.×100)
2.3 免疫電鏡染色 電鏡下,在黑質和紋狀體區可觀察到MAPCs來源的神經細胞與其他神經細胞形成了突觸聯系(圖2A-D)。
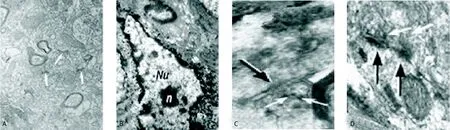
圖2 移植側黑質和紋狀體區MAPCs分化的TH陽性細胞的超微結構(A.×1000;B-D.×10000)
3 討論
PD為中樞神經系統一種常見的退行性疾病,以中腦黑質多巴胺能神經元漸進性變性壞死及其支配的紋狀體內多巴胺能神經遞質匱乏為病理特征[6]。在PD的治療中,藥物治療有不良反應,且5~10年后療效明顯下降[7]。現有的常規治療手段無法阻止多巴胺能神經元的繼續喪失。細胞移植有望補充和替代PD患者腦中喪失的多巴胺能神經元。相繼有胎腦黑質組織[8]、腎上腺髓質[9]、神經干細胞[10]、ES細胞[11]移植治療PD的報道。但由于取材困難、來源不足、倫理限制、免疫排斥、體外增殖能力差或神經分化效率低等方面的問題而阻礙這些細胞移植治療在臨床上的廣泛應用,因此,尋找最佳的移植細胞就成了醫學界在干細胞研究方面的重點之一。 骨髓基質細胞(BMSCs)由于取材簡單、體外增殖能力強、神經分化效率高、自體移植不受倫理學和免疫排斥的限制等優點而成了目前干細胞研究領域的熱點[12-14],作為BMSCs的亞群細胞之一,MAPCs更具有無以比擬的優點而受到醫學界的極大關注[15]。
本研究中,MAPCs經立體定向移植大鼠患側紋狀體后,可以在腦組織局部較長時間內存活,并在黑質和紋狀體區富集并高效率地分化為多巴胺能神經元;這些資料表明MAPCs分化的多巴胺能神經元能與腦組織相整合,替代受損的神經細胞,使受損的神經環路得以重建。電鏡觀察中,我們發現MAPCs分化的部分TH+細胞伸出突起并與其他神經細胞建立了突觸聯系。當然,神經細胞分化或神經環路的重建并非神經功能恢復的先決條件之一,我們認為更為合理的解釋是MAPCs與宿主腦組織的相互作用導致了某些營養因子的分泌,而這些因子正是神經功能缺損得以恢復的主要原因。不過,細胞環路重建以及細胞間的電生理變化也是一個重要的原因,我們將就移植細胞和宿主細胞間的直接電生理變化關系進行進一步研究。
相對于其他已知的干細胞,MAPCs來源豐富、取材簡單、容易分離純化培養,在合適的培養條件下體外擴增能力強,可達100代以上,細胞不發生分化和衰退。從PD病人骨髓來源的MAPCs經實驗證實與正常MAPCs具有相似的形態和分化能力,分化成多巴胺能細胞的能力沒有下降[16],同時MAPCs也適合作為基因治療載體[17],攜帶酪氨酸羥化酶(TH)基因的MAPCs可以在腦內產生更高濃度的多巴胺。 MAPCs具有與胚胎干細胞相似的特性,同時又克服了倫理學的限制,可為干細胞臨床應用研究的突破帶來希望。
[1] Fathi F, Altiraihi T, Mowla SJ, et al. Transplantation of retinoic acid treated murine embryonic stem cells &behavioural deficit in Parkinsonian rats[J]. Indian J Med Res,2010,131(4):536-544.
[2] Reyes M, Lund T, Lenvik T, et al. Purification and ex vivo expansion of postnatal human marrow mesodermal progenitor cells[J]. Blood,2001,98(9):2615-2625.
[3] Jiang Y, Jahagirdar BN, Reinhardt RL, et al. Pluripotency of mesenchymal stem cells derived from adult marrow[J].Nature,2002,418(6893):41-49.
[4] Highfill SL, Kelly RM, O’Shaughnessy MJ, et al. Multipotent adult progenitor cells can suppress graft-versus-host disease via prostaglandin E2 synthesis and only if localized to sites of allopriming[J]. Blood,2009,114(3):693.
[5] Snykers S, Vanhaecke T, Rogiers V. Isolation of rat bone marrow stem cells[J]. Methods Mol Biol, 2006, 320:265-272.
[6] May TS. Transplantation of embryonic stem cells in Parkinson’s disease[J]. Lancet Neurol,2002,1(1):6.
[7] Grove JE, Bruscia E, Krause DS. Plasticity of Bone Marrow-Derived Stem Cells[J]. Stem Cells,2004,22(4):487-500.
[8] Dezawa M, Kanno H, Hoshino M, et al. Specific induction of neuronal cells from bone marrow stromal cells and application for autologous transplantation[J]. J Clin Invest, 2004,113(12):1701-1710.
[9] Weissman I L. Translating stem and progenitor cell biology to the clinic: barriers and opportunities[J]. Science,2000,287(5457):1442-1446.
[10] 盛漢松, 張弩, 林逢春, 等. 全反式維甲酸誘導中腦神經干細胞向多巴胺能神經元分化的作用[J].溫州醫學院學報,2011,41(1): 6-9.
[11] Mezey E, Chandross KJ, Harta G, et al. Turning blood into brain: cells bearing neuronal antigens generated in vivo from bone marrow[J]. Science,2000,290(5497):1779-1782.
[12] Haynesworth SE, Baber MA, Caplan AI. Cytokine expression by human marrow-derived mesenchymal progenitor cells in vitro: effects of dexamethasone and IL-1 alpha[J]. J Cell Physiol,1996,166(3):585-592.
[13] Brazelton TR, Rossi FM, Keshet GI, et al. From marrow to brain: expression of neuronal phenotypes in adult mice[J].Science,2000,290(5497):1775-1779.
[14] Kim S, Honmou O, Kato K, et al. Neural differentiation potential of peripheral blood-and bone-marrow-derived precursor cells[J]. Brain research,2006,1123(1):27-33.
[15]Storch A, Paul G, Csete M, et al. Long-term proliferation and dopaminergic differentiation of human mesencephalic neural precursor cells[J]. Exp Neurol, 2001,170(2):317-325.
[16] Zhang Z, Wang X, Wang S. Isolation and characterization of mesenchymal stem cells derived from bone marrow of patients with Parkinson’s disease[J]. In Vitro Cell Dev Biol Anim,2008,44(5-6):169-177.
[17] Lu L, Zhao C, Liu Y, et al. Therapeutic benefit of TH-engineered mesenchymal stem cells for Parkinson’s disease[J]. Brain Res Brain Res Protoc,2005,15(1):46-51.

