紅松多酚抗氧化實驗研究
贠可力,王振宇,2*
(1.哈爾濱工業大學 食品科學與工程學院,哈爾濱 150090;2.東北林業大學 林學院,哈爾濱 150040)
紅松(Pinus koraiensis),亦稱海松或者果松。常 綠喬木,高達40m。其葉五針一束,長6~12cm。紅松種子長1.2~1.6cm,子葉13~16枚。球果卵狀圓錐形,種子大而無翅。紅松是我國東北地區重要的松屬樹種,分布于我國東北長白山至小興安嶺地區,常與紅皮云杉及魚鱗松等組成混交林。耐旱性強,喜微酸性或中性土壤,針葉及球果中含有抗氧化活性成分,種子可食,入藥后具有祛風除濕、滋養補虛輕身延年的功效。近年來,天然抗氧化劑的研究受到廣泛關注,其中多酚類是主要的抗氧化活性成分之一。自由基引起的疾病有80多種,因而自由基清除劑對于人類健康有重要意義。
1 材料與方法
1.1 實驗材料
紅松樹皮于2009年得自伊春林業局林區附近的木材加工廠的廢棄樹皮。
1.2 實驗儀器
高速萬能粉碎機,電子天平,恒溫水浴鍋,北京醫療電子儀器廠。T6新世紀紫外分光光度計,電熱恒溫水浴鍋,GL-16G-C型高速冷凍離心機,DF-110型電子分析天平。精密pH計,R-205B旋轉蒸發儀,KQ-5200超聲波儀。
1.3 試驗試劑
沒食子酸,Folin酚試劑,無水碳酸鈉,無水乙醇,濃硫酸,鹽酸均為分析純。三羥甲基氨基甲烷(Tris堿)(Sigma公司)、1,1-二苯基苦基苯肼(DPPH)(Aldrich公司);抗壞血酸、硫酸亞鐵 (FeSO4)、鄰二氮菲、2-硫代巴比妥酸 (TBA)、30%過氧化氫、三氯乙酸 (TCA)、鄰苯三酚、鐵氰化鉀K3Fe(CN)6、沒食子酸、福林試劑、碳酸鈉、濃鹽酸、磷酸一氫鈉、磷酸氫二鈉均為國產分析純。
1.4 實驗方法
1.4.1 紅松多酚提取方法
將紅松樹樹皮用告訴組織到隨機搗碎,過60目篩,用電子天平稱取松樹皮粉末100g,加入2000mL冷凍的60%丙酮(1∶20w/v),在超聲功率為100%,超聲溫度為50℃條件下提取40min,,在轉速為3500r/min下離心6min,濾紙放在抽濾瓶上抽濾,以上過程重復4次。收集濾液置于旋轉蒸發儀中,在45℃旋轉蒸發至約15%的提取液,將其轉移至容量瓶,用去離子水調節到終體積為400mL,制備10份樣品,分別取出l0mL混勻作為一份混合樣品,于-80℃儲存,用于后續抗氧化和抗輻射試驗。
1.4.2 多酚標準曲線的制作
采用Folin-ciocalteu比色法檢測多酚含量并做了一些修改[1]。用1mL的蒸餾水溶解0.05g沒食子酸,定容至10mL,分別移取0、0.1、0.2、0.3、0.5、0.7mL到10mL的試管中,定容。從上述不同濃度的標準液中分別移取0.1mL到10mL的試管中,分別加入6mL水,混合后加入0.5mL Folin-ciocalteu試劑混合,在0.5~8min內加入1.5mL的20%碳酸鈉溶液,用水定容,將上述標準溶液在20℃放置2h后,在波長765nm下測定吸光值,繪制標準曲線。
1.4.3 多酚含量的測定
準確稱取提取液0.1mL于10mL試管中,按照上述標準曲線測定方法在765nm下測定其吸光值,從上述標準曲線計算相應的總多酚含量,按照以下公式換算總酚含量(以沒食子酸得當量值表示)。按上述步驟操作,吸光度為Y軸,濃度為x軸繪制標準曲線,單位是:“mg沒食子酸等同量/mL”。按檢測流程操作,讀取樣品的吸光度值,帶入回歸方程計算樣品待測液中總多酚含量。每100g樣品中總多酚含量按下式計算:X=m1v2/mv1×100。
綜上可見,敦煌文獻數據庫的建設隨著計算機技術和數字化技術的發展而方興未艾,但已取得了顯著的成績,在文獻保護和研究方面做出了巨大貢獻。但通過調研也發現,敦煌數據庫的建設尚缺乏系統理論語言學原則指導下建立的、面向敦煌文獻語言文字研究而創建的深加工研究型語料庫。現有的敦煌文獻電子化、數字化工作取得的顯著成果,為建設這種深加工多模態語料庫提供了有利條件。
式中:X-樣品中總多酚含量:m1-根據標準曲線或回歸方程計算出待測液中總多酚的含量;m-樣品質量:v1-樣品提取液測定用體積;v2-樣品提取液總體積。
標準曲線的檢測結果(見圖1)

圖1 沒食子酸標準曲線
以吸光度A(y)值為縱坐標,濃度(x,μg/mL)為橫坐標,用最小二乘法進行線性回歸,得到回歸方程:y=0.17569x-0.0025,其中x單位為μg/mL,R2=0.99977
最后測定的多酚含量為:從100g樹皮中共獲得了166.32mg總多酚,相當于松樹皮中含量為1.663mg/g。
1.4.2 單花青素含量分析測定
單節花青素含量用pH示差分光光度法。提取物用0.025M,pH1的氯化鉀緩沖液以1∶3或1∶8的提取物與緩沖液比例混合,在515nm和700nm處測定吸光度,以蒸餾水為空白比色。提取物用pH4.5乙酸鈉緩沖液混合,這些溶液在同樣的波長下測定。花青素的含量用下式計算。總單花青素(mg/100g鮮果皮)=A×MW×1000(E×C)。
式中 A:吸光率(A515- A700)pH 1.0- (A515- A700)pH 4.5;MW:449.2花色苷3-糖配基的分子量;E:26900花色苷3-糖配基的摩爾吸光率;C:每毫升每毫克緩沖溶液的濃度。每100g鮮果皮中花色苷的含量用花色苷3-糖配基的毫克數表示。紅松樹皮中單花青素含量測定結果:164.22mg/100g樹皮。
1.4.4 清除 DPPH 自由基試驗[2]
(1)準確稱取0.1g粗提取物與各個濃度的乙醇洗脫物,分別用95%、50%的乙醇在超聲條件下幫助溶解,制成1mg/mL 的母液,分別吸取10、20、40、80、160、320、640μL,用50% 的乙醇溶液定容至5mL,分別加入500μL 0.375mmol/L的DPPH溶液,在水25℃水浴中20min,在517nm下測定吸光值Ai。
(2)分別吸取10、20、40、80、160、320、640μL,用50% 的乙醇溶液定容至2mL,在水25℃水浴中20min,在517nm下測定吸光值Aj。
(3)吸取0.5mLDPPH 溶液,加入2.5mL 50% 的乙醇溶液,在水25℃水浴中20min,測定在517nm下測定吸光值Ao。
1.4.5 清除 ABTS自由基試驗[3]
將7mmol/L ABTS和2.45mmol/L的過硫酸鉀(終濃度)混合,在室溫避光條件下靜置過夜,將生成的ABTS溶液用水稀釋,使其在30℃,734nm波長下的吸光度為0.7±0.02,即得到ABTS工作液。分別吸取5、10、20、40、80、160μL的濃度為2mg/mL的大孔樹脂富集的20%~60%乙醇洗脫物于10mL比色管中,用50%乙醇定容至200μL。再加入1.5mL的ABTS溶液,空白管用蒸餾水代替提取液,對照管用蒸餾水代替ABTS工作液,并做重復試驗,室溫避光放置1h,于波長734nm下測定其吸光度。并用VC作對照。ABTS自由基清除率(%)=[A空白-(A樣品-A對照)]/A空白×100%。
2 結果與分析
2.1 洗脫物質對DPPH自由基的清除作用

圖2 分級洗脫物質的DPPH清除作用
不同洗脫物對DPPH都具有清除作用,其作用在低濃度條件下呈現出很好的計量反應關系,幾乎為線性,但當濃度上升至125μg/mL時,清除曲線趨于平緩,說明隨著各種洗脫物質的濃度增加對于清除此種自由基的能力量效關系不再明顯。其結果如圖2。
2.2 洗脫物質對DPPH自由基的清除作用
不同洗脫物對DPPH都具有清除作用,其作用在低濃度條件下呈現出很好的計量反應關系,幾乎為線性,但當濃度上升至40μg/mL時,清除曲線趨于平緩,說明隨著各種洗脫物質的濃度增加對于清除此種自由基的能力量效關系不再明顯。清除效果最好的時40%乙醇洗脫物。其結果如圖3。
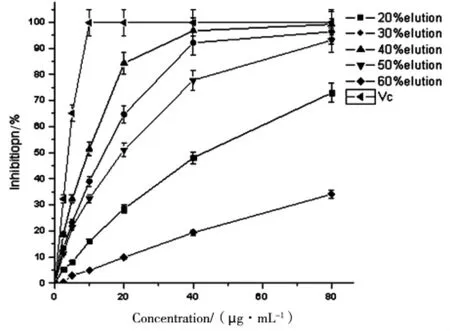
圖3 分級洗脫物質的ABTS清除作用
3 結論
由這些結果可以看出,大孔樹脂富集物不同濃度洗脫物對于兩種穩定的非生理性自由基由顯著的清除作用,有待于進一步研究其機制。
[1]Jie Sun,Yi-Fang Chu,Xianzhong Wu,et al.Antioxidant and Antiproliferative Activities of Common Fruits[J].Journal of Agricultural and Food Chemistry,2002,50(25):7449-7454.
[2]Chanjirakul K,Wang SY,Wang CY,et al.Natural volatile treatments increase free-radical scavenging capacity of strawberries and blackberries[J].Journal of the Science of Food and Agricultural,2007,87(8):1463-1472.
[3]Re,R.,Pellegrini,N.,Proteggente,A.,et al.Antioxidant activity applying an improved ABTS radical cation decolorization assay[J].Free Radical Biology and Medicine,1998,72:1231-1237.

