異鉤藤堿對脂多糖誘導的星形膠質細胞炎性介質釋放的抑制作用
宋 宇,劉繼平,石富國,蘭 洲,厲璐帆,馬世平
中國藥科大學中藥藥理教研室
各種腦血管病變引起的中樞缺血性疾病是現代社會危害中老年人健康的重要疾病,具有發病率高、致殘率高和死亡率高的特點。因此探索腦缺血的病理機制及尋找有效的治療藥物具有重要的學術價值和社會意義。星形膠質細胞作為中樞神經系統的免疫吞噬細胞,在腦缺血及缺血再灌注后,被各種致炎因素激活成反應性星形膠質細胞。激活的星形膠質細胞釋放多種炎性介質,如白介素-1β(interleukine-1β,IL-1β)、白介素-6(interleukine-6,IL-6)、腫瘤壞死因子-α(TNF-α)、一氧化氮(nitric oxide,NO)及前列腺素 E2(prostaglandin E2,PGE2)等[1]。 這些炎癥介質可以進一步激活周圍的膠質細胞,導致突觸消失,神經元凋亡或壞死,形成二次損傷[2]。因此抑制星形膠質細胞過度的激活和炎性介質的大量釋放有助于保護神經元,在腦缺血治療中具有重要意義。
鉤藤是茜草科植物鉤藤(Uncaria rhynchophylla Jacks)及其同屬植物的帶鉤莖枝,有清熱平肝、息風定驚的功效,臨床用于治療癲癇、驚厥和高血壓等病[3]。目前已從鉤藤中分離出30多種化合物,異鉤藤堿(isorhynchophylline,IRN,圖 1)是其中的一種具有多種藥理活性的成分,早期的研究主要集中于異鉤藤堿的降壓、抗心律失常作用[4-5]。近年來,鉤藤提取物和異鉤藤堿都顯示出抗中樞缺血再灌注損傷作用,很多研究指出,異鉤藤堿可以降低興奮性神經遞質谷氨酸誘導的神經元凋亡和損傷。進一步研究還表明,異鉤藤堿可以抑制脂多糖(lipopolysaccharide,LPS)誘導的小膠質細胞的激活和炎性因子的釋放[6]。然而異鉤藤堿對于激活的星形膠質細胞的作用目前還不清楚。
本實驗用LPS刺激星形膠質細胞模擬腦內炎性環境,觀察不同濃度的異鉤藤堿對IL-1β和TNF-α釋放的抑制作用,以及異鉤藤堿對iNOS mRNA表達水平的影響,初步探索異鉤藤堿發揮抗炎作用的分子機制。
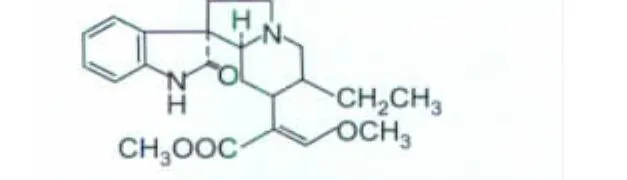
圖1 異鉤藤堿的結構式
1 材 料
1.1 試劑
異鉤藤堿(廣西中醫藥研究所,純度:97.8%);DMEM 培養基干粉(Gibco,批號:31800-014);小牛血清(Gibco,批號:16010-159);注射用青霉素鈉、注射用硫酸鏈霉素 (山東魯抗辰欣藥業有限公司);胰蛋白酶(1:250)(Typsin,南京大治生物技術有限公司);一抗:大鼠抗人膠質纖維酸性蛋白單克隆抗體(GFAP,武漢博士德生物工程有限公司);一氧化氮測試試劑盒 (南京建成生物工程研究所);IL-1β和TNF-α 的 ELISA 試劑盒(Santa Cruz)。
1.2 儀器
CO2培養箱 (TEHER)、倒置顯微鏡 (PM-6 Olympus);Mini-REPOTEAN 電 泳槽 (Bio-Red 公司);TGL-16G高速冷凍離心機 (日本日立公司);DYY-Ⅲ型電轉移槽(北京六一儀器廠);Biocell2010酶標儀(Anthos Labtec Instruments公司)。
1.3 動物
新生1天的Sprague Dawley大鼠 (上海西普爾-必凱實驗動物有限公司),許可證號:SCXZ(滬)2008-0016。
2 方法與結果
2.1 新生大鼠腦皮質星形膠質細胞的分離、培養與純度鑒定
根據參考文獻[7],在無菌條件下取新生SD鼠大腦皮質,去除血污,仔細剝除腦膜和血管,然后將其剪碎成小塊(<1 mm3),加入0.125%的胰酶消化15 min,并輕輕吹打制成單細胞懸液。移入離心管,加入適量的含20%血清的DMEM培養基中止消化。200目篩網過濾,1000 r·min-1離心 8 min,吸棄上層,然后加入適量含20%血清的DMEM培養基,制成單細胞懸液,調整細胞密度至 2×105·mL-1,并將其接種至玻璃培養瓶中,于37℃、5%CO2培養箱中孵育30 min;翻轉培養瓶吸出瓶中的細胞懸液,放入另一個培養瓶內,同法,再差速貼壁一次,將濾液接種至塑料培養瓶中,接種密度約1×105·mL-1。次日換液,去除未貼壁的活力差及死亡細胞,繼續培養9~12d,培養液顏色略變黃時換液,每次換液稍加振搖,12d開始每4d傳一代,共傳三次,每次傳代均差速貼壁0.5h。
將傳至4代的星形膠質細胞按照1×105·mL-1接種至多聚賴氨酸包被的蓋玻片上,放入培養箱中培養2~3d后,取出蓋玻片,進行GFAP免疫組化鑒定,結果表明本實驗所使用星形膠質細胞純度>95%。
2.2 實驗分組、藥物處理及數據分析
待細胞長至80%融合度時,以1×105密度接種于96孔板或6孔板。細胞培養48h后,吸去原培養液,用無糖Earle’s液清洗1遍,同時加入含有LPS或含有LPS與異鉤藤堿的無糖培養基進行處理,細胞處理后分為空白組;LPS(1μg·mL-1)處理模型組;LPS+IRN 3μg·mL-1組;LPS+IRN 10μg·mL-1組;LPS+IRN 30μg·mL-1組。 孵育 24 h。 吸取細胞培養上清液并收集細胞,用于實驗檢測。
2.3 IRN對細胞活力的影響
將分組培養處理后的96孔板,加入20μL的MTT(5 g·L-1)37℃繼續孵育 4 h,棄去上清液,每孔加入150μL二甲亞砜,振蕩10 min,以波長520 nm于酶標儀上測吸光度值。以空白對照組吸光度值均數為100%,計算細胞存活率。各孔細胞存活率(%)=(各組吸光度值/空白組吸光度值均數)×100%。
如表1所示,與空白對照組相比,LPS刺激并未明顯的改變星形膠質細胞的活力,異鉤藤堿不同濃度單獨處理或與LPS共同孵育都未能明顯的改變星形膠質細胞的活力。
表1 IRN對星形膠質細胞活力的影響(,n=6)

表1 IRN對星形膠質細胞活力的影響(,n=6)
2.4 細胞培養上清液中NO含量的測定
藥物處理后,收集細胞上清液,1500 r·min-1,4℃離心10 min。根據Griess法測定培養液中NO的含量[8]。具體測定方法按試劑盒說明書進行操作。
與空白對照組相比,LPS刺激顯著地升高了星形膠質細胞培養基中NO的含量,如表2所示,IRN可以劑量依賴地降低培養基中NO的水平,與LPS組相比,IRN 30μg·mL-1孵育可以顯著地降低星形膠質細胞的炎性介質NO釋放。
表2 IRN對LPS誘導星形膠質細胞NO釋放的抑制作用(,n=6)

表2 IRN對LPS誘導星形膠質細胞NO釋放的抑制作用(,n=6)
注:##p<0.01 vs空白組,*p<0.05 vs LPS 組
2.5 PCR檢測星形膠質細胞中iNOS mRNA的含量
藥物處理后,用PBS洗滌細胞,按Trizol試劑盒說明書提取細胞總RNA。然后采用隨機引物,參照逆轉錄酶MMLV說明書方法進行逆轉錄,取逆轉錄產物進行PCR。引物核苷酸序列分別為iNOS引物序列:sense,5’-AGAGAGATCCGGTTCACA-3’;antisense,5’-CAC AGA ACT GAG GGT ACA-3’(GenBank accession number S71597)。 GADPH 引物序列 sense,5’-GAAGGG TGGGGCCAAAAG-3’; antisense, 5’-GGATGCAGGGAT GATGTTCT-3’ (Gen Bankaccession number AB017801)。將PCR產物電泳,用紫外凝膠成像系統照相,并用Kodak Digital Science 1D分析軟件進行灰度掃描和分析。
如圖2與表3所示,RT-PCR結果表明空白組基本觀察不到iNOS mRNA表達,而LPS刺激顯著地誘導了iNOS mRNA的表達。不同濃度的IRN處理呈劑量依賴性的抑制了LPS誘導的iNOS mRNA表達。

圖2 IRN對iNOS mRNA表達水平的影響
表3 IRN 抑制 iNOS mRNA 表達水平(,n=6)

表3 IRN 抑制 iNOS mRNA 表達水平(,n=6)
##p<0.01 vs空白組;**p<0.01,*p<0.05 vs LPS 組
2.6 ELISA法測定細胞上清液中的IL-1β和TNF-α含量
藥物處理24 h后收集細胞培養上清液。分別按ELISA試劑盒說明書繪制標準曲線和測定培養上清液中的IL-1β和TNF-α含量水平。
結果如表4所示,LPS組IL-1β和TNF-α的水平都遠高于空白對照組,而IRN不同濃度組都明顯的降低了這兩種炎性因子的含量。
表4 IRN 對 IL-1β 和 TNF-α 釋放含量的影響(,n=6)

表4 IRN 對 IL-1β 和 TNF-α 釋放含量的影響(,n=6)
##p<0.01 vs空白組,*p<0.05 vs LPS組
3 討 論
大量研究表明,星形膠質細胞在腦缺血疾病中扮演著重要角色,在缺血及再灌注后,缺血灶周圍大量的星形膠質細胞被激活,激活的星形膠質細胞一方面分泌出神經生長因子(nerve growth factor,NGF)、腦源性神經營養因子 (brain-derived neurotrophic factor,BDNF)和膠質源性神經生長因子(glial cell-derived neurotrophic factor,GDNF), 促進受損的神經元的修復與再生[8]。另一方面,激活的膠質細胞在缺血再灌注的初期不但參與抗原遞承,啟動炎性過程,還分泌了大量的炎性介質,例如NO、PGE2、IL-1β和 TNF-α等, 這些炎性介質進一步激活了周圍的膠質細胞,加重了腦內的炎癥反應,形成缺血后的二次損傷[2]。
NO對細胞的作用具有兩面性,中樞神經系統在一氧化氮合酶(NOS)作用下通過左旋精氨酸-NO途徑產生NO。NOS同工酶有3種亞型,即神經型(nNOS)、內皮型(eNOS)以及誘導型(iNOS)。生理狀態下,由eNOS和nNOS產生的少量NO可滅活氧自由基,并調節腦血流。在腦缺血再灌注過程中,腦內產生的多種炎性介質均可激活星形膠質細胞iNOS,釋放大量的NO,導致神經元去極化和谷氨酸鹽釋放增加,繼而產生神經興奮性中毒,造成神經元損傷或誘導神經元凋亡[9]。異鉤藤堿可以有效地降低LPS激活的星形膠質細胞中iNOS mRNA的表達,從而明顯地減少了NO的合成和釋放,降低缺血再灌注后的二次損傷。IL-1β和TNF-α具有更廣泛的生理病理作用,IL-1β是觸發免疫和炎癥反應的重要介質,誘導細胞粘附分子表達,吸引中性粒細胞聚集,激活膠質細胞產生多種細胞因子,誘導炎性細胞因子的基因表達及分泌,促進神經毒性物質的產生和釋放,IL-1β可誘導及加快凋亡基因表達[10]。TNF-α可以刺激膠質細胞產生多種炎癥因子,并調控多種細胞的細胞周期和細胞功能;直接或間接的引起神經元損傷或死亡[11]。異鉤藤堿對LPS刺激的星形膠質細胞的IL-1β和TNF-α分泌顯示出強大的抑制作用,有效地減輕了缺血后膠質細胞激活介導的炎癥反應的進一步加重,從而有利于神經元的存活和再生。
本研究表明,異鉤藤堿可以顯著地抑制LPS刺激的星形膠質細胞炎性介質NO的釋放,降低iNOS mRNA的表達水平,同時減少致炎因子IL-1β和TNF-α的產生。已有研究證明,異鉤藤堿還能有效地抑制LPS誘導的小膠質細胞的激活和炎性因子的釋放。這些結果說明異鉤藤堿具有較好地抑制中樞炎癥反應的作用,為傳統中藥鉤藤作為治療缺血性腦病藥物提供了科學依據。
[1]Eikelenboom P,Veerhuis R, Scheper W, et al.The significance of neuroinflammation in understanding Alzheimer′s disease[J].J Neural Transm, 2006, 113(11):1685-95.
[2]McGeer PL,Rogers J,McGeer EG.Inflammation,antiinflammatory agents and Alzheimer disease:the last 12 years[J].J Alzheimers Dis, 2006, 9(3):271-6.
[3]劉 佳,富志軍.鉤藤的研究概況[J].海峽藥學,2006,8(5):90-2.
[4]宋純清,樊 懿,黃偉暉,等.鉤藤中不同成分降壓作用的差異[J]. 中草藥,2000,31(10):762-4.
[5]黃燮南,石京山,謝笑龍.鉤藤堿和異鉤藤堿對Ca2+轉運影響[J].中國藥理學通報,1993,9(6):428-9.
[6]Yuan D,MaB,YangJY,etal.Anti-inflammatory effects ofrhynchophylline and isorhynchophylline in mouse N9 microglial cells and the molecular mechanism[J].Int Immunopharmacol,2009,9(13):1549-54.
[7]張 斌,魏欣冰,高 鵬,等.腦皮質星形膠質細胞的純化培養[J]. 山東大學學報(醫學版),2006,44(8):857-9.
[8]Altar CA,DiStefano PS.Neurotrophin traffcking by anterograde transport[J].Trends Neurosci, 1998, 21(10):433-7.
[9]Brown GC.Mechanisms of inflammatory neurodegeneration:iNOS and NADPH oxidase[J].Biochem Soc Trans,2007,35(5):1119-21.
[10]Masada T,Hua Y,Xi G,et al.Overexpression of interleukin-1 receptor antagonist reduces brain edema induced by intracerebral hemorrhage and thrombin[J].Acta Neurochir Suppl, 2003, 86(5):463-7.
[11]王 珍,劉慶瑩,朱長庚,等.戊四氮致癇大鼠腦和腦脊液IL-1β、TNF-α含量的變化及大腦皮質和海馬內GFAP和cyclinD1表達 [J].華中科技大學學報,2005,34(2):129-37.