多糧小曲清香型白酒發酵過程中微生物動態變化研究
王萬能,王 鵬,王 東,婁國平,龔曉林,范新發,趙遠雕,邱重晏
(1.重慶理工大學藥學與生物工程學院,重慶 400054;2.重慶市江津酒廠(集團)有限公司,重慶 402284)
中國傳統白酒由于其獨特的發酵工藝和產品風格,在世界六大蒸餾酒中占有重要的地位。小曲清香白酒在我國歷史悠久,是具有傳統特色的一個主要酒種。重慶小曲清香白酒主要以高梁等糧谷為原料,根霉小曲為糖化發酵劑,采用整粒原料經蒸煮、做箱培菌糖化、續糟固態發酵、蒸餾、陳釀、勾兌而成。它以其醇香清雅、糟香突出、回甜、余味凈爽等獨特風格而深受飲者喜愛[2]。
20世紀80年代至今,白酒微生物的研究進入了高潮,各酒廠、科研機構和學校紛紛對白酒微生物進行研究。窖池中的生態因素與窖池中的微生物相互聯系、相互作用、相互制約協調共同構建成了窖池特定微生物生態系統[3]。同時,由于曲藥以及現場生產環境的微生物因素,在連續投料生產每一批次的窖池酒醅中,周而復始地重復進行著微生物的消長和變化過程,因此在同一個生產地點和成熟的生產計數條件下,微生物的構成基本趨于穩定,在正常的發酵發酵狀態下微生物的動態變化是趨于一致的[4]。
本研究對江津小曲清香型白酒生產過程中的微生物進行分離、純化、計數和鑒定,一方面了解江津酒釀造的主要菌種及主要特性和作用,另一方面可以了解有害微生物的種類、性能和作用。通過了解控制發酵工藝來促進有益菌的作用、抑制有害菌的活動,提高和穩定酒的產量和質量,為發現白酒發酵過程微生物的動態變化規律和窖池發酵機理奠定一定的基礎[5]。
1 材料與方法
1.1 試驗窖池
重慶市江津酒廠生產窖池。
1.2 樣品采集
從制箱開始取樣,取制箱一天樣品。發酵中分別按入窖1、2、3、4、5 d跟蹤取樣。取樣深度在50 cm處,兩邊與中間三點混合均勻。
1.3 微生物的分離計數
1.3.1 根霉、芽孢桿菌及其他細菌的分離計數
配制LB、PDA培養基,無菌操作取樣2 g于滅菌的小燒杯中,加入滅菌水50 mL,稀釋倍數為10-3、10-4、10-5。可用滅菌的1.5 mL 離心管充分攪拌混勻。取0.2 mL的不同稀釋梯度濃度的菌液,涂布于LB、PDA固體培養基上,每個濃度重復2次,培養1 d,觀察不同的菌落,分類計數。計算得:純菌落數(個/g)=菌落數×稀釋倍數×125。通過《伯杰氏細菌鑒定手冊》配合細菌生理生化實驗鑒定芽孢桿菌及其他細菌。通過《真菌鑒定手冊》鑒定出根霉菌[6]。
1.3.2 酵母菌的分離計數
將2 g樣品置50 mL無菌水,充分攪拌混勻,稀釋10-3~10-5個濃度梯度。用槍頭吸取0.2 mL的3個梯度稀釋好的懸液分別涂布于YEPD培養基平板,倒置于28℃恒溫培養箱中培養。待培養基表面長出均勻菌落后計數。置于28℃恒溫培養箱中培養2~3 d后觀察,照相記錄菌落顏色和形態。然后依據《常見與常用真菌》進行觀察與檢索[7-8]。
1.3.3 乳酸菌的分離計數
MRS培養基冷卻至46℃左右,加入質量分數為10%的碳酸鈣粉末,備用。樣品稀釋:無菌操作取樣2 g于滅菌的小燒杯中,加入滅菌水50 mL,稀釋倍數為 10-3、10-4、10-5。分別吸取不同稀釋度的稀釋液2 mL置于制作好的MRS培養基內,鋪勻。用溶化冷卻至46℃左右的MRS培養基倒平皿,迅速轉動平皿使之混合均勻,冷卻成夾層平板[9]。培養和計數:將平皿倒置于37℃恒溫箱內培養24~48 h,觀察長出的細小菌落,取有溶鈣圈的菌落計數[10]。涂片,革蘭氏染色,鏡檢,對革蘭氏染色呈陽性的桿狀細菌進行純化培養。
2 結果與分析
2.1 各類菌種群在發酵過程的變化
在菌落生長到適宜對菌落進行計數時,對培養皿中的菌落計數,并記錄計數結果。本研究只對發酵過程中的主要菌落進行了分離鑒定計數,主要是根霉、酵母、芽孢、乳酸菌及其他細菌[11]。各類菌在發酵過程的變化如表1所示。
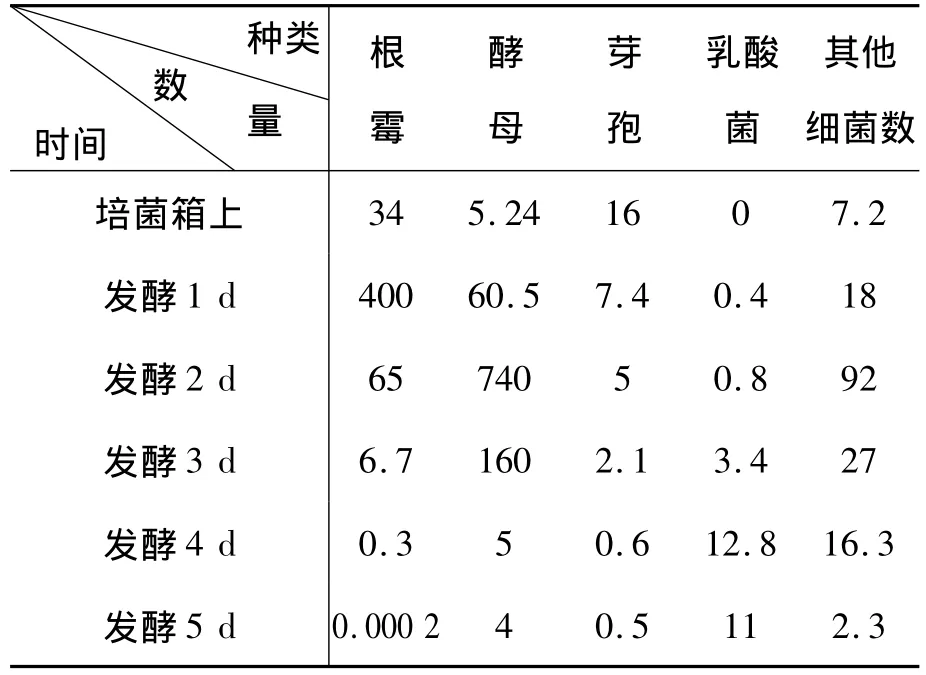
表1 各類菌在發酵過程的變化104個/g(酒醅)
2.2 發酵過程中微生物變化的動態曲線分析
白酒發酵過程中的主要優勢菌群主要有酵母菌、乳酸菌、根霉、芽孢桿菌等以及其他細菌。這些微生物相互作用、相互協調在發酵過程中發揮主要作用。微生物菌群數量的多少、種類對酒質的好壞有著很大的影響,所以可以調節其中微生物的動態變化使有害菌群與有益菌群達到平衡的狀態,使酒質大大提升,同時提高糧食利用率[12]。多糧小曲清香白酒發酵過程中微生物變化趨勢如圖1所示。
通過對本實驗的微生物進行分類鑒定、計數、繪制動態分析曲線,可更清晰地觀察和分析。根霉作為優勢菌,在入窖發酵1 d后,菌落數量達到400×104個/g,然后隨著環境的變化,其數量越來越少,到出窖時則減少到最少,只有2個/g。
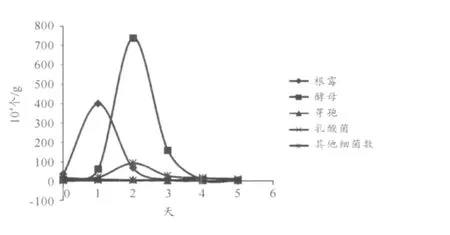
圖1 多糧小曲清香白酒發酵過程中微生物變化趨勢
酵母菌屬酵母,作為主要優勢菌,一直增加到發酵2 d,隨后雖有減少,但是一直到發酵后期都能被檢測到,酵母在酒精生產起最主要作用,其菌落數量高達740×104個/g。
乳酸菌屬細菌在入池前沒有檢測到,而在發酵后期逐漸增多,發酵第4 d菌落數達到12.8×104個/g,發酵5 d則又降低。
芽孢在入池時最多,可能是空氣等環境中的芽孢的進入。有關文獻報道芽孢可能是產淀粉酶有關。隨后則逐漸減少,發酵后期依然可檢測到,菌落數量也高達5 000個/g。
其他細菌在發酵第2 d數量最多,隨后由于氧氣的減少、pH值以及酒精的出現等環境的變化,細菌銳減,但是發酵末期依然有細菌存在。
3 分析與討論
根霉細胞中含有一定的酒化酶系,能邊糖化邊發酵,可使小曲酒整個發酵過程中自始至終邊糖化邊發酵,所以發酵作用較徹底,淀粉出酒率進一步得到提高,這一特性是其他霉菌所沒有的。發酵1 d后就達到了最高值,隨后有所減少,但一直伴隨在發酵過程中[13-14]。
釀酒酵母主要生長在含糖量較高的偏酸性環境中,是兼性厭氧微生物,在繁殖時需要供給大量空氣,具好氣性;在進行酒精發酵時,它就不需要空氣,具厭氣性[15-17]。在開始時數量不多,隨著發酵時間增加發酵環境更適宜酵母菌的生長,到第二天達到了最高值,隨后減少,但在發酵過程中在大部分時間里是最優勢菌。
從數據上來看乳酸菌數量明顯低于其他菌種數量。
酒中的眾多的香味成分來源于細菌的代謝,細菌主要有乳酸菌、芽孢桿菌等,乳酸菌能使發酵糖類產生乳酸,乳酸通過酯化產生乳酸乙酯,乳酸乙酯使白酒有獨特的香味,因此白酒生產需要適量的乳酸菌。但是乳酸菌過量使用會使酒醅酸度過大,影響出酒率和酒質。酒中含乳酸乙酯過多,會使酒氣帶悶香[18]。芽孢桿菌在初期數量最大,與車間生產環境有很大關系,隨后逐漸減少,芽孢桿菌與產淀粉酶有很大關系[19]。其他細菌沒有依依分類鑒定,它們可能也與酒的香氣產生有很大關系,有待于確定,希望今后在這方面進一步開展一些研究工作。
[1]吳衍庸.白酒工業生態中的微生物生態學[J].釀酒科技,2001(5):32-34.
[2]李大和.不同原料川法小曲酒生產技術評述[J].釀酒,2006,33(1):5 -8.
[3]貪娟莉,顏霞.太白酒發酵過程中酒醅微生物區系分析[J].釀酒科技,2006(150):40-42.
[4]沈怡方.關于清香型白酒的幾點思考[J].釀酒,2010,37(2):3 -4.
[5]劉永.多糧小曲清香型白酒生產工藝[J].釀酒科技,2010(4):68-70.
[6]謝善慈,李璐.濃香型白酒糟醅微生物分離方法初探[J].釀酒科技,2009(1):52 -55.
[7]中國科學院微生物研究所.常見與常用真菌[M].北京:科學出版社,1937.
[8]張磊,施思.濃香型白酒大曲中酵母菌的分離和鑒定[J].釀酒科技,2010(5):38 -41.
[9]徐立新,徐開成.產酸菌的分離純化[J].釀酒科技,2001(5):35-38.
[10]李鳳梅,王曉.自然發酵酸菜汁中乳酸菌分離鑒定[J].中國釀造,2008(3):33 -35.
[11]李增勝,任潤斌.清香型白酒發酵過程中酒醅中的主要微生物[J].釀酒,2005(5):32-34.
[12]何誠,任道群.濃香型白酒人工窖泥培養過程中微生物變化研究[J].釀酒科技,2011(1):15-17.
[13]蒙英,徐錦,黃家莉,等.替代法釀制小曲米酒研究[J].安徽農業科學,2010,38(20):10887 -10888.
[14]范光先,王和玉.茅臺酒生產過程中的微生物研究進展[J].釀酒科技,2006(10):75-78.
[15]葛隱,唐勝云.五糧液窖池中耐酸性酵母菌的分離篩選[J].釀酒,2010(5):34 -36.
[16]張麗琴,張琇,王永娟,等.干紅枸杞果酒釀造工藝的研究[J].安徽農業科學,2010,38(36):20746-20748.
[17]趙翾,李紅良,陳玩.紅豆糯米酒的釀造工藝研究[J].安徽農業科學,2010,38(30):17179,17183.
[18]姚惟琦,陳茂彬.濃香型白酒酒醅中乳酸菌分離及其對模擬固態發酵的影響[J].釀酒(3):26-28.
[19]王旭亮,王德良.白酒微生物研究與應用現狀[J].釀酒科技,2009(6):88-90.

