圍絕經期和絕經后子宮內膜息肉局部雌孕激素受體的表達及意義
郭偉男 孫立敏 張鍾元 馬翠卿 李曉 胡建秀 范秀華
子宮內膜息肉的發生與其局部雌孕激素(E2、P)水平及其受體[雌激素受體(ER),孕激素受體(PR)]表達有關,局部內膜組織接受甾體信號,并刺激相關蛋白表達,造成本病的發生與發展,甚至有學者認為子宮內膜息肉與子宮內膜癌有必然聯系[1]。通過研究圍絕經期和絕經后子宮內膜息肉患者局部雌孕激素受體的含量并與正常內膜進行比較,揭示甾體激素因素在圍絕經期、絕經后女性子宮內膜息肉發生中的作用。
1 資料與方法
1.1 一般資料 選取2009年1月至2010年6月就診于河北省正定縣人民醫院和河北醫科大學第二醫院門診宮腔鏡室經子宮內膜息肉切除術(TCRP),或因子宮肌瘤合并子宮內膜息肉而行子宮切除的圍絕經期(圍絕經期組,11例)及絕經后(絕經組,8例)子宮內膜息肉患者共19例,選取同期因生殖道脫垂而行子宮切除,排除子宮內膜病變患者9例(對照組),年齡42~60歲,體重具有可比性,排除雌激素替代及肝腎疾患,無婦科惡性腫瘤病史。
1.2 方法
1.2.1 資料采集:組織取下后分成2份,一部分4%多聚甲醛固定,用于HE染色及免疫組化SP法檢測組織中ER和PR表達;另一部分置于EP管中液氮保存,用于逆轉錄-聚合酶鏈反應(RT-PCR)半定量檢測ER和PR轉錄水平。
1.2.2 SP法免疫組化檢測ER、PR表達:采用免疫組化SP法檢測各組中ER、PR蛋白的表達。陰性對照一抗以 PBS替代,陽性對照由試劑公司提供的乳腺癌標本。ERα兔抗人多克隆抗體、ERβ兔抗人多克隆抗體均購自北京博奧森生物技術有限公司;二抗、DAB顯色劑等均購自北京中杉生物技術有限公司。采用計算機圖像分析系統,對于每張樣片隨機取5個部位進行圖像采集。
1.2.3 RT-PCR 檢測轉錄水平
1.2.3.1 引物:ER 引物:上游5’-GGAGACATGAGAGCTGCCA-3’,下游 5’-CCAGCAGCATGTCGAAGATC-3’,擴增產物大小:438 bp;PR引物:上游 5’-TCATGAGCCGGTCCGGGTGCAAG-3’,下游 5’-CGGGGTGGACGAGGCACAGG-3’,擴增產物大小:196 bp;β-actin引物:Actb-F:5’-TACCCAGGCATTGCTGACAGG-3’,Actb-R:5’-ACTTGCGGT GCACGATGGA-3’,目的片段長度205 bp。
1.2.3.2 PCR 擴增:擴增體系包括:上下游引物:2.5 μl、逆轉錄產物(cDNA):1 μl、dNTP(2 mmol/L):1 μl、Buffer:2 μl、ddH2O:14.85 μl,共 25 μl。ER 擴增條件:95℃ 預變性 5 min,95℃變性 30 s、53℃退火 30 s、72℃ 30 s,72℃ 延伸5 min,30 個循環,4℃保存;PR擴增條件:95℃預變性5 min,進入循環,95℃變性 45 s、55℃退火 30 s、72℃延伸 30 s,30 個循環后 72℃最后延伸5 min,4℃保存。
1.2.3.3 產物分析:紫外透射儀上觀察結果并照相,選用Band Scan 5.0凝膠圖像處理軟件進行光密度值分析,采用目的基因與β-actin光密度的比值表示目的基因的表達水平。
1.3 統計學分析應用SPSS 13.0統計軟件,計量資料以表示,采用t檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 免疫組化比較 見表1。
表1 3組免疫組化比較
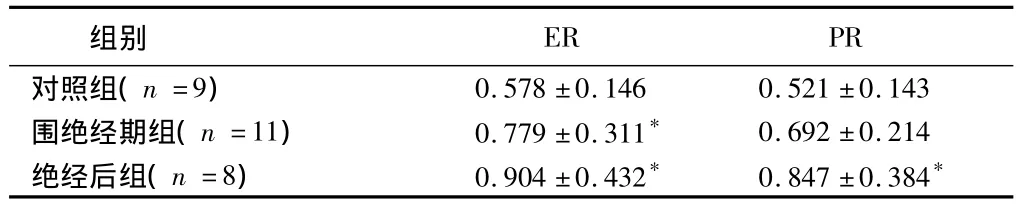
表1 3組免疫組化比較
注:與對照組比較,*P<0.05
ER PR對照組(n=9)組別0.578±0.146 0.521±0.143圍絕經期組(n=11) 0.779±0.311* 0.692±0.214絕經后組(n=8) 0.904±0.432* 0.847±0.384*
2.2 RT-PCR比較 見表2。
表2 2組RT-PCR比較
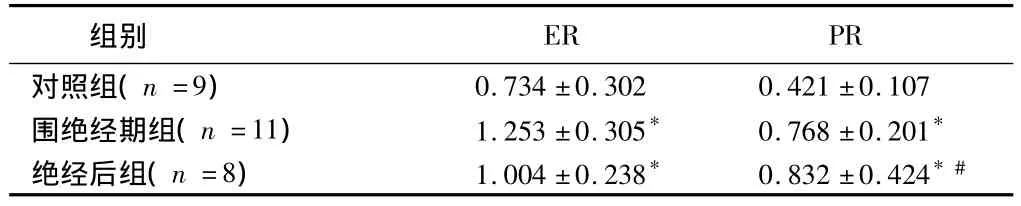
表2 2組RT-PCR比較
注:與對照組比較,*P<0.05;與圍絕經期組比較,#P<0.05
ER PR對照組(n=9)組別0.734±0.302 0.421±0.107圍絕經期組(n=11) 1.253±0.305* 0.768±0.201*絕經后組(n=8) 1.004±0.238* 0.832±0.424*#
2.3 免疫組化及RT-PCR圖 圍絕經息肉中ER表達上調,而圍絕經息肉中ER、PR的表達均上調。圍絕經期息肉中及絕經后息肉中的ER、PR的RNA轉錄水平較正常組都有所提高,同時絕經后息肉組較圍絕經期組中的PR的RNA轉錄水平有所提高。見圖1、2。
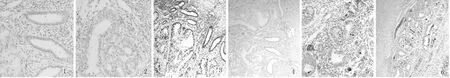
圖1 3組免疫組化檢測ER、PR蛋白表達(IHC×40)
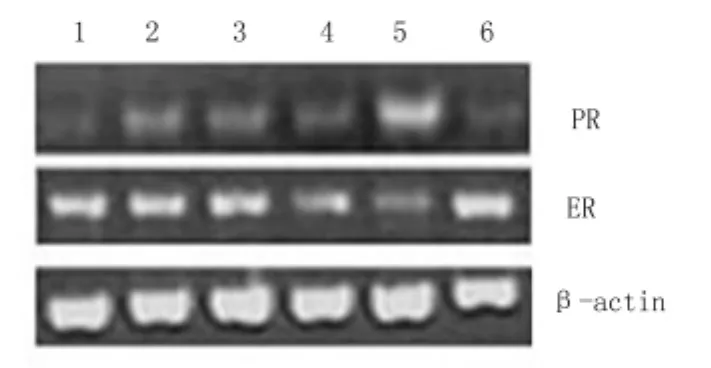
圖2 3組RT-PCR檢測ER、PR轉錄水平
3 討論
E2通過與ER結合,形成二聚體,再通過與靶基因中的雌激素反應元件(ERE)特異性結合,形成細胞信號刺激靶基因轉錄[2],造成一系列促進靶器官細胞增殖和分化的蛋白表達,對子宮內膜作用即表現為促進子宮內膜的增生和血管增殖。此外E2通過正反饋作用還可在DNA復制轉錄水平上誘導ER和PR生成,長期過度的作用即可使子宮內膜發生增生甚至癌變,而增生的一個表現即為形成子宮內膜息肉。在對孕齡女性的研究中發現,并非ER都參與了子宮內膜息肉的形成,E2及ER在其中起著更為重要的作用[3],而PR在息肉中的表達降低,可能提示P及PR途徑對本病發生起保護作用。
增殖期息肉中PR處于低水平、相對缺乏的狀態,使其進入分泌期后對P的反應能力下降,從而使P抑制ER產生的作用減弱,導致ER持續高水平表達,細胞增殖形成息肉[4,5]。我們研究發現,圍絕經期子宮內膜息肉患者局部ER表達升高,無論從蛋白水平還是從轉錄水平均得到證實,與肖艷景等[6]研究結果相一致,與孕齡女性子宮內膜息肉發病機制相一致[7],而在絕經后子宮內膜息肉的研究中發現,局部雌孕激素受體表達均升高,這在轉錄水平的研究更為明顯(P<0.05),這與孕齡女性子宮內膜息肉中的表達相悖[8],與傳統E2、P及其受體途徑作用觀點相反(E2與ER結合,產生促進細胞增殖相關信號,導致子宮內膜呈增生期改變,P與PR結合后產生一系列相關信號促進細胞成熟,導致子宮內膜向分泌期轉化)。本實驗結果提示:絕經后子宮內膜息肉的發病機制與圍絕經期及孕齡女性不同,因此在治療絕經后子宮內膜息肉的方法選擇上,建議絕經后女性避免使用E2、P替代治療。
隨著對激素路徑的不斷研究,發現ER、PR均存在亞型,有學者研究發現:ERα是造成子宮內膜癌的重要原因,而ER β則對子宮內膜惡變起保護作用[9]。近年來有越來越多學者著手于P亞型的研究,發現不同P亞型可能作用不同[10],在絕經后子宮內膜息肉的發病中是否由于不同孕激素亞型造成,還有待進一步研究。
1 張瑩,劉潔,崔月梅.宮腔鏡電切術診治子宮內膜息肉的臨床應用.河北醫藥,2010,32:2516-2517.
2 Jeffers WN,Couse JF,Banks EP,et al.Expression of estrogen receptor beta is developmentally regulated in reproductive tissues of male and female mice.Biol Reprod,2000,62:310-317.
3 Suzuki T,Shimizu T,Yu HP,et al.Salutary effects of 17beta-estradiol on T-cell signaling and cytokine production after trauma-hemorrhage are mediated primarily via estrogen receptor-alpha.Physiol Cell Physiol,2007,292:2103-2113.
4 Taylor LJ,Jackson TL,Reid JG,et al.The differential expression of oestrogen receptors,progesterone receptors,bcl-2 and ki-67 in endometrial polyps.Obstet Gynaecol,2003,110:794-798.
5 Bakout SH,Gupta JK,Khan KS.Risk factors associated with endometrial polyps in abnormal uterine bleeding.Menopause,2003,10:534-537.
6 肖艷景,張全武,謝林森,等.ER與PR等在絕經后子宮內膜息肉中的表達.實用技師雜志,2006,13:1659-1661.
7 范秀華,邢小芬,劉淳,等.ER、PR、HSP70和HSP90在子宮內膜息肉治療前后的表達及意義.河北醫藥,2009,31:3343-3345.
8 羅雪梅,程秋蓉,孟曉軍,等.子宮內膜息肉發病的相關因素研究.中國全科醫學,2010,13:588-590.
9 王海霞,解其貴,趙俊紅,等.子宮內膜癌雌激素受體α、β亞型和孕激素受體mRNA表達與臨床病理的關系.中國臨床醫學,2008,15:863-865.
10 陳銳,于麗,廖秦.子宮內膜癌中孕激素受體亞型表達及其甲基化狀態的研究.現代婦產科進展,2008,7:501-505.

