大鼠股直肌去負荷萎縮及再負荷恢復過程中的蛋白表達差異
周越 任媛媛 王瑞元
北京體育大學(北京 100084)
骨骼肌去負荷會產生廢用性萎縮,出現明顯的質量丟失和收縮能力下降等變化,而在特定的再負荷后又可恢復到正常水平。運動減退[1]、航天失重[2]和對骨折、癱瘓、神經性病變等疾病進行固定治療或因此導致的運動減少等,均會發生去負荷導致的廢用性肌萎縮[3]。
骨骼肌萎縮的過程涉及眾多細胞內分子,蛋白組分失衡可導致肌肉收縮功能發生變化[4,5]。但以往相關研究大多集中于單個或少數幾個基因和蛋白質,因此,整體分析并確定去負荷肌萎縮后究竟是哪些蛋白發生了變化及如何變化對了解骨骼肌收縮功能尤為重要。蛋白質組學(Proteomics)正是基于這種要求而誕生和發展的學科,采用蛋白質組學研究方法可有效地尋找和篩選2個樣本之間的蛋白表達差異[6,7]。本研究采用雙向電泳技術及大鼠尾部懸吊模型,從蛋白質組學角度研究骨骼肌去負荷肌萎縮過程中蛋白質的變化,篩選差異蛋白,探討發生機制,為預防和治療肌萎縮提供理論依據。
1 材料與方法
1.1 實驗對象及分組
Sprague-Dawley雌性大鼠24只,SPF級,8周齡,體重180~210克。購自北京維通利華實驗動物技術有限公司[許可證號:SCXK(京)2002-0001,動物編號:0668277]。標準飼料分籠飼養,自由飲食。室溫22±2℃,相對濕度50%~70%,每日光照12小時。動物實驗由北京實驗動物福利倫理委員會北京體育大學分會批準。
大鼠適應性喂養1周后隨機分為對照組(C)、去負荷2周組(U)與去負荷2周后自然恢復2周組(R),每組8只。對照組常規喂養,自由活動、飲食,共2周。
去負荷采用尾部懸吊模型:大鼠尾基部由透氣膠布纏繞制成懸掛點,懸掛大鼠使其后肢懸垂脫離地面,身體長軸與水平面成25°~30°,前肢著地仍可自由旋轉及自由進食飲水,共2周。
對照組和去負荷2周組于實驗開始后第14天取材,去負荷2周后自然恢復2周組在實驗后第28天取材。稱重后采用戊巴比妥鈉腹腔注射(45 mg/kg)麻醉大鼠。迅速剪取大鼠右腿股直肌稱重,切割成小塊后立即投入液氮內,肌肉組織-80℃保存。
1.2 蛋白質的抽提
采用TCA-丙酮沉淀法(pH4~7膠條)提蛋白。在液氮中將樣品充分研磨成粉末,取100 mg轉移至離心管中并加入2 ml蛋白提取液A(三氯乙酸0.2 g,巰基乙醇 1.4 μl,-20℃預冷丙酮 2 ml),-20℃沉淀過夜;4℃,40000 g離心1 h,棄上清,保留沉淀;用3倍體積的含0.07%(v/v)的巰基乙醇的冷丙酮將沉淀重懸,-20℃沉淀 > 1 h;4℃,40000 g離心1 h,棄上清,保留沉淀;將沉淀用真空干燥加速離心機抽干;將干燥粉末轉移至10 ml離心管中,按30 μl/mg加入蛋白提取液B(7M尿素,2M硫脲,4%(w/v)CHAPS,40 mM DTT,ddH2O,使用前加入PMSF、LEUPEPTIN和 IPG Buffer pH4~ 7);震蕩搖勻后置于冰上1~2 h,期間每10分鐘震蕩1次;超聲 10 s(2 s,59 s,20%);4℃,30000 g離心 1 h,棄沉淀,保留上清。
為建立穩定的二維電泳圖譜,每組標本重復進行二維電泳分離3次。溫度控制在20℃,實驗所需水均為去離子水。
1.3 雙向電泳
采用Bradford法測定總蛋白含量。
等電聚焦:采用PROTEAN IEF Cell(BIO-RAD,USA)等電聚焦儀。pH 4~7線性規格IPGs膠條(Bio-Rad)。提取好的上清液按照測得的蛋白濃度與水化液(8M Urea,2%CHAP,0.002%溴酚藍,DTT,IPG buffer)混合,蛋白含量為1500 μg,最終體積為400 μl。IPG膠條水化,泡脹20 min后,覆蓋適量礦物油封閉。低電場(60V)下水化12 h后進行等電聚焦。等電聚焦程序設置:50V 12 h,150V 1h,300V 1h,600V 1h,1200V 1 h,10000V 2h聚焦到65000V·h。
平衡與轉移:等電聚焦完畢后,取出膠條,先于平衡液I中平衡15 min,隨后在平衡液Ⅱ中平衡15 min。平衡儲液為0.05 M Tris-HCl(pH 8.8),6M尿素,30%甘油,2%SDS,0.002%BromopHenol blue,分裝,-20℃保存。儲液使用前加入2%DTT為平衡液I;加入2.5% Iodoacetamine 為平衡液II。后將膠條放于12%聚丙烯酰胺凝膠上,并覆蓋2 ml的75℃瓊脂溶液。
SDS-PAGE:第二向電泳在EttanTM DALT six Electrophoresis unit(GE Healthcare,Swede)垂直電泳槽上完成。起始電流為5 mA/gel,待樣品在完全走出IPG膠條,濃縮成一條線后,再加大電流到20 mA/gel,當溴酚藍指示劑遷移到膠的底部邊緣時,結束電泳。使用低分子量Marker。
染色:用Coomassie G-250染液染色過夜,脫色3小時(20%甲醇,10%冰乙酸)。
1.4 圖像掃描與分析
染色后的凝膠用方正Z-320掃描儀進行掃描,采用PDQuest軟件(Bio-Rad)分析獲得數字化圖像,包括蛋白點的檢測、背景扣除和點的匹配,以及等電點和分子量的校準等。選取表達量比值大于2倍或小于0.5的點作為差異蛋白質點。
分別對3組股直肌組織蛋白重復進行3次2-DE分離,選取正常對照組股直肌圖譜為Master,將去負荷組和自然恢復組圖譜與之比較,發現3組膠條重復性較好,匹配率分別為89%和92%。
1.5 統計學分析
數據均用平均數±標準差表示,組間采用SPSS軟件進行獨立樣本t檢驗,顯著性水平為P <0.05。
2 結果
2.1 大鼠體重與股直肌濕重
表1顯示,與對照組相比,去負荷組大鼠體重顯著下降(P < 0.01),股直肌濕重下降了21%(P< 0.01),股直肌濕重/體重也顯著下降(P < 0.01);自然恢復組上述三指標顯著高于去負荷組(P <0.01),而與對照組相比無顯著性差異。
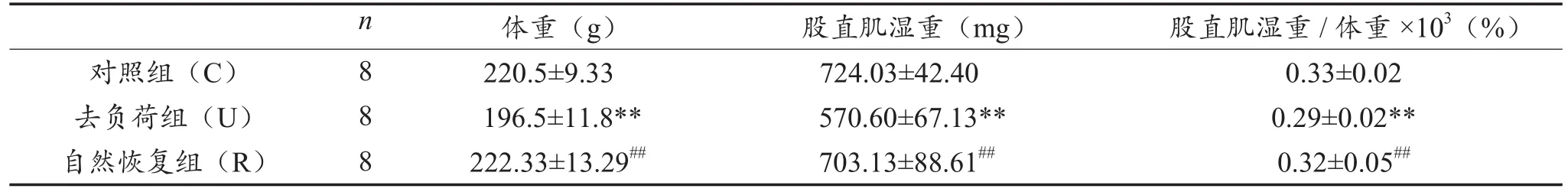
表1 三組大鼠股直肌濕重與體重比較
2.2 雙向電泳圖譜中的差異蛋白質點(圖1、表2)
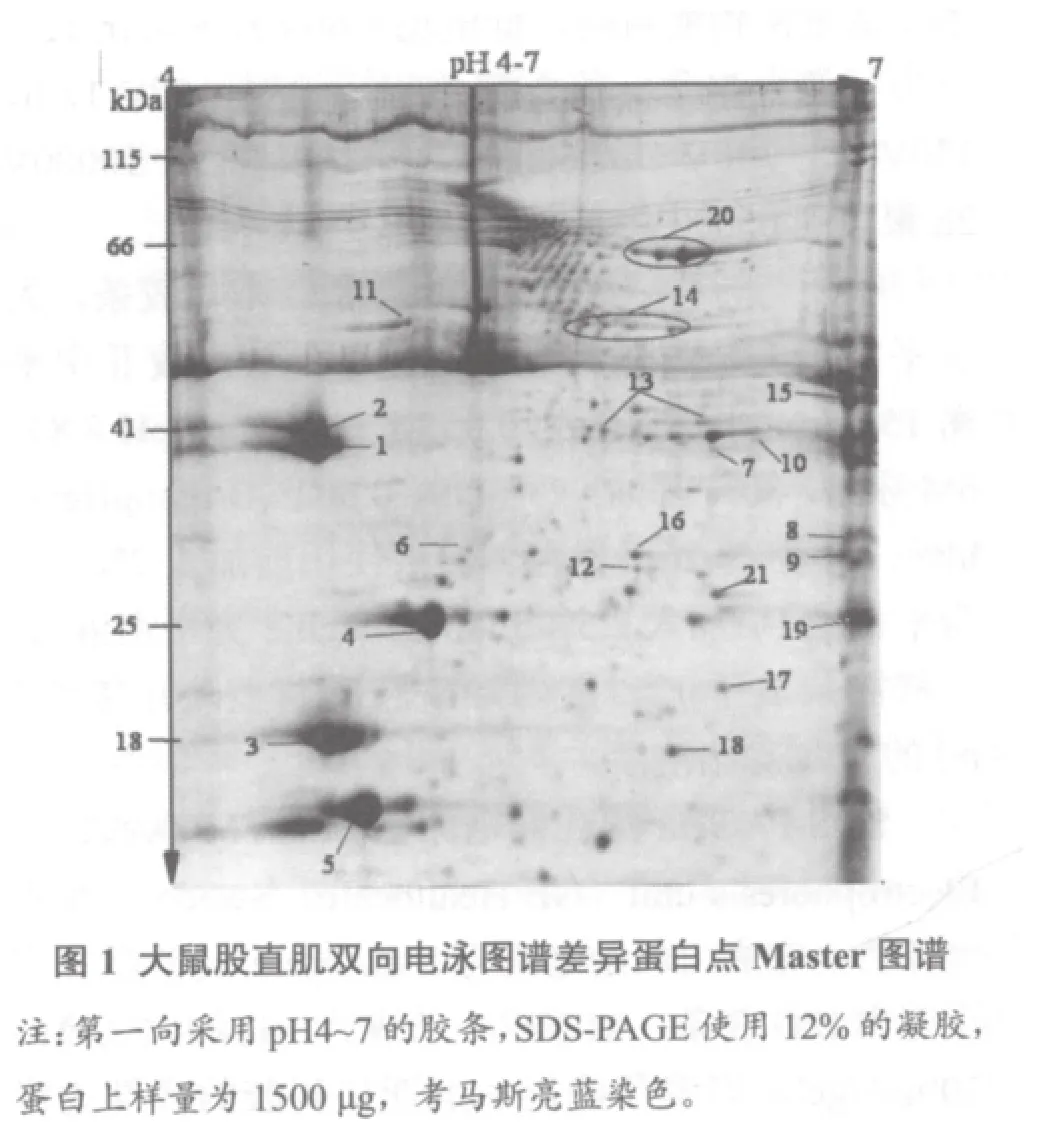
(2)代謝蛋白:有8種與糖酵解和線粒體代謝相關的蛋白出現表達差異。去負荷2周組磷酸丙糖異構酶1表達下調,為對照組的0.31,自然恢復2周組恢復到對照組水平。去負荷2周組大鼠股直肌,-烯醇酶表達均明顯上調,自然恢復2周組-烯醇酶異構體SSP6207恢復至對照組水平,而SSP7207持續上調;自然恢復2周組-烯醇酶異構體SSP6321和7303下調,僅SSP7303恢復到對照組水平,SSP6318和7303未恢復。去負荷2周組股直肌ATP合成酶鏈即線粒體前體、碳酸酐酶Ⅲ與過氧化物酶6表達上調,分別是對照組的2.81、2.18和2.51倍,恢復2周組持續上調未降低。去負荷2周組肌肉肌酸激酶M鏈表達上調,為對照組的10.41倍,自然恢復2周組表達下調,為去負荷2周組的0.11。去負荷2周組甘油三磷酸脫氫酶表達上調,恢復2周組亦持續上調未恢復(見表2,圖 1)。
(3)應激蛋白:去負荷組有4種應激蛋白出現表達差異。去負荷2周組P20與熱休克蛋白-6表達上調,自然恢復2周組仍持續上調,未見復原。去負荷2周組Hsp27表達與對照組未見差異,但自然恢復2周組與對照組相比表達上調。去負荷2周組股直肌B-晶體蛋白表達上調,是對照組的4.72倍,自然恢復2周組表達下調,為去負荷2周組的0.33(見表 2,圖1)。
(4)其他蛋白:去負荷2周組運輸蛋白血清白蛋白的兩種異構體(SSP6422和7415)表達與對照組相比下調,自然恢復2周組上調恢復到對照組水平。去負荷2周組DJ-1 protein表達上調,自然恢復2周組持續上調(見表2,圖1)。

表2 三組大鼠股直肌比較表達明顯變化的蛋白質
3 討論
3.1 肌萎縮模型
判定廢用狀態下肌肉萎縮程度的常用指標為肌肉濕重及濕重體重比。本實驗中,去負荷2周后股直肌濕重下降21%及濕重體重比顯著下降,表明懸吊2周后股直肌即出現明顯萎縮,肌萎縮模型成功建立。Kauhanen[8]等使兔后肢于收縮位制動3天后,股中間肌纖維直徑縮小15%;制動2周后,縮小50%;制動4周后,出現嚴重的肌原纖維纖維樣變性,同時肌肉中的結締組織明顯增多。Seo[9]研究發現大鼠去負荷3周后比目魚肌濕重下降了59%。總之,去負荷后骨骼肌明顯萎縮,但因方式不同或所研究的骨骼肌部位不同,其肌肉萎縮和重量下降幅度有差異。自然恢復2周組體重、股直肌濕重及濕重體重比與去負荷組比較有顯著性差異,而與正常對照組無顯著性差異,表明自然恢復2周后大鼠肌萎縮基本緩解。
3.2 收縮蛋白
肌肉收縮主要由粗細肌絲相互作用產生,收縮蛋白輕鏈和重鏈表達的變化會引起肌肉質量和收縮力量變化,也會導致肌纖維類型轉變。
肌球蛋白重鏈分子量大于220 kDa,采用雙向電泳不能很好地觀察其變化量。肌球蛋白輕鏈(MLC)是肌小節粗肌絲的組成成分。原肌球蛋白主要有加強和穩定肌動蛋白絲,抑制肌動蛋白與肌球蛋白結合的作用。MLC1與原肌球蛋白,在快肌中含量較高[10]。本研究中,去負荷2周后MLC1與原肌球蛋白,下降可能與去負荷后總蛋白量下降有關。MLC1表達下調可使橫橋形成時肌球蛋白重鏈活性及穩定性下降,引起肌張力減弱。自然恢復2周后,僅原肌球蛋白恢復,可能與恢復時間有關。
MLC3主要存在于Ⅱ型纖維中,在Ⅱb纖維中的含量顯著高于Ⅱa和Ⅱx纖維。Adams等[11]研究發現,在肌萎縮過程中快縮肌MHCⅡb增加,MHCⅡa與MHCⅡx蛋白減少。這可以解釋本實驗中去負荷2周后MLC3表達上調,恢復2周后MLC3恢復正常,即懸吊后快型肌纖維增加的結果。
MLC2在慢型肌纖維中含量較多,其下降可能與肌萎縮后慢型肌纖維向快型肌纖維轉化有關。MLC2下調意味著蛋白合成和降解途徑間的平衡向降解方向偏移。同時,這種在肌動蛋白-肌球蛋白系統中結構、組分的變化導致肌肉收縮功能降低[12]。
3.3 代謝蛋白
本實驗結果表明,去負荷2周后,與糖酵解相關的烯醇酶、甘油醛3-磷酸脫氫酶含量上調。這主要是去負荷導致肌萎縮后,肌肉不能正常收縮,出現缺血缺氧,從而有氧代謝減少、糖酵解增加,能量合成減少;同時,肌萎縮伴有肌纖維直徑減小和纖維類型由慢向快轉變,導致肌組織中糖酵解相關酶量增加。自然恢復2周后與糖酵解有關的酶含量雖有一定幅度下調,但未恢復到對照組水平,這可能與恢復時間和方式有關。
碳酸酐酶Ⅲ在哺乳動物骨骼肌中表達很高,主要集中在高耗氧型的慢收縮纖維即I型纖維中,在以糖酵解為主的快收縮纖維即II型纖維中含量極少[14]。本實驗觀察到的碳酸酐酶Ⅲ表達升高似與這種肌萎縮后肌纖維由慢向快的轉型不一致,其原因有待研究。碳酸酐酶Ⅲ還有助于將機體產生的HCO3-轉化成易于通過細胞膜的CO2[15],有助于代謝產物從細胞膜排出;碳酸酐酶Ⅲ對維持細胞內pH值的穩定也起著重要作用[16,17]。碳酸酐酶Ⅲ升高是否與這種增加CO2排出、穩定內環境的要求提高,清除糖酵解產生乳酸能力的增加有關,同樣值得深入研究。
肌酸激酶在骨骼肌能量轉移中起重要作用,可逆地催化磷酸鹽在ATP和肌酸之間的轉化。研究發現[18]在去負荷肌肉中,肌肉特異性肌酸激酶與甘油三磷酸脫氫酶表達上調,于去負荷4天后達最高峰,28天后保持穩定,可認為是肌肉廢用的標志。本研究與此結果一致,去負荷2周后肌酸激酶含量明顯上調,再負荷2周后恢復正常。肌酸肌酶上調與肌萎縮過程中纖維類型由慢轉快的表現一致。
Lawler等[19]在大鼠后肢去負荷導致廢用性肌肉萎縮的模型中發現,肌肉氧化水平升高和抗氧化能力降低。本實驗中去負荷2周后ATP合成酶鏈與過氧化物酶6上調可能是對肌萎縮過程中氧化應激的適應性反應。
磷酸丙糖異構酶(TPI)能催化磷酸二羥丙酮轉變為甘油醛三磷酸,其表達下調使肌細胞內磷酸二羥丙酮明顯增多,果糖1,6-二磷酸輕度增多,ATP合成率降低。本實驗中,去負荷2周后磷酸丙糖異構酶表達下調與ATP合成減少有關,自然恢復2周后其表達上調。
3.4 應激蛋白
肌萎縮過程中應激蛋白表達上調與氧化應激有關。Powers等[20]認為氧化應激是蛋白降解通路的關鍵調節因素,它導致蛋白水解增加和肌肉萎縮。HSPs在維持細胞穩態、保護氧化應激反應、輔助蛋白合成以及修復錯誤折疊蛋白等方面具有重要功能。熱休克蛋白HspB6、p20分別沉積在肌絲Z線、Ⅰ帶和閏盤等處,通過與肌動蛋白和中間肌絲相互作用來穩定肌小節,維護肌原纖維和細胞骨架結構,其表達與肌肉收縮尤其是慢肌的收縮有關[21];Hsp27主要功能是穩定微絲和細胞因子信號轉導,其在非應激條件下位于細胞質,應激時移位于細胞核內,在正常細胞中表達水平相對較低,但應激條件可誘導10~20倍表達。本實驗中,去負荷2周后 p20、Hsp27和HspB6表達略微上調,自然恢復2周后仍持續上調。這與Isfort[6,7]報道的后肢懸吊和去神經的比目魚肌相應熱休克蛋白表達下調相反,但與Andrianjafiniony等的研究結果[22]類似,即大鼠解懸吊14天時,肌肉重塑過程中氧化應激仍處于較高的激活狀態。這可能與觀察的肌組織部位或取樣時間不同有關。
3.5 其他蛋白
血清白蛋白對維持血液滲透壓有重要作用,有研究[25]發現,它能充當亞鐵血紅素并清除自由基,促進脂質代謝。臨床采用缺血時血清白蛋白末端序列發生改變所形成的缺血修飾白蛋白(ischemia modified albumin,IMA)作為心肌缺血的早期診斷和預后評估。有學者[26]觀察到靜坐工作者IMA水平比參加有氧運動者略低。本研究中,去負荷2周后血清白蛋白表達下調,自然恢復2周后表達上調,是否與其有相似的機制仍需研究。
4 總結
本研究采用蛋白組學技術整體分析了去負荷和再負荷恢復后骨骼肌蛋白表達的變化,表達差異較大的主要是收縮蛋白、代謝蛋白和應激蛋白,其表達變化可能是導致骨骼肌去負荷萎縮的原因。本研究尚未發現類似轉錄因子及信號轉導類蛋白的表達出現明顯變化,這可能與其在肌組織中的豐度較小有關,尚需進一步研究。
[1]Allen DL,Linderman JK,Roy RR,et al. Apoptosis: a mechanism contributing to remodeling of skeletal muscle in response to hindlimb unweighting. Am J Physiol Cell Physiol,1997,273(2):C579-C587.
[2]Adams GR,Caiozzo VJ,Baldwin KM. Skeletal muscle unweighting: spaceflight and ground-based models. J Appl Physiol,2003,95(6):2185-2201.
[3]Appell HJ,Duarte JA,Soares JM. Supplementation of vitamin E may attenuate skeletal muscle immobilization atrophy. Int J Sports Med,1997,18(3):157-160.
[4]Jackman RW,Kandarian SC. The molecular basis of skeletal muscle atrophy. Am J Physiol Cell Physiol,2004,287(4):C834-C843.
[5]Spangenburg EE,Williams JH,Roy RR,et al. Skeletal muscle calcineurin: in fl uence of phenotype adaptation and atrophy. Am J Physiol Regulatory Integrative Comp Physiol,2001,280(4):R1256-1260.
[6]Isfort RJ,Hinkle RT,Jones MB,et al. Proteomic analysis of the atrophying rat soleus muscle following denervation. Electrophoresis,2000,21(11):2228-34.
[7]Isfort RJ,Wang F,Greis KD,et al. Proteomic analysis of rat soleus muscle undergoing hindlimb suspension-induced atrophy and reweighting hypertrophy. Proteomies,2002,2(5):543-550.
[8]Kauhanen S,Leivo I,Pettila M,et al. Recovery of skeletal muscle after immobilization of rabbit hindlimb.A light microscopic study. APMIS,1996,104(11):797-804.
[9]Seo Y,Lee K,Park K,et al. A Proteomic assessment of muscle contractile alterations during unloading and reloading. J Biochem,2006,139(1):71-80.
[10]Okumura N,Hashida-Okumura A,Kita K,et al. Proteomic analysis of slow-and fast-twitch skeletal muscles.Proteomics,2005,5(11):2896-2906.
[11]Adams GR,Haddad F,McCue SA,et al. Effects of space fl ight and thyroid de fi ciency on rat hindlimb development expression of MHC isoforms. J Appl Physiol,2000,88(3):904- 916.
[12]Margossian SS. Reversible dissociation of dog cardiac myosin regulatory light chain 2 and its in fl uence on ATP hydrolysis. Biol Chem,1985,260(25):13747-13754.
[13]Fitts RH,Riley DR,and Widrick JJ. Functional and structural adaptations of skeletal muscle to microgravity.Exp Biol,2001,204(18):3201-3208.
[14]Shima K,Tashiro K,Hibi N,et al. Carbonic anhydrase-Ⅲ immunohistochemical localization in human skeletal muscle. Acta Neuropathol(Berl),1983,59(3):237-239.
[15]Kawashiro T,Scheid P. Facilitated transport of CO2in rat skeletal muscle. J Physiol,1976,260(2):35P.
[16]Henry RP. Multiple roles of carbonic anhydrase in cellular transport and metabolism. Ann Rev Physiol,1996,58 :523-538.
[17]Shelton JB,Chegwidden WR. Modi fi cation of carbonic anhydrase III activity by phosphate and phosphorylated metabolites. Comp Biochem Physiol,1996,114(4):283-289.
[18]Cros N,Muller J,Bouju S,et al. Upregulation of M-creatine kinase and glyceraldehyde 3-phosphate dehydrogenase: Two markers of muscle disuse. Am Physiol,1999,276(2):308-316.
[19]Lawler JM,Song W,Demaree SR. Hindlimb unloading increases oxidative stress and disrupts antioxidant capacity in skeletal muscle. Free Radic Biol Med,2003,35(1):9-16.
[20]Powers SK,Kavazis AN,and McClung JM. Oxidative stress and disuse muscle atrophy. J Appl Physiol,2007,102(6):2389-2397.
[21]Inaguma Y,Hasegawa K,Kato K,et al. cDNA cloning of a 20-kDa protein(p20) highly homologous to small heat shock proteins:developmental and physiological changes in rat hindlimb muscles. Gene,1996,178(1-2):145-150.
[22]Andrianjafiniony T,Dupré-Aucouturier S,Letexier D,et al. Oxidative stress,apoptosis,and proteolysis in skeletal muscle repair after unloading. Am J Physiol Cell Physiol,2010,299(2):C307-C315.
[23]Fujita Y,Ohto E,Katayama E,et al. alpha B-Crystallin-coated MAP microtubule resists nocodazole and calcium-induced disassembly. Cell Sci,2004,117(9):1719-1726.
[24]Horwitz J. Alpha-crystallin can function as a molecular chaperone. Proc Natl Acad Sci USA,1992,89(21):10449-10453.
[25]Jagoe RT,Lecker SH,Gomes M,et al. Patterns of gene expression in atrophying skeletal muscles: Response to food deprivation. FASEB J,2002,16(13):1697-17121.
[26]Lippi G,Salvagno GL,Montagnana M,et al. In fl uence of physical exercise and relationship with biochemical variables of NT-pro-brain natriuretic peptide and ischemia modi fi ed albumin. Clin Chim Acta,2006,367(1-2):175-180.

