一種光合細菌復合制劑對草魚的生長及非特異性免疫功能的影響
勞惠燕 王蔚淼 李小梅 李續娥
草魚養殖中一直面臨病害多、死亡量大的問題,而采用抗生素和化學藥物防治又會造成耐藥性和藥物殘留超標。因此,研發天然無公害、能有效提高草魚抗病力的免疫增強劑具有廣闊的前景。光合細菌是一大類在厭氧條件下進行不放氧光合作用的細菌總稱,在水產養殖上有凈化水質、促進生長、防病治病等作用。已有研究發現,光合細菌含有的細胞壁多糖和輔酶Q能明顯提高水產動物的免疫功能[1-3]。魚類主要依靠非特異免疫系統抵抗病原入侵,而關于光合細菌對草魚免疫機能的研究鮮有報道。本研究擬以一種光合細菌復合制劑為飼料添加劑飼喂草魚,探討其對草魚生長及非特異性免疫功能的影響,為開發防治魚病的益生菌制劑類藥物提供參考依據。
1 材料與方法
1.1 實驗材料及分組
光合細菌復合制劑(菌數4×109CFU/ml)和基礎飼料均由廣東海大集團股份有限公司畜牧水產研究中心提供。實驗草魚(Ctenopharyngodon idellus)180余尾,初始平均體重為(32.82±0.02)g,購回后置于水族箱中暫養22 d,之后隨機平分為2組:①對照組,只飼喂基礎飼料;②處理組,將光合細菌制劑按1%比例噴灑于基礎飼料上拌勻飼喂。每組各設3個平行,每個平行30尾魚。草魚飼喂過程中每日定時定量飼喂2次,并記錄攝食量,其它養殖管理按常規方式進行。
1.2 測定方法
1.2.1 生長性能指標的測定
分別對飼喂30 d和60 d的實驗草魚稱重、測體長,計算生長性能指標:
增重率(%)=[(試驗末均重-試驗初均重)/試驗初均重]×100;
體長增長率(%)=(試驗末體均長-試驗初體均長)/試驗初體均長×100;
特定生長率(%/d)=(ln試驗末均重-ln試驗初均重)/試驗天數×100;
飼料系數=均攝食量/(試驗末均重-試驗初均重);
蛋白質效率=[(試驗末總體重-試驗初總體重)/(飼料中的蛋白質含量×攝取飼料總重量)]。
1.2.2 非特異性免疫指標的測定
對飼喂30 d和60 d的實驗草魚稱重、測體長后,取血樣和肝臟(取樣前1 d停止投喂)。血樣采用穿刺尾動脈取血法取血,每組取15尾魚,采集的血樣部分以2 g/l的肝素鈉抗凝,其余分離血清。血清和肝臟均保存于-20℃冰箱中備用。
1.2.2.1 白細胞吞噬活性的測定
將金黃色葡萄球菌(Stapylococcus aureus,購于廣東省微生物菌種保藏中心)接種在LB培養基上,37℃下培養24 h后,3000 r/min離心5 min,集菌。然后在菌懸液中加入終濃度為1%的福爾馬林,37℃下滅活24 h(經過平皿法證實此菌已被徹底滅活),用滅菌生理鹽水(0.65%)清洗2次,并調成為濃度為10%的菌懸液,即為福爾馬林滅活的菌體,置4℃冰箱中保存備用,作為檢測白細胞吞噬活性的吞噬原。
將0.2 ml抗凝血加入0.1 ml金黃色葡萄球菌懸液,充分混勻后置于28℃下水浴,孵育1 h。水浴期間每隔10 min搖勻1次。靜置,吸取紅細胞與上層血漿之間的白細胞層,每個血樣涂5片。自然晾干后,滴加甲醇固定,Wright's-Giemsa染色10 min,蒸餾水沖洗,風筒吹干后油鏡觀察。計數并計算白細胞的吞噬百分比(PP)與吞噬指數(PI)。
PP(%)=(100個吞噬細胞中參與吞噬的細胞數/100)×100;
PI=吞噬細胞內的細菌總數/參與吞噬的吞噬細胞數。
1.2.2.2 血清抗菌活力的測定
用0.1 mol/l pH值6.4的磷酸鹽緩沖液從固體培養基上將熒光假單胞菌(Pseudomonas fluorescens,購于廣東省微生物菌種保藏中心)洗下作為底物并配成OD570=0.3~0.5的菌懸液。取3 ml該懸液與50 μl待測血清于試管中混勻,測570 nm處的光密度值(A0)。然后在37℃溫水浴中30 min,取出后放入冰箱(4℃)10 min終止反應,測定570 nm處的光密度(A),抗菌活力(Ua)按公式計算:Ua=(A0-A)/A0。
1.2.2.3 SOD、MDA、GSH-Px的測定
均采用南京建成生物工程研究所生產的試劑盒測定(批號為20100712),具體測定步驟按說明書進行。
1.3 數據處理
實驗數據采用Microsoft Excel進行t檢驗分析差異性。
2 結果
2.1 光合細菌復合制劑對草魚生長性能的影響
用添加光合細菌復合制劑的飼料飼喂草魚60 d時,草魚的生長性能指標變化如表1所示。從表1可知,處理組草魚增重率、特定生長率和蛋白質效率較對照組分別提高了2.68%、2.03%、4.72%,飼料系數降低了4.78%,體長增長率降低了4.63%。雖然這種差異不具有顯著性意義(P>0.05),但添加光合細菌復合制劑對草魚增重率、特定生長率、蛋白質效率增加及飼料系數降低的趨勢對草魚的養殖卻是十分有意義的。此外,處理組草魚增重率增加與體長增長率降低,提示添加光合細菌復合制劑有可能促進草魚的體形增肥。
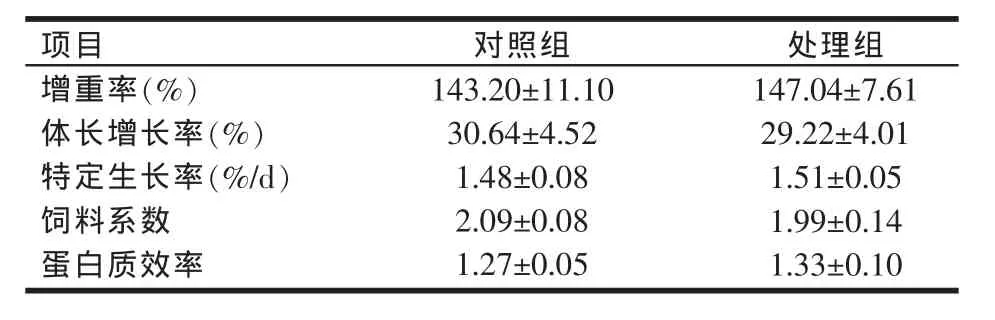
表1 光合細菌復合制劑對草魚生長的影響
2.2 光合細菌復合制劑對草魚非特異性免疫的影響(見表2)
光合細菌復合制劑作為飼料添加劑對草魚PP,PI,血清抗菌活力,血清及肝臟總SOD活力、MDA含量、GSH-Px活力共9個非特異性免疫指標的影響情況如表2所示。由表2可知,飼喂30 d時,處理組較對照組提高草魚白細胞吞噬百分比29.6%,具有極顯著差異(P<0.01),到飼喂60 d時,處理組與對照組白細胞吞噬百分比則無顯著性差異(P>0.05);飼喂30 d或60 d時,處理組與對照組的吞噬指數均無顯著性差異(P>0.05)。處理組與對照組的血清抗菌活力在飼喂30 d時無顯著性差異(P>0.05),但在飼喂60 d時,處理組極顯著升高(P<0.01)。
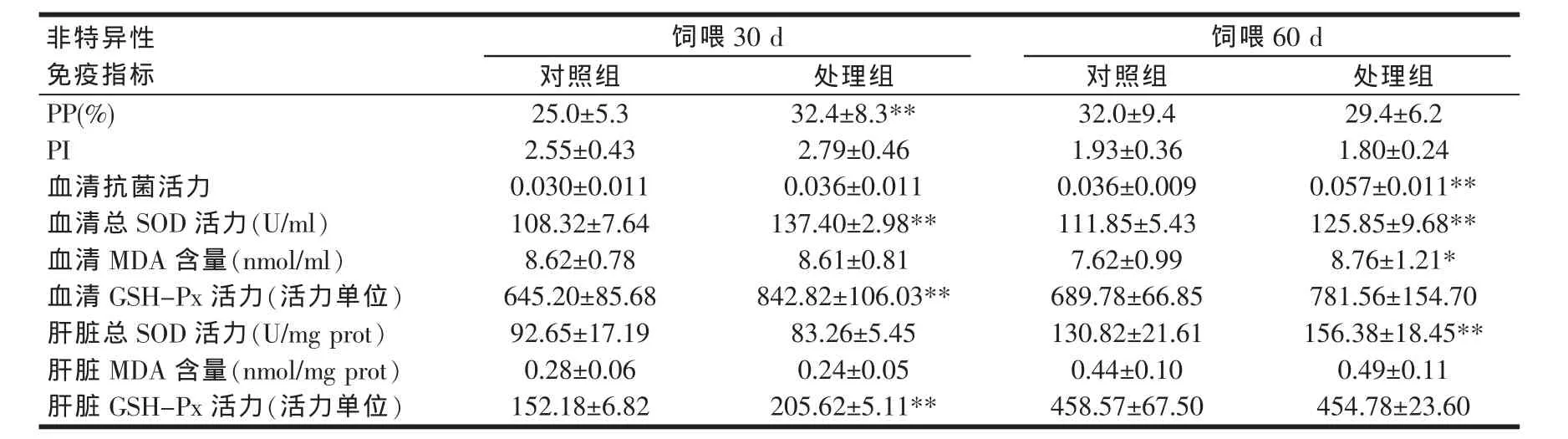
表2 光合細菌復合制劑對草魚非特異性免疫的影響
飼喂30 d或60 d時,與對照組相比,處理組草魚血清總SOD活力均極顯著升高(P<0.01),但肝臟總SOD活力僅在飼喂60時有極顯著升高(P<0.01);飼喂30 d時,處理組血清及肝臟GSH-Px活力均極顯著升高(P<0.01),飼喂60 d時,處理組與對照組的該指標則不具顯著性差異(P>0.05)。飼喂60 d時,處理組草魚血清MDA含量較對照組顯著升高(P<0.05),但肝臟MDA含量沒有顯著性變化(P>0.05)。
3 討論
3.1 光合細菌復合制劑對草魚生長性能的影響
光合細菌能有效利用水中過剩的有機物作為自身繁殖的營養源,迅速分解水中有害物質,增加溶氧,穩定水質,為水生生物創造良好的生態環境;其菌體的營養成分十分豐富,蛋白質含量高達65.45%,維生素含量豐富、齊全[4],有很好的促生長作用。沈錦玉等[5]在飼料中添加1%或5%的光合細菌飼喂鯽魚、羅非魚48 d,得出魚的生長速度高于對照組的結論;Wang Yanbo等[6]的研究結果表明,飼料中添加0.1%光合細菌凍干粉飼養鯉魚60 d能顯著提高其日增重、相對增重率和降低飼料系數。本試驗飼料中添加1%的光合細菌復合制劑飼養草魚60 d對其生長沒有顯著影響,這可能與光合細菌的種類及添加劑量、魚的食性以及養殖環境有關。
3.2 光合細菌復合制劑對草魚非特異性免疫的影響
飼料中的微生態制劑通過刺激機體的細胞和體液免疫功能提高水產動物的抗病力,如白細胞吞噬活性、抗菌活力、溶菌酶活力、補體活性、過氧化物酶活力等。
魚類白細胞的主要作用是吞噬病菌和自身的老化與壞死細胞,保護機體抵御病害的侵襲。王有基等[7]每7 d給鯉魚投放不同濃度的光合細菌菌液,在第1、7、14、21、28 d檢測鯉魚白細胞吞噬活性等指標,測得處理組白細胞吞噬百分比和吞噬指數明顯高于對照組(P<0.05),且隨著時間的增加而增強;趙衛紅等[8]的研究結果也表明,在水體中添加光合細菌飼養異育銀鯽49 d能提高其白細胞的免疫性能,作用效果隨著添加量的增加而增加。本研究發現,光合細菌復合制劑飼喂草魚30 d時提高草魚白細胞吞噬百分比29.6%,而60 d時處理組與對照組沒有顯著差異,可能是因為光合細菌對魚類白細胞吞噬活性的刺激作用主要在投放的早期、持續時間較短的緣故。
SOD對機體的氧化與抗氧化平衡起著至關重要的作用,此酶能清除超氧陰離子自由基(O2-),保護細胞免受損傷。本研究表明,飼喂草魚30 d時,處理組血清SOD活力提高了26.8%,60 d時血清SOD活力提高12.5%,肝臟SOD活力提高19.5%,血清抗菌活力提高58.3%,劉慧玲等[9]的研究結果也表明,光合細菌能顯著提高羅非魚組織SOD活力和抗菌活力,與本研究的結果一致。GSH-Px是機體內廣泛存在的一種重要的催化過氧化氫分解的酶,起到保護細胞膜結構和功能完整的作用。關于光合細菌對魚類GSH-Px活力的影響,目前尚未發現報道,而其它微生態制劑對水產動物GSH-Px活力的影響則有相關報道。Deng-Yu Tseng等[10]測定枯草芽孢桿菌對白對蝦的免疫參數的影響,GSH-Px活力是指標之一,但各處理組之間沒有顯著差異。本試驗結果顯示,光合細菌復合制劑在飼喂草魚30 d時極顯著提高草魚血清和肝臟GSH-Px活力,60 d時與對照組沒有顯著差異,推測其對GSH-Px活力的刺激作用可能也在早期。
MDA是脂質過氧化反應的終產物,它的含量高低間接反應了機體細胞受自由基攻擊的嚴重程度。在正常生物體內,氧自由基的產生與清除可維持低水平的,有利無害的平衡[11]。本研究中飼喂草魚60 d時,血清處理組MDA含量反而比對照組顯著升高了,說明受自由基攻擊的程度高,這可能是機體要與血清中極顯著升高的清除自由基的SOD平衡的緣故。菌種來源、類型、劑量和使用時間等各種因素會顯著影響微生態制劑的免疫調節活力。由于微生態制劑在水產養殖中存在最適宜劑量,且最適宜劑量會因免疫對象和免疫指標的類型而不同,不同組織或器官的特定免疫反應的作用也會隨著使用劑量而變化。免疫刺激劑的用量與免疫刺激作用并不存在正相關,高劑量或者是長時間的投喂反而會抑制免疫反應[12-13]。因此,光合細菌復合制劑對草魚的最佳免疫時間和使用劑量還有待進一步研究。
[1]敖禮林.光合細菌在水產養殖上的高效應用及注意事項[J].江西水產科技,2009(4):38-39.
[2]寧宕.新一代飼料添加劑——光合細菌[J].獸藥與飼料添加劑,2003(2):47.
[3]Qi Zizhong,Zhang Xiaohua,Boon N,et al.Probiotics in aquaculture of China-Current state,problems and prospect[J].Aquaculture,2009,290(1/2):15-21.
[4]徐良梅,滕小華.光合細菌的基本特性及在水產養殖上的應用[J].東北農業大學學報,2005,36(2):230-234.
[5]沈錦玉,尹文林,劉問,等.光合細菌HZPSB對水產養殖水質的改良和對魚類促生長作用[J].科技通報,2004,20(6):481-484.
[6]Wang Yanbo,Xu Zirong.Effect of probiotics for common carp(Cyprinus carpio)based on growth performance and digestive enzyme activities[J].Animal Feed Science and Technology,2006,127(3/4):283-292.
[7]王有基,胡夢紅,朱煥青,等.光合細菌對鯉魚非特異性免疫功能的影響[J].水利漁業,2005,25(6):38-39.
[8]趙衛紅,陳立僑,劉曉利,等.地衣芽孢桿菌和莢膜紅假單胞菌對異育銀鯽魚種非特異性免疫機能的影響[J].上海水產大學學報,2008,17(6):757-760.
[9]劉慧玲,張戰鋒,李長玲,等.光合細菌對羅非魚魚苗養殖水質及抗病力的影響[J].漁業現代化,2009,36(2):47-51.
[10]Tseng D Y,Ho P L,Huang S Y.Enhancement of immunity and disease resistance in the white shrimp,Litopenaeus vannamei,by the probiotic,Bacillus subtilis E20 [J].Fish & Shellfish Immunology,2009,26(2):339-344.
[11]張燕,李桂芳,任秀敏,等.鼻息肉組織和血清中MDA含量及ADA、SOD活性的測定及其意義[J].山東大學耳鼻喉眼學報,2010,24(6):24-26.
[12]Nayak S K.Probiotics and immunity.A fish perspective[J].Fish&Shellfish Immunology,2010,29(1):2-14.
[13]Hai N V,Fotedar R.Comparison of the effects of the prebioticsβ-1,3-D-glucan)and the customised probotics(Pseudomonas synxantha and P.aeruginosa)on the culture of juvenile western king prawns (Penaeus latisulcatus Kishinouye,1896)[J].Aquaculture,2009,289(3/4):310-316.

