特異性抗原致敏的DC-CIK與DC-CTL細胞對黑色素瘤抑瘤作用的比較
任鵬濤,張 苑,蔡建輝,張 艷,田 青
(河北醫科大學第二醫院胃腸外科,石家莊050000)
黑色素瘤是臨床上常見的惡性腫瘤之一,手術難以徹底切除,且化療、放療等常規治療方法的效果均不明顯。近年來發現過繼免疫治療對其有較好的療效。過繼免疫治療對腫瘤病人免疫系統的重建,清除微小腫瘤病灶,提高病人生活質量及延長生存時間等具有重要的意義。但在治療過程中最關鍵的是要獲得殺傷效果好、存活時間長、數量多的免疫效應細胞。目前常用于臨床的腫瘤浸潤淋巴細胞和淋巴因子激活的殺傷細胞(lymphokine activated killer,LAK細胞)等效應細胞都存在殺傷活性弱、增殖活性低或在臨床應用時副作用大等問題。細胞因子誘導的殺傷細胞(cytokine induced killer,CIK細胞)和細胞毒性T淋巴細胞(cytotoxic lymphocytes, CTL)因其具有殺瘤譜廣、增殖能力強、副作用小等優點從而成為現階段過繼免疫治療中效應細胞研究的熱點。本實驗試圖通過兩者對細胞增殖周期和細胞凋亡的影響以及殺傷實驗效果的研究進一步為臨床提供更為安全、有效的腫瘤免疫治療效應細胞。
1 材料和方法
1.1 主要試劑和實驗動物 IL-1α、IL-2、INF-γ、GM-CSF均購自美國PEPRO TECH公司,RPMI1640培養基和青霉素-鏈霉素購自美國HYCLONE公司,胎牛血清購自杭州四季青生物工程材料有限公司,四甲基偶氮鹽(MTT)購自SIGMA公司。
C57BL/6小鼠(8周齡,雌性,體重15~20g,平均體重18g,共70只)由河北醫科大學動物實驗中心提供,按標準培養環境條件飼養。小鼠B16黑色素瘤細胞株由中國科學院上海生物化學與細胞生物學研究所細胞庫提供。
1.2 實驗方法
1.2.1 樹突狀細胞(DC)的制備[1]DC的培養:無菌條件下取小鼠脾臟(10只小鼠),研磨,200目篩網過濾,采用密度梯度離心,將得到的PBMC放入RPMI-1640培養基(含10%胎牛血清)吹打混勻,調整細胞濃度為5×106個/mL,加入24孔板中,每孔1mL,置于37℃,5%CO2培養箱中3h。用完全培養液洗去非貼壁細胞,獲得貼壁的單核細胞。加入IL-4(500U/mL)和GM-CSF(1000U/mL),于5%CO2培養箱內培養,以后每3d半量換液1次。
1.2.2 CIK細胞的制備[2]CIK細胞的培養[2]:取上述含未貼壁細胞的培養液中加入INF-γ(1000U/mL),24h后加入IL-1α(100U/mL)、CD3McAb(50ng/mL)和IL-2(500U/mL),于5%CO2培養箱中培養,每3d半量換液1次,第14天收獲細胞。
1.2.3 腫瘤全抗原和抗原負載的DC-CIK的制備 B16黑色素瘤細胞株在PRMI-1640培養基中培養、傳代,消化收集對數生長期的該細胞,離心,洗滌,封裝入凍存管中。緩慢放入液氮內10min,取出后立即置入37℃水浴箱中10min,該凍融步驟共重復3次。隨后將其放入離心機中3000r/min,離心10min。取上清液,于-20℃冰箱中保存備用。在DC培養的第6天加入按上述方法制備的腫瘤凍融抗原,3d后收集該DC加入CIK細胞培養瓶中(DC∶CIK=1∶10)共同培養即為特異性抗原負載的DCCIK,再培養4d后記數并收集細胞。
1.2.4 特異性抗原負載的DC-CTL的制備[3]取正常小鼠抗凝靜脈血梯度離心法分離外周血單核細胞,尼龍毛柱法分離得到T淋巴細胞。將培養9d的DC細胞與腫瘤抗原共同孵育3d,加入培養5d的T淋巴細胞培養瓶內,再共同培養24h,所獲得的細胞即為特異性抗原負載的DC-CIK細胞。
1.2.5 建立B16黑色素瘤動物模型及效應細胞的注射 60只C57小鼠,將低溫保存的B16惡性黑色素瘤細胞復蘇后傳代、培養,取對數生長期的細胞消化后,離心并進行細胞計數,調整細胞濃度至5×106/mL,C57BL/6小鼠左肩背部皮膚消毒后,注射器吸取0.2mL接種于該處皮下,迅速用鑷子夾住皮膚,防止接種細胞懸液回流。然后隨機將小鼠分為3組:第1組:特異性抗原負載的DC-CIK;第2組:特異性抗原負載的DC-CTL;第3組:對照組。待小鼠注射部位形成黑色腫瘤后(接種第14天接種部位出現直徑0.33~1.67cm大小的腫瘤,平均直徑0.68cm),按照分組于小鼠鼠尾靜脈分別注射以上培養的DCCIK和DC-CTL效應細胞,劑量均為0.2mL(細胞濃度為1×106/mL,對照組于鼠尾靜脈注射同等劑量的生理鹽水)。第15天提取標本。
1.2.6 對腫瘤細胞的體外殺傷作用的檢測 采用MTT比色法檢測2組效應細胞對B16細胞的抑瘤作用。按效靶比例1∶10、1∶20、1∶40加入B16黑色素瘤細胞接種24h的96孔板內,共同培養24h加入新鮮配制的5mg/mL的MTT 10μL,共同培養4h,離心(2000r/min 5min),吸棄上清液,每孔加DMSO100μL振蕩溶解10min,用酶標檢測儀在570nm處測定吸光度A值。同時設空白對照、靶細胞對照、效應細胞對照。每孔數值減去空白孔對照,求出3個復孔的平均A值,按下面公式計算效應細胞的細胞毒活性,以殺傷率表示:殺傷率(%)=[靶細胞對照A值-(實驗孔A值-效應細胞對照A值)]/靶細胞對照A值×100%
1.2.7 對腫瘤細胞增殖和凋亡作用的影響 每組取5只小鼠在治療注射結束后5d脫頸椎處死。先測量瘤體大小及瘤體重量。再取癌腫結節2份,1份用4%戊二醛固定,制備電鏡標本,透射電鏡觀察。另1份用70%乙醇固定,制備流式細胞儀檢測標本上流式細胞儀檢測凋亡率,每個標本重復3次。
1.3 統計學處理 計算癌細胞凋亡指數(AI)與增殖指數(PI)的比率以及細胞周期中G0/G1期、S期、G2/M期各期細胞比率,并應用SPSS11.0統計軟件,采用方差齊性t檢驗進行統計學分析。
2 結果
2.1 DC細胞的形態學觀察 從外周血獲得的單個核細胞,培養3h后,獲得貼壁細胞,多為體積小、圓形的單個核細胞。培養2~3d的細胞開始出現變形,體積增大,由規則的圓形變為不規則,表面有細小的樹突狀偽足。第5天時,細胞的體積更大,表面出現大量毛刺狀突起,并且細胞常聚集成大小不等的細胞團,部分細胞開始懸浮。培養至7~9d成熟后,大部分細胞開始懸浮,呈典型的樹突狀細胞形態。在掃描電子顯微鏡下可以觀察到DC細胞表面有絲狀、星型、毛棘狀等偽足樣突起(圖1)。
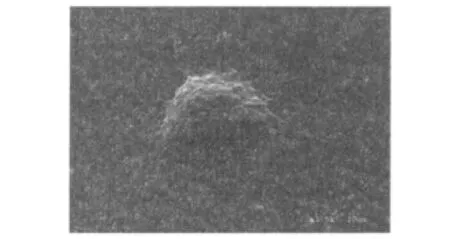
圖1 DC細胞電鏡圖片Fig 1 Morphological observation of dendritic cell(DC)
2.2 免疫表型的測定 DC高表達CD1a、CD80、CD86、HLA-DR;流式細胞檢測表明CIK細胞屬于異質細胞群,但隨著培養時間的延長,CD3+CD8+、CD3+CD56+所占細胞的比率明顯升高。
2.3 DC-CIK和DC-CTL的抑瘤作用 DC-CIK組腫瘤平均體積(0.0377±0.0128)cm3,DC-CTL組腫瘤平均體積(0.0359±0.0131)cm3,對照組腫瘤平均體積(0.4052±0.0429)cm3。DC-CIK組和DC-CTL組腫瘤體積明顯小于對照組(P<0.05),DC-CIK組和DC-CIK組兩組之間比較,雖然DC-CTL組體積略小,但沒有顯著性差異(P>0.05)。瘤體重量對照組為(2.061±1.07)g,DC-CIK組(0.958±0.32)g,DCCTL組(0.939±0.41)g,兩實驗組瘤體重量明顯小于對照組(P<0.05),但兩實驗組之間沒有顯著性差異(P>0.05)。
2.4 對腫瘤細胞凋亡作用的影響
2.4.1 透射電鏡觀察細胞凋亡情況 透射電鏡觀察對照組小鼠瘤細胞核增大、畸形,核膜結構清晰,細胞質少,核質比例失調,細胞質內有大量線粒體、游離核蛋白體豐富;實驗組可見瘤細胞體積不同程度的減小,形態不規則,與鄰近的瘤細胞脫離,且細胞核皺縮,胞質濃縮,線粒體空泡化,核異染色質邊集,濃縮成半月形,可見小而圓的無結構的凋亡小體。部分腫瘤細胞出現細胞膜破壞,胞質外溢。
2.4.2 DC-CIK細胞、DC-CTL細胞對癌細胞增殖周期和細胞凋亡的影響 實驗組兩組細胞,流式細胞DNA直方圖上均可見不同程度的凋亡峰,而對照組未見凋亡峰(圖2)。
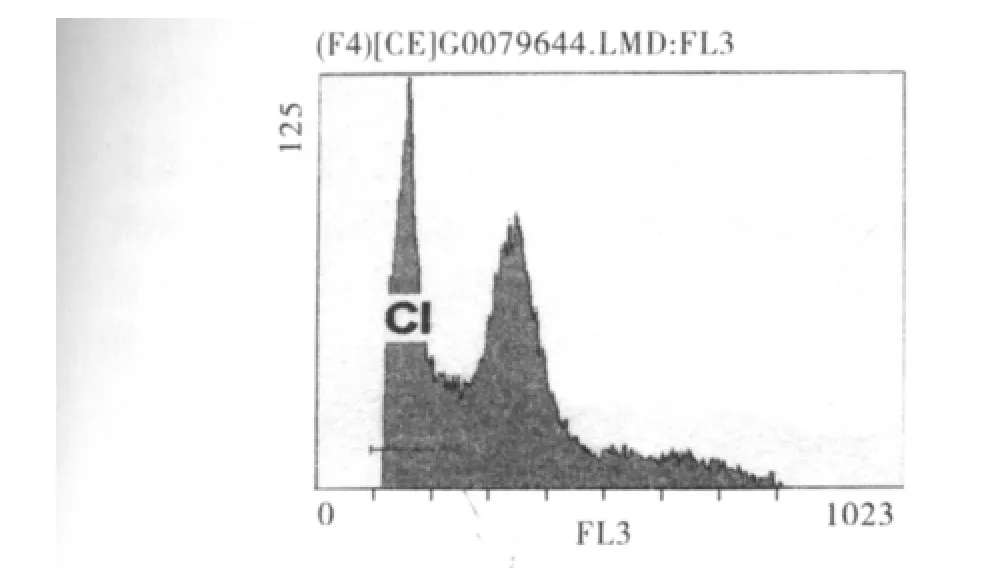
圖2 凋亡峰在實驗組表現Fig 2 Apoptosis peak observed in experiment group
實驗組兩組細胞作用后與對照組細胞相比較,瘤細胞中G0/G1期比率和細胞AI顯著增加(P<0.05),S期未見顯著變化(P>0.05),G2/M期細胞比率和細胞PI下降(P<0.05),但實驗組兩組之間沒有有顯著差異(P>0.05),見表1。
2.5 細胞體外抑瘤作用 DC-CIK和DC-CTL對腫瘤細胞都有較強的殺傷作用,但DC-CTL對B16黑色素細胞的殺傷作用明顯高于DC-CIK(P<0.05),且殺傷活性隨著效靶比的增加而升高,見表2。
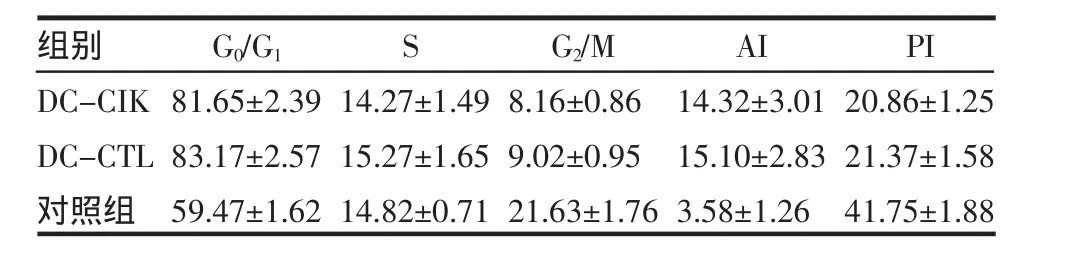
表1 DC-CIK、DC-CTL細胞對B16黑色素瘤細胞G0/G1、S、G2/M期細胞比率及對AI、PI的影響Tab 1 Effect of DC-CIK cells and DC-CTL cells on the rate of B16melanoma cells in G0/G1,S,G2/M stages,PI and AI rate of tumor cells
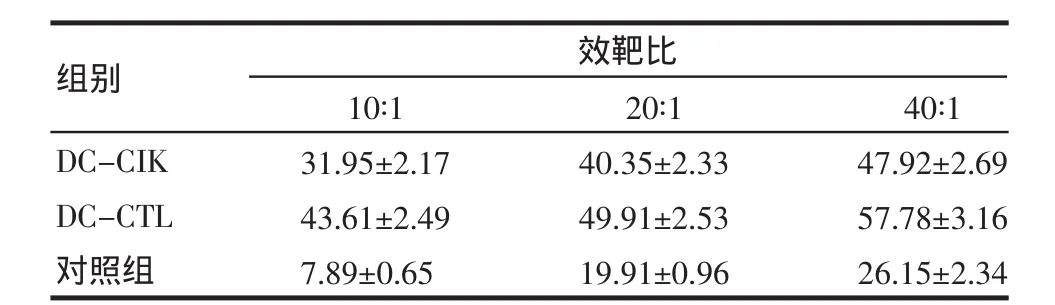
表2 DC-CIK和DC-CTL對B16黑色素瘤的殺傷活性Tab 2 Killing activity of DC-CIK and DC-CTL effector cells to B16melanoma cells
3 討論
樹突狀細胞是體內最重要的、功能最強的抗原遞呈細胞,它能有效的攝取、加工、遞呈腫瘤抗原,在機體的抗腫瘤免疫中發揮著重要的作用[4]。CIK細胞是在體外通過加入不同的細胞因子刺激外周血單個核細胞培養而獲得的一群異質細胞,具有T淋巴細胞強大的抗瘤活性和NK細胞的非MHC限制性殺瘤優點[5]。眾多研究表明DC細胞與CIK細胞共同培養可以提高CIK細胞對靶細胞的細胞毒殺傷作用[6-8],其機制可能為(1)DC細胞分泌的多種細胞因子,如IL-2、INF-γ等可以促進CIK細胞的進一步成熟。(2)DC分泌的IL-12明顯升高,誘導Th-1型免疫應答,可以進一步清除腫瘤細胞。且腫瘤細胞總蛋白中包含有豐富的膜抗原、MHC抗原表位等成分,經過特異性抗原致敏的DC細胞的攝取、加工和遞呈后,可誘導針對該特異性抗原的特異性細胞毒性T淋巴細胞,發揮有效的抗腫瘤免疫效應。腫瘤特異性CTL對腫瘤細胞的殺傷在腫瘤免疫應答中起著極為重要的作用[9]。由于腫瘤細胞表達的抗原肽水平較低,不易于被T淋巴細胞所識別,難以誘發腫瘤細胞的特異性殺傷。而CTL細胞的激活需要腫瘤抗原致敏和抗原遞呈細胞所提供的共刺激因子,DC作為功能最強大的抗原遞呈細胞,可以提供共刺激因子來誘導CTL的腫瘤殺傷作用。本實驗證實特異性抗原致敏的DC-CIK和DC-CTL對腫瘤細胞都有較強的殺傷作用,說明DC已經成功攝取了B16黑色素瘤細胞抗原遞呈給淋巴細胞激活了針對B16黑色素瘤的特異性殺傷作用。同時實驗表明DC-CTL的殺傷作用明顯高于DC-CIK,說明雖然特異性抗原致敏的DC-CIK有一定的殺傷能力,但可能由于腫瘤細胞的免疫逃避等因素使得總的殺傷效能較DC-CTL低,但其機制有待進一步的研究。同時促進腫瘤細胞的凋亡也是治療腫瘤的有效方法。此次實驗表明,特異性抗原致敏的DC-CIK和DC-CTL對腫瘤細胞都有明顯的誘導細胞凋亡的作用,兩者之間并沒有明顯的差異。一些研究表明CIK和CTL都通過Fas/FasL系統誘導細胞的凋亡,但具體的途徑尚不明了[10-11]。
本研究表明特異性抗原致敏的DC-CIK與DC-CTL細胞可以有效的殺傷B16黑色素瘤細胞并誘導瘤細胞凋亡,但DC-CTL的殺傷效能較DCCIK明顯增高,雖然其機制有待進一步研究,但仍然為臨床提供更為安全、有效的腫瘤免疫治療效應細胞提供了一定的理論基礎。
[1]謝遵江,曹立敏,賀業春,等.體外培養小鼠樹突狀細胞的擴增鑒定及形態學觀察[J].解剖科學進展,2005,11(3)240
[2]Hishii M,Kurnick JT,Ramiraz T,et al.Studies of zhe mechanism of cytolysis by tumor-infiltrating lymphocytes[J].Clin Exp Immunol, 1999,116(3):388
[3] Bachleinter T,Stift A,Friedl J,et al.Stimulation of autologous antitumor T-CELL responses against medullary thyroid carcinoma using tumor lysate-pulsed dendritic cells[J].J Clin Endocrinol Metabol,2002,87(3):1098
[4] Leemhuis T,Wells S,Scheffold C,et al.A phase I trial of autologous cytokine-induced killer cells for the treatment[J].Biol Blood Marrow Transplate,2005,11(3):181
[5] Liebrich W,Schlag P,Manasterski M,et al.In vitro and clinical characterization of a Newcastle disease virus-modified autologous tumor cell vaccine for treatment of colorectal cancer patients[J]. Eur J Cancer,1991,27(6):708
[6] Marten A,Renoth S,Toal M,et al.Enhanced lytic activity of cytokine-induced killer cells against multiple myeloma cells after co-culture with idiotype-pulsed dendritic cells[J].Haematologica, 2001,86(10):1029
[7]Zoll B,Lefterova P,Ebert O,et al.Modulation of cell surface markers on NK-like T lymphocytes by using IL-2,IL-7or IL-12in vitro stimulation[J].Cytokine,2000,12(9):1385
[8]Geroea F,Bajdani B,Nisii C,et al.Reciprocal activating interaction between natural killer cells and dendritic cells[J].Exp Med,2002, 195(3):327
[9]Syme R,Gluck S.Generation of dendritic cells:role of cytokines and potential clinical application[J].Official J Eur Society FOR Haemapheresis,2001,24:117
[10]Panther E,Corinti S,Ldzko M,et al.Adenosine affects expression of membrane molecules,cytokine and chemokine release,and the T-cell stimulatory capacity of human dendritic cells[J].Blood,2003, 101(15):3598
[11]Gabriele L,Borghi P,Rozera,et al.TNF-alpha promotes the rapid differentiation monocytesfrom pqtientswith chronicmyeloid leukom into activated dendritic cells tumed to undergo full maluration LPS treatment[J].Blood,2004,103(3):980

