侵襲性牙周炎與慢性牙周炎病變位點(diǎn)中人巨細(xì)胞病毒的定量檢測(cè)
李瀟 孫欽峰 孫允東 葛少華 楊丕山
(1.山東大學(xué)口腔醫(yī)院 牙周科,山東省口腔生物醫(yī)學(xué)重點(diǎn)實(shí)驗(yàn)室;2.山東大學(xué)醫(yī)學(xué)院 醫(yī)學(xué)微生物學(xué)教研室,濟(jì)南 250012)
侵襲性牙周炎與慢性牙周炎病變位點(diǎn)中人巨細(xì)胞病毒的定量檢測(cè)
李瀟1孫欽峰1孫允東2葛少華1楊丕山1
(1.山東大學(xué)口腔醫(yī)院 牙周科,山東省口腔生物醫(yī)學(xué)重點(diǎn)實(shí)驗(yàn)室;2.山東大學(xué)醫(yī)學(xué)院 醫(yī)學(xué)微生物學(xué)教研室,濟(jì)南 250012)
目的 應(yīng)用實(shí)時(shí)熒光定量PCR方法檢測(cè)侵襲性牙周炎(AgP)及慢性牙周炎(CP)患者齦下樣本中人巨細(xì)胞病毒(HCMV)的DNA載量,探討HCMV感染與牙周炎之間的關(guān)系。方法 選擇18例AgP患者、24例CP患者及15例牙周健康對(duì)照者,收集齦下樣本114例。構(gòu)建含有HCMV高保守片段的重組質(zhì)粒,制備標(biāo)準(zhǔn)品DNA模板,建立并應(yīng)用SYBR GreenⅠ實(shí)時(shí)熒光定量PCR方法,檢測(cè)樣本中HCMV的DNA載量。結(jié)果 AgP病變位點(diǎn)、CP病變位點(diǎn)以及牙周健康位點(diǎn)中HCMV的陽(yáng)性檢出率分別為58.3%、41.7%和6.7%。AgP和CP病變位點(diǎn)中HCMV的陽(yáng)性檢出率顯著高于牙周健康位點(diǎn)(P<0.01)。在AgP病變位點(diǎn)中,病毒載量在104以上的位點(diǎn)占33.3%,明顯高于CP病變位點(diǎn)的10.4%,兩組之間的差異具有統(tǒng)計(jì)學(xué)意義(P<0.05)。結(jié)論 HCMV感染與牙周炎的發(fā)生發(fā)展密切相關(guān),其活動(dòng)性感染可能與AgP組織破壞的迅速進(jìn)展有關(guān)。
人巨細(xì)胞病毒; 侵襲性牙周炎; 慢性牙周炎
牙周炎是一種慢性感染性疾病,其發(fā)生發(fā)展受到多種因素的影響。存在于菌斑生物膜中的牙周可疑致病菌及其產(chǎn)物是引發(fā)牙周疾病的始動(dòng)因子。然而,單純的細(xì)菌感染學(xué)說(shuō)不能很好地解釋牙周組織破壞局限化及陣發(fā)性破壞加速等現(xiàn)象。近年來(lái),學(xué)者[1]提出某些皰疹病毒可能與牙周炎的發(fā)病有關(guān),牙周局部組織的皰疹病毒感染可以在一定程度上解釋牙周炎的某些臨床表現(xiàn)。其中,人巨細(xì)胞病毒(human cytomegalovirus,HCMV)被認(rèn)為是與牙周炎關(guān)系最為密切的一種皰疹病毒。由于不同種族人群病毒感染情況存在差異,以及研究者選用的檢測(cè)方法不同,導(dǎo)致各研究機(jī)構(gòu)的HCMV檢測(cè)結(jié)果存在較大差異[2-3]。HCMV與牙周炎之間的關(guān)系尚存在爭(zhēng)議,需要進(jìn)一步研究探討。侵襲性牙周炎(aggressive periodontitis,AgP)和慢性牙周炎(chronic periodontitis,CP)是臨床表現(xiàn)和實(shí)驗(yàn)室檢查均有明顯差異的2種牙周炎[4],HCMV DNA載量在AgP和CP的病變位點(diǎn)中是否存在差異目前尚未明確。本實(shí)驗(yàn)應(yīng)用SYBR GreenⅠ熒光定量PCR方法,對(duì)AgP及CP病變位點(diǎn)的齦下樣本進(jìn)行HCMV定量檢測(cè),旨在進(jìn)一步探討HCMV與這2種不同類型牙周炎之間的關(guān)系。
1 材料和方法
1.1 研究對(duì)象
依據(jù)1999年牙周病分類法國(guó)際研討會(huì)對(duì)AgP及CP所制定的診斷標(biāo)準(zhǔn)[5],在山東大學(xué)口腔醫(yī)院牙周科就診的初診患者中選擇AgP及CP患者共42例。其中AgP患者18例,年齡19~35歲,男8例,女10例;CP患者24例,年齡41~65歲,男15例,女9例。15例牙周健康對(duì)照者來(lái)自山東大學(xué)口腔醫(yī)院職工和來(lái)牙周科常規(guī)檢查的志愿者,年齡22~45歲,男7例,女8例。所有受試者的共同納入要求為:1)無(wú)明顯的錯(cuò)畸形,余留牙不少于20顆;2)近1年內(nèi)未接受過(guò)牙周治療,3個(gè)月內(nèi)未服用過(guò)抗生素;3)全身無(wú)糖尿病、心血管疾病等系統(tǒng)性疾病,女性非妊娠期或哺乳期;4)無(wú)吸煙史。健康對(duì)照者全口牙周檢查探診深度(probing depth,PD)小于等于3mm,無(wú)附著喪失(attachment loss,AL),出血指數(shù)(bleeding index,BI)大于等于2的位點(diǎn)不超過(guò)10%。
本研究經(jīng)山東大學(xué)口腔醫(yī)院倫理委員會(huì)批準(zhǔn),受試者均知情同意。
1.2 臨床觀察指標(biāo)
檢查并記錄所有受試者的全口牙周狀況,包括菌斑指數(shù)(plaque index,PLI)、PD、AL、BI、松動(dòng)度以及根分叉病變情況,并拍攝全口曲面斷層片。
1.3 齦下標(biāo)本的采集與處理
牙周炎患者各以2顆病變較重的磨牙為觀察牙,選擇其探診深度最深的位點(diǎn)作為取樣位點(diǎn),取樣位點(diǎn)排除頸部齲壞及充填體等局部刺激因素,并滿足PD大于等于5mm,AL大于等于3mm,探診出血(+)。健康對(duì)照者選擇2顆第一磨牙的近中頰側(cè)位點(diǎn)為取樣位點(diǎn),要求PD小于等于3mm,無(wú)附著喪失,探診出血(-)。采用無(wú)菌刮治器收集齦下菌斑樣本,將取樣位點(diǎn)隔濕后,先用消毒棉球?qū)l上菌斑清除,并用氣槍吹干牙面,用無(wú)菌刮治器從取樣位點(diǎn)牙周袋最底部刮取齦下菌斑,置于EP管中,加入200μL TE緩沖液,充分振蕩混勻,-80℃冰箱保存?zhèn)溆谩J占凝l下樣本共114例。
1.4 齦下樣本DNA抽提
采用小量病毒核酸抽提試劑盒(上海華舜生物工程有限公司)抽提樣本DNA。紫外分光光度計(jì)檢測(cè)DNA質(zhì)量濃度和純度,所有樣本DNA質(zhì)量濃度統(tǒng)一稀釋至100 ng·μL-1,-20℃保存?zhèn)溆谩?/p>
1.5 標(biāo)準(zhǔn)品來(lái)源
HCMV由山東大學(xué)醫(yī)學(xué)院微生物學(xué)教研室提供,用作陽(yáng)性標(biāo)準(zhǔn)品樣品;EB病毒(Epstein-Barr virus,EBV)及牙齦卟啉單胞菌(Porphyromonas gingivalis,P.gingivalis)、具核梭桿菌(Fusobacterium nucleatum,F(xiàn).nucleatum)標(biāo)準(zhǔn)菌株分別由青島大學(xué)醫(yī)學(xué)院微生物學(xué)教研室和四川大學(xué)口腔疾病研究國(guó)家重點(diǎn)實(shí)驗(yàn)室提供,以上病原體均作為特異性實(shí)驗(yàn)陰性對(duì)照品,DNA抽提同1.4所述。
1.6 標(biāo)準(zhǔn)品DNA模板的制備
選取HCMV高保守序列設(shè)計(jì)特異性引物[6],正鏈引物序列為5’-GCGTGCTTTTTAGCCTCTGCA-3’,負(fù)鏈引物序列為5’-AAAAGTTTGTGCCCCAACGGTA-3’,由上海博尚生物技術(shù)有限公司合成。以HCMV DNA為模板行常規(guī)聚合酶鏈反應(yīng)(poly-merase chain reaction,PCR),擴(kuò)增所得的151 bp特異性片段克隆于pMD19-T載體(TaKaRa公司,日本),重組質(zhì)粒經(jīng)PCR鑒定后送交測(cè)序。用高純質(zhì)粒小量制備試劑盒(北京百泰克生物技術(shù)有限公司)純化質(zhì)粒DNA,紫外分光光度計(jì)定量后換算為拷貝數(shù),連續(xù)10倍梯度稀釋,制備(1×100~1×108)copies·mL-1的標(biāo)準(zhǔn)品DNA模板,建立HCMV的定量標(biāo)準(zhǔn)。
1.7 熒光定量PCR反應(yīng)體系的建立
采用SYBR GreenⅠ實(shí)時(shí)熒光定量PCR方法,反應(yīng)體系使用TaKaRa公司的SYBR Premix Ex TaqⅡ試劑。反應(yīng)總體積20μL,其中樣品DNA模板2μL,SYBR Premix Ex TaqⅡ(2×)10μL,正負(fù)鏈引物(5μmol·L-1)各0.8μL,ROX Reference Dye(50×)0.4μL,滅菌去離子水補(bǔ)齊20μL反應(yīng)體系。使用ABI7000熒光定量PCR儀進(jìn)行PCR擴(kuò)增。擴(kuò)增條件:95℃預(yù)變性30 s,95℃變性5 s,62℃退火31 s,共40個(gè)循環(huán)。循環(huán)結(jié)束后附加熔解曲線分析。敏感性、特異性及穩(wěn)定性檢測(cè):分別取(1×100~1×108)copies·mL-1的陽(yáng)性標(biāo)準(zhǔn)品DNA 2μL,按上述條件進(jìn)行敏感性檢測(cè);以齦下樣本中常見(jiàn)的病原體HCMV、EBV、P.gingivalis、F.nucleatum以及正常人基因組的DNA為模板,按上述條件進(jìn)行特異性檢測(cè);選擇3個(gè)低濃度的陽(yáng)性標(biāo)準(zhǔn)品DNA為模板,批內(nèi)及批間各重復(fù)檢測(cè)3次,以評(píng)價(jià)該反應(yīng)體系的穩(wěn)定性。
1.8 齦下樣本的檢測(cè)
將待測(cè)齦下樣品DNA模板和標(biāo)準(zhǔn)品在同一定量PCR體系中完成檢測(cè)。根據(jù)出現(xiàn)S型擴(kuò)增曲線及循環(huán)閾值(Ct值)小于等于37判斷陽(yáng)性結(jié)果,根據(jù)熔解曲線峰值判斷是否為特異性擴(kuò)增,由ABI7000 Real-Time PCR System隨機(jī)軟件自動(dòng)生成模板濃度(Log C0)與曲線Ct值之間的標(biāo)準(zhǔn)曲線,并依據(jù)標(biāo)準(zhǔn)曲線自動(dòng)給出每個(gè)樣本的DNA拷貝數(shù)。
1.9 統(tǒng)計(jì)分析
采用SPSS 17.0軟件進(jìn)行統(tǒng)計(jì)學(xué)分析,檢出率采用卡方檢驗(yàn)。
2 結(jié)果
2.1 陽(yáng)性標(biāo)準(zhǔn)品DNA模板的獲得
成功克隆并獲得含有目的片段的重組質(zhì)粒,測(cè)序結(jié)果正確,可用作陽(yáng)性標(biāo)準(zhǔn)品DNA模板。
2.2 反應(yīng)敏感性、特異性及穩(wěn)定性檢測(cè)
敏感性檢測(cè)結(jié)果表明:隨著模板量的梯度減少,擴(kuò)增曲線的Ct值逐漸增大,檢測(cè)的底線為1×102copies·mL-1。特異性檢測(cè)結(jié)果表明:HCMV陽(yáng)性模板可見(jiàn)陽(yáng)性擴(kuò)增曲線,熔解曲線分析可見(jiàn)在87℃附近有一特異性峰值,EBV、P.gingivalis、F.nucleatum以及正常人基因組DNA均未見(jiàn)陽(yáng)性擴(kuò)增曲線,熔解曲線分析見(jiàn)以上陰性對(duì)照均顯示為一條低平無(wú)峰曲線。穩(wěn)定性實(shí)驗(yàn)結(jié)果表明:濃度分別為(1×102~1×104)copies·mL-1的標(biāo)準(zhǔn)品模板批內(nèi)及批間Ct值的變異系數(shù)均小于5%。
2.3 實(shí)時(shí)熒光定量PCR標(biāo)準(zhǔn)曲線分析
標(biāo)準(zhǔn)曲線分析結(jié)果(圖1)顯示:HCMV標(biāo)準(zhǔn)品Log C0與Ct值之間具有良好的線性關(guān)系(R2>0.99)。
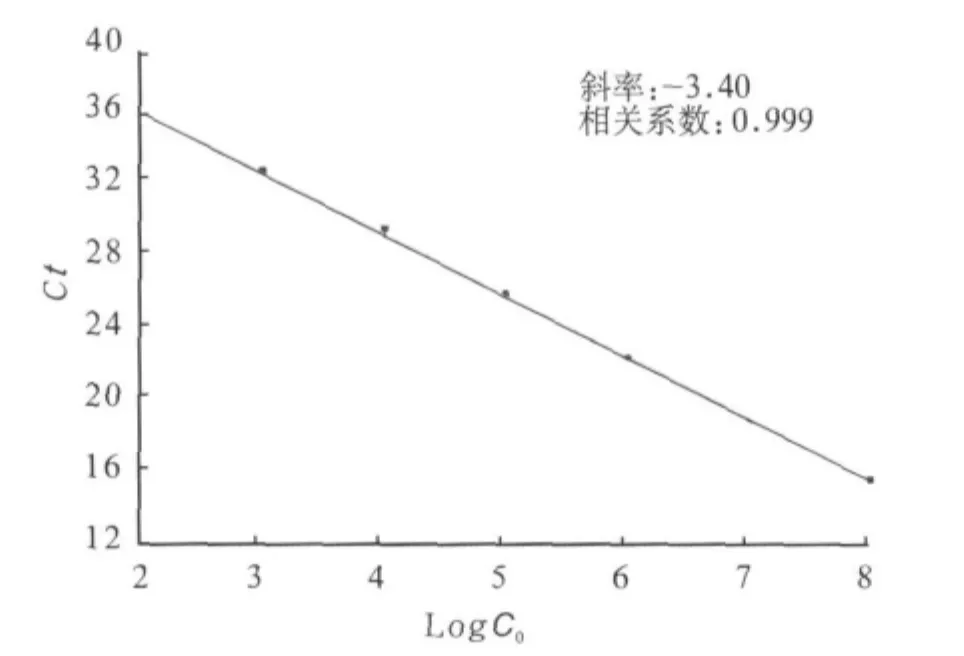
圖1 HCMV實(shí)時(shí)熒光定量PCR標(biāo)準(zhǔn)曲線Fig 1 Standard curve for HCMV fluorescent quantitative realtime PCR
2.4 齦下樣本實(shí)時(shí)熒光定量PCR檢測(cè)結(jié)果
實(shí)時(shí)熒光定量PCR檢測(cè)結(jié)果顯示:AgP病變位點(diǎn)、CP病變位點(diǎn)以及牙周健康位點(diǎn)中HCMV的陽(yáng)性檢出率分別為58.3%、41.7%和6.7%(表1)。AgP和CP病變位點(diǎn)中HCMV的陽(yáng)性檢出率顯著高于牙周健康位點(diǎn)(P<0.01),而AgP病變位點(diǎn)與CP病變位點(diǎn)之間無(wú)統(tǒng)計(jì)學(xué)差異(P>0.05)。HCMV載量在不同類型牙周位點(diǎn)中的分布情況見(jiàn)表1、2,在AgP病變位點(diǎn)中,病毒載量在104以上的位點(diǎn)占33.3%(12/36),明顯高于CP病變位點(diǎn)的10.4%(5/48),兩組之間的差異具有統(tǒng)計(jì)學(xué)意義(P<0.05)。

表1 牙周炎病變位點(diǎn)和牙周健康位點(diǎn)中HCMV陽(yáng)性檢出率及病毒載量范圍Tab 1 Prevalence and quantity of HCMV in periodontitis sites and healthy controls
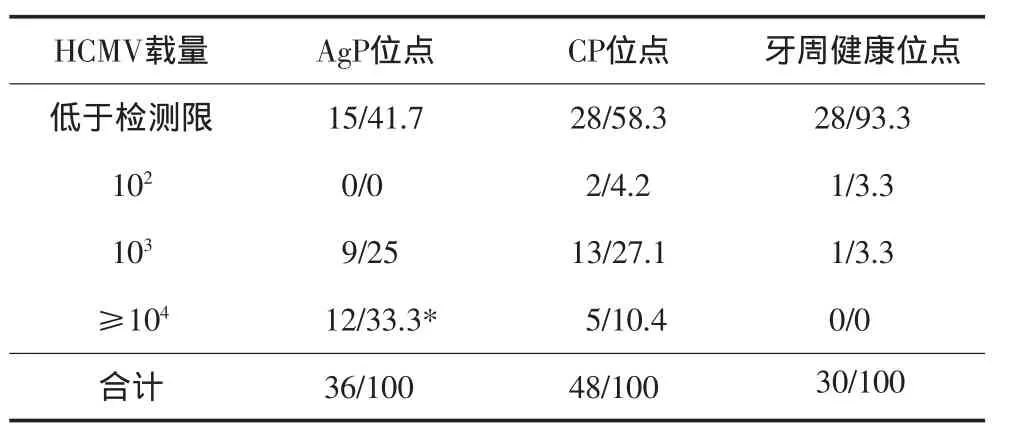
表2 HCMV載量在牙周炎病變位點(diǎn)和牙周健康位點(diǎn)中的分布情況Tab 2 Distribution of HCMV load in periodontitis sites and healthy controls n/%
3 討論
HCMV初次感染后,通常以無(wú)癥狀狀態(tài)潛伏在健康人體中,在一定條件下,病毒激活并增殖,釋放病毒顆粒,損傷機(jī)體細(xì)胞并改變細(xì)胞的炎癥反應(yīng)模式,繼而引起癥狀。HCMV的這種致病模式與牙周炎呈陣發(fā)性破壞加速的特點(diǎn)十分相似,所以近年來(lái)愈來(lái)愈受到牙周病學(xué)領(lǐng)域?qū)<壹皩W(xué)者的關(guān)注[1-3]。病毒載量的高低直接關(guān)系到此病毒在疾病中的致病效應(yīng)及疾病的嚴(yán)重程度,因此對(duì)牙周病變位點(diǎn)中的HCMV進(jìn)行定量檢測(cè),可以更深入地了解病毒與牙周病之間的關(guān)系。
以SYBR GreenⅠ作為熒光指示劑的實(shí)時(shí)熒光定量PCR方法是近年才發(fā)展成熟的一種病毒檢測(cè)方法,現(xiàn)已廣泛應(yīng)用于病毒DNA或RNA載量的檢測(cè)[7]。本研究以HCMV高保守序列為靶基因設(shè)計(jì)特異性引物,并對(duì)引物濃度及退火溫度等擴(kuò)增條件進(jìn)行優(yōu)化,消除了引物二聚體對(duì)結(jié)果的影響,建立了一種適用于檢測(cè)牙周標(biāo)本中HCMV的SYBR GreenⅠ熒光定量PCR方法。特異性檢測(cè)結(jié)果顯示:除HCMV陽(yáng)性標(biāo)準(zhǔn)品出現(xiàn)擴(kuò)增曲線和特異性溶解曲線峰外,其他在牙周病變位點(diǎn)中常見(jiàn)的病毒及細(xì)菌DNA均表現(xiàn)為陰性結(jié)果。敏感性檢測(cè)結(jié)果顯示:隨著模板量的梯度減少,擴(kuò)增曲線的Ct值逐漸增大,檢測(cè)底線為1×102copies·mL-1。穩(wěn)定性實(shí)驗(yàn)結(jié)果顯示:該方法批內(nèi)和批間的Ct值變異系數(shù)均小于5%。以上結(jié)果說(shuō)明本研究建立的方法具有良好的特異性、敏感性和穩(wěn)定性,能夠滿足少量牙周齦下標(biāo)本中HCMV的檢測(cè),為臨床大樣本深入研究HCMV在牙周炎發(fā)病中的作用奠定了實(shí)驗(yàn)基礎(chǔ)。
AgP在好發(fā)人群、病因及臨床表現(xiàn)等方面均不同于CP[4]。AgP以發(fā)病年齡低、病程進(jìn)展迅速為特點(diǎn),并可造成嚴(yán)重的牙周附著喪失和牙槽骨破壞。其病因非常復(fù)雜,除細(xì)菌感染、遺傳因素、宿主免疫狀態(tài)外,病毒感染也可能起到一定作用。本研究檢測(cè)結(jié)果顯示:與牙周健康位點(diǎn)相比,AgP和CP病變位點(diǎn)中均有較高的HCMV陽(yáng)性檢出率,這說(shuō)明HCMV感染與牙周炎的發(fā)生發(fā)展密切相關(guān)。而Nibali等[3]采用熒光定量PCR方法在牙周炎患者齦下標(biāo)本中未檢測(cè)到HCMV,因而對(duì)HCMV在牙周炎中的致病作用提出質(zhì)疑。分析導(dǎo)致各研究機(jī)構(gòu)HCMV檢測(cè)結(jié)果之間存在較大差異的原因可能與不同國(guó)家人種、生活習(xí)慣以及采用的檢測(cè)方法不一致有關(guān)。重要的是,本研究發(fā)現(xiàn);雖然AgP與CP中HCMV的檢出率無(wú)明顯差異,但二者的HCMV DNA載量存在明顯不同。AgP患者病變位點(diǎn)中的HCMV載量可高達(dá)1.62×105copies·mL-1;高拷貝的病毒DNA檢出率顯著高于牙周健康位點(diǎn),也明顯高于慢性牙周炎病變位點(diǎn)。Botero等[2]發(fā)現(xiàn):大部分病程進(jìn)展緩慢的慢性牙周炎病變位點(diǎn)處于HCMV的潛伏感染狀態(tài)而不是病毒的活動(dòng)性感染。Ting等[8]研究顯示:在5例X線片表現(xiàn)為硬骨板消失的局限型侵襲性牙周炎病變位點(diǎn)中全部可以檢測(cè)到HCMV主要衣殼蛋白轉(zhuǎn)錄產(chǎn)物的cDNA,從而認(rèn)為HCMV的活動(dòng)性感染在局限型AgP的活動(dòng)性病變中扮演了重要角色。Kamma等[9]也發(fā)現(xiàn)HCMV感染與處于維護(hù)期治療的AgP活動(dòng)性位點(diǎn)相關(guān)。丁芳等[10]也通過(guò)研究證明AgP患者HCMV檢出率顯著高于健康對(duì)照者,提示齦下皰疹病毒的存在與侵襲性牙周炎相關(guān)。本研究結(jié)果與上述研究相符,并進(jìn)一步通過(guò)定量檢測(cè)的方法比較了AgP與CP病變位點(diǎn)之間的病毒拷貝水平,結(jié)果提示:在AgP的病變位點(diǎn)中,HCMV處于活躍的增殖狀態(tài),HCMV的活動(dòng)性感染可能與廣泛型AgP牙周組織破壞的迅速進(jìn)展密切相關(guān)。HCMV活動(dòng)性感染與AgP進(jìn)展相關(guān)可能與以下因素有關(guān):1)HCMV的活動(dòng)性感染可能導(dǎo)致牙周組織局部短暫的免疫抑制,使宿主對(duì)牙周致病菌的抵抗力下降,從而導(dǎo)致牙周可疑致病菌的大量繁殖,加速了牙周組織破壞的進(jìn)程;2)HCMV活躍增殖可能直接破壞牙周組織細(xì)胞;3)HCMV可能通過(guò)誘導(dǎo)能夠激活破骨細(xì)胞和基質(zhì)金屬蛋白酶的促炎癥因子的釋放,進(jìn)一步加重牙周組織的破壞。但是,AgP病變位點(diǎn)中高拷貝HCMV活躍增殖的具體機(jī)制目前尚不明確,患者個(gè)體因素、局部及全身的T細(xì)胞免疫狀況是否在其中起到作用還有待進(jìn)一步證實(shí)。
本研究表明:HCMV感染與牙周炎發(fā)生發(fā)展密切相關(guān),其活動(dòng)性感染可能與AgP牙周組織的快速破壞有關(guān)。本研究建立的SYBR GreenⅠ實(shí)時(shí)熒光定量PCR方法具有良好的特異性和靈敏性,可以用于HCMV與牙周炎發(fā)生發(fā)展關(guān)系的臨床大樣本研究。
[1] Slots J.Herpesviruses in periodontal diseases[J].Periodontol 2000, 2005,38:33-62.
[2] Botero JE,Vidal C,Contreras A,et al.Comparison of nested polymerase chain reaction(PCR),real-time PCR and viral culture for the detection of cytomegalovirus in subgingival samples[J]. Oral Microbiol Immunol,2008,23(3):239-244.
[3] Nibali L,Atkinson C,Griffiths P,et al.Low prevalence of subgingival viruses in periodontitis patients[J].J Clin Periodontol, 2009,36(11):928-932.
[4] Armitage GC,Cullinan MP.Comparison of the clinical features of chronic and aggressive periodontitis[J].Periodontol 2000,2010, 53:12-27.
[5] Armitage GC.Development of a classification system for periodontal diseases and conditions[J].Ann Periodontol,1999,4(1):1-6.
[6] Correia-Silva JF,Bruna-Romero O,Resende RG,et al.Saliva as a source of HCMV DNA in allogeneic stem cell transplantation patients[J].Oral Dis,2010,16(2):210-216.
[7] Segura MM,Monfar M,Puig M,et al.A real-time PCR assay for quantification of canine adenoviral vectors[J].J Virol Methods, 2010,163(1):129-136.
[8] Ting M,Contreras A,Slots J.Herpesvirus in localized juvenile periodontitis[J].J Periodontal Res,2000,35(1):17-25.
[9] Kamma JJ,Contreras A,Slots J.Herpes viruses and periodontopathic bacteria in early-onset periodontitis[J].J Clin Periodontol, 2001,28(9):879-885.
[10]丁芳,馮向輝,孟煥新,等.侵襲性牙周炎患者齦下菌斑中的皰疹病毒與牙周致病菌[J].北京大學(xué)學(xué)報(bào):醫(yī)學(xué)版,2008,40(3):318-322.
DING Fang,FENG Xiang-hui,MENG Huan-xin,et al.Relationship between herpesviruses and periodontal pathogenic bacteria in subgingival plaque[J].J Peking University:Health Sciences, 2008,40(3):318-322.
(本文編輯 李彩)
Quantitative detection of human cytomegalovirus in aggressive and chronic periodontitis lesions
LI Xiao1,SUN Qin-feng1,SUN Yun-dong2,GE Shao-hua1,YANG Pi-shan1.(1.Dept.of Periodontics,School of Stomatology,Shandong University;Shandong Provincial Key Laboratory of Oral Biomedicine,Jinan250012,China;2.Dept.of Microbiology,School of Medicine,Shandong University,Jinan250012,China)
ObjectiveTo establish a quantitative real-time PCR assay for the detection of human cytomegalovirus(HCMV)DNA load in subgingival specimens from the patients with aggressive and chronic periodontitis,and to investigate the relationship between HCMV infection and the periodontal status.MethodsA total of 114 subgingival plaque specimens were taken from 18 subjects with aggressive priodontiti(AgP),24 subjects with chronic periodontitis(CP)and 15 healthy control subjects.Standard quantification was performed with recombinant plasmid containing a conserved fragment of HCMV.The SYBR GreenⅠfluorescent quantitative real-time PCR assay was established based on positive plasmid.HCMV DNA load in the specimens were detected with quantitative real-time PCR based on SYBR GreenⅠfluorescence.Results HCMV were detected in 58.3%of AgP sites and 41.7%of CP sites,however, only 6.7%of periodontally-healthy sites were HCMV positive.The detection rate of HCMV in periodontitis lesions was significantly higher than in periodontal health(P<0.01).High copy-counts more than 104of HCMV were detected in 33.3%of AgP sites,which were significantly higher than in CP sites(10.4%)(P<0.05).ConclusionSubgingival infection with HCMV is closely associated with periodontitis.Active HCMV infection may be related to the rapid tissue destruction of AgP.
human cytomegalovirus; aggressive periodontitis; chronic periodontitis
R 781.4+2
A
10.3969/j.issn.1000-1182.2011.03.005
1000-1182(2011)03-0242-04
2010-09-23;
2010-11-10
李瀟(1984—),女,山東人,碩士
楊丕山,Tel:0531-88382368

