金絲桃苷對四氯化碳誘導肝細胞損傷的保護作用
(中國人民解放軍第三軍醫大學西南醫院藥學部,重慶 400038)
肝臟損傷是指由多種有害因子和物質引起的肝臟病理和生理異常,每年因肝病死亡的人數約為30萬人,但目前尚無可有效減輕肝臟損傷和促進肝細胞再生的藥物。金絲桃苷(hyperin,HP)廣泛存在于藤黃科、杜鵑花科、豆科及衛矛科等多種植物的黃酮醇苷化合物中,已在20多種植物中被發現。藥理研究表明,金絲桃苷具有較好的鎮痛、免疫調節等作用,以及較強的抗氧化作用,本研究旨在探討金絲桃苷對四氧化碳(CCl4)誘導化學性肝細胞損傷的保護作用及其機制,現報道如下。
1 儀器與試藥
722s型分光光度計(上海精密科學儀器有限公司);450型酶標儀(美國Bio-Rad公司)。金絲桃苷(中國藥品生物制品檢定所,批號為111521-200303);CCl4購于Sigma公司;天門冬酸氨基轉移酶(AST)、丙氨酸氨基轉移酶(ALT)、丙二醛(MDA)和超氧化物歧化酶(SOD)測定試劑盒(南京建成生物工程研究所,批號分別為20070312,20070402,20071029,20071010);噻唑藍(Amresco 公司,北京拜爾迪生物公司分裝);二甲基亞砜(DMSO,天津化學試劑有限公司)。
2 方法與結果
2.1 誘導肝細胞損傷所需CCl4適宜濃度的確定
取對數生長期L-02人肝細胞,消化后用RPMI-1640培養液調整細胞密度為5×104/mL,肝細胞活力大于90%。加入96孔培養板中,每孔100 μL細胞懸液,于37℃及5%CO2培養箱中培養24 h,肝細胞全部貼壁生長后待用。以CCl4原液4.82 mL溶于DMSO 5.18 mL,制成5 mol/L的CCl4液,以含 10%胎牛血清的 RPMI-1640 液稀釋配成含 2.5,5.0,10.0,15.0,20.0,30.0 mmol/L CCl4的溶液。加入96孔培養板,以無CCl4的RPMI-1640培養基為空白對照。每個濃度做5個平行孔,培養24 h后,以四甲基偶氮唑藍微量酶反應比色(MTT)法測肝細胞存活率。以空白對照為標準,CCl4濃度為2.5 mmol/L時,MTT檢測顯示肝細胞存活率為90.9%,顯微鏡下細胞形態改變不明顯。隨著CCl4濃度的升高,肝細胞存活率逐漸降低,且肝細胞逐漸出現核溶解、細胞膜破損、細胞結構不清。當CCl4濃度達到30.0 mmol/L時,肝細胞存活率僅為11.36%。最理想的CCl4造模濃度為 15.0 mmol/L,可較好地顯示CCl4肝細胞損傷與保護因子作用的差異。結果見表1。

表1 不同濃度CCl4損傷后肝細胞MTT檢測結果(n=5)
2.2 金絲桃苷對CCl4誘導肝細胞損傷的保護作用
調整細胞密度為5×105/mL,將肝細胞懸液加入96孔和24孔培養板中,于37℃及5%CO2培養箱中培養24 h后,肝細胞全部貼壁生長后供試驗用。設CCl4模型組(終濃度為15 mmol/L)、金絲桃苷(5,10,20,40,80,160 μg/mL)+CCl46 個處理組、空白對照組、維生素E(終濃度為50 μmol/L)+CCl4組,每組設3個復孔。分別加入CCl4、不同質量濃度的金絲桃苷、維生素E及培養液,繼續培養24 h后,收集24孔板中細胞培養液及細胞待測,同時用MTT法測定96孔板肝細胞的存活率。取肝細胞培養上清液,按試劑盒說明書,采用賴氏法測定ALT及AST。棄肝細胞培養液,加0.5 mL 1%Triton-100裂解細胞,充分吹打混勻后收集,2 500 r/min離心10 min,取上清,按試劑盒說明測定谷胱甘肽(GSH)、MDA含量測定。結果見表2及表3。CCl4誘導損傷肝細胞后,促進胞內酶的釋放,CCl4模型組培養上清液中的ALT及AST水平較正常明顯升高,肝細胞內MDA含量升高,GSH水平及肝細胞存活率明顯下降。隨著培養液中金絲桃苷質量濃度遞增,其肝細胞保護效應逐漸明顯,并呈明顯的劑量效應關系。80 μg/mL的金絲桃苷已能顯著抑制CCl4誘導損傷肝細胞后ALT及AST水平的上升,降低損傷肝細胞中MDA含量,顯著升高肝細胞內GSH水平及肝細胞存活率,且效應強度與維生素E對照組相當。
3 討論
3.1 CCl4誘導肝臟氧化性損傷實驗模型的選擇
金絲桃苷具有一定的抗氧化活性,為確定該活性是否有助于金絲桃苷在氧化性肝損傷中發揮保護作用。在大量查閱文獻的基礎上,決定選用CCl4作為肝臟致毒因素[1-2]。CCl4是經典的氧化性肝損傷致毒劑,其致毒機制:一是激活肝微粒體內依賴于CYP450的混合功能氧化酶,產生三氯甲基(-CCl3)、二氯甲基(-CCl2)和過氧化甲基(-CCl3OO)等自由基,致細胞DNA鍵斷裂,并引發膜脂質過氧化鏈式反應,導致MDA形成增多,肝細胞膜通透性增加,使位于細胞漿中及線粒體中的ALT與 AST釋放;二是可促進GSH等抗氧化物的消耗,導致氧自由基損傷進一步加重,最終使肝細胞死亡[3-4]。因此,采用CCl4制備體外肝細胞和大鼠肝損傷模型,可以較明確地反映金絲桃苷的抗氧化活性。

表2 金絲桃苷對CCl4損傷肝細胞培養上清液ALT及AST測定結果(U/L)
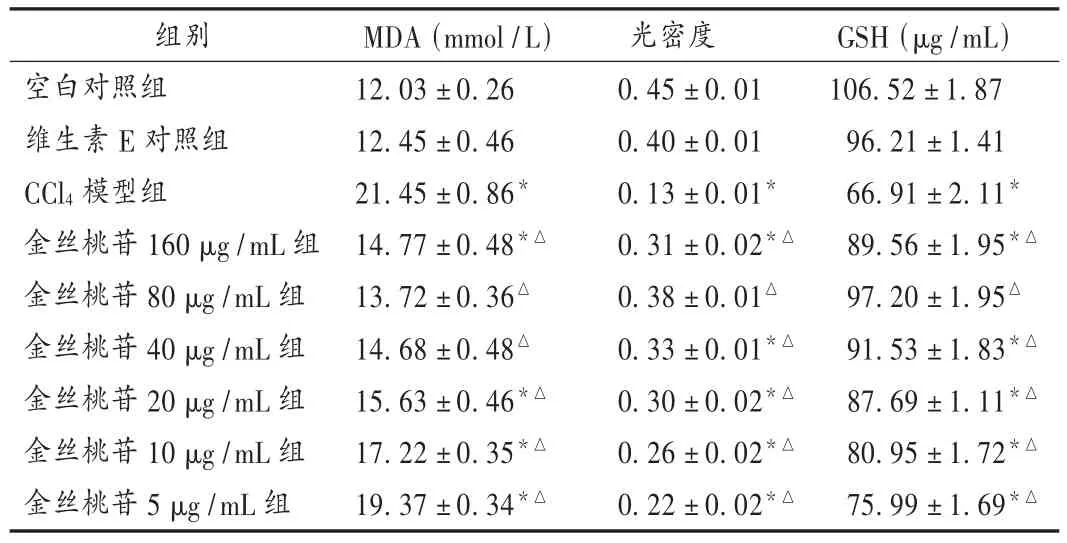
表3 金絲桃苷對CCl4損傷肝細胞MDA及細胞存活率的影響
3.2 金絲桃苷對CCl4誘導L-02人肝細胞損傷的保護作用
離體細胞試驗的影響因素相對較少,可控性強,能準確反映處理因素對CCl4誘導肝損傷的效應。試驗中對CCl4的致肝損傷劑量進行了摸索。目前文獻報道的肝細胞損傷的CCl4適宜終濃度在5~20 mmol/L不等[5-7],而找到適宜的造模濃度(既可有效誘導肝細胞損傷,又可較好反映保護劑的肝保護作用至關重要)。考察了CCl46 個濃度(2.5,5.0,10.0,15.0,20.0,30.0 mmol/L)的肝細胞損傷效應,結果CCl4濃度不高于10 mmol/L時,肝細胞損傷不明顯,細胞存活率大于60%,可能會夸大保護劑的保護作用;CCl4濃度不低于20 mmol/L時,肝細胞損傷變形嚴重,細胞存活率低于20%,無法準確反映保護作用。因此,最終確定15 mmol/L為最佳造模濃度。
采用體外培養人肝細胞株L-02的試驗結果顯示,金絲桃苷質量濃度在20 μg/mL到160 μg/mL范圍內對CCl4誘導肝細胞損傷的保護作用呈明顯的劑量效應關系,劑量為80 μg/mL時肝細胞保護作用已極顯著(P<0.01),細胞內MDA含量及其釋放AST和ALT明顯減少,胞內GSH含量和細胞活性則明顯提高,效應強度與維生素E對照組相當,表明金絲桃苷對CCl4所致肝細胞損傷具有顯著的保護作用。細胞中MDA的含量可反映脂質過氧化的程度,間接反映肝細胞的損傷程度,而GSH是機體清除-CCl3的關鍵物質,因此推測其保護機制可能與金絲桃苷的抗氧化作用密切相關。為獲得抗氧化的直接證據,課題組對金絲桃苷是否通過清除氧自由基、抑制脂質過氧化和減少脂質過氧化產物生成,從而達到保護肝細胞膜和線粒體膜的完整性的研究尚在進行中。
[1]徐 穎,馬 軼,陳 飛,等.金絲桃苷對培養的乳鼠心肌細胞的保護作用[J].沈陽藥科大學學報,2000,17(5):365-367.
[2]李慶林,陳志武,馬傳庚.金絲桃苷對原代培養的大鼠心肌細胞缺氧-再給氧損傷的影響[J].中草藥,2006,37(4):575-577.
[3]Clawson GA.Mechanisms of carbon tetrachloride hepatotoxicity[J].Pathol Immunopathol Res,1989,8(2):104-112.
[4]Boll M,Weber LW,Becker E,et al.Mechanism of carbon tetrachloride-induced hepatotoxicity.Hepatocellular damage by reactive carbon tetrachloride metabolites[J].Z Naturforsch C,2001,56(7-8):649-659.
[5]潘 勤,李定國,杜學良,等.生長抑素及奧曲肽的肝細胞保護作用及其機制研究[J].中國病理生理雜志,2008,24(4):730-733.
[6]焦 楊,段小群,林 興,等.玉郎傘多糖對四氯化碳誘導大鼠原代肝細胞損傷的保護作用[J].中國醫院藥學雜志,2006,26(11):1 333-1 335.
[7]陳 蕾,吳 皓,姚靜倩,等.珠蚌多糖對四氯化碳誘導肝細胞損傷的保護作用[J].中國海洋藥物雜志,2008,27(2):18-21.

