大腸桿菌色氨酸轉運系統多基因敲除對色氨酸生產的影響
趙志軍,陳晟,吳丹,吳敬,陳堅
1 江南大學 食品科學與技術國家重點實驗室,無錫 214122
2 江南大學生物工程學院 工業生物技術教育部重點實驗室,無錫 214122
L-色氨酸作為人體內的一種必需氨基酸,廣泛應用于醫藥、食品和飼料等行業[1]。工業上一般采用微生物發酵法生產色氨酸,其生產菌株的篩選主要是通過誘變或者基因工程的手段,去除色氨酸合成代謝中的各種反饋調控作用[2]。然而由于微生物合成色氨酸的代謝調控機制非常復雜,通過現有手段很難完全去除,此時其殘余的調控作用往往會阻礙色氨酸的進一步合成[3]。此類現象在其他氨基酸的菌種選育中也廣泛存在[4]。
針對以上情況,轉運系統工程為氨基酸生產菌株的選育提供了一種新的育種思路。轉運系統工程通過提高胞內氨基酸的分泌速率或者降低胞外氨基酸的吸收速率,使細胞內氨基酸濃度一直保持在較低水平,從而使氨基酸的反饋調控作用減弱或不起作用,最終達到高效生產某種氨基酸的目的[5]。近年來,關于賴氨酸、蘇氨酸和半胱氨酸等氨基酸轉運系統的研究表明,轉運系統工程可能會成為氨基酸生產菌株選育過程中規避殘余調控作用,高效積累目的氨基酸的一種重要的方法[6-9]。
大腸桿菌的色氨酸轉運系統分為分泌系統和吸收系統,其中關于色氨酸分泌系統的相關基因仍未得到完全鑒定[10-11],而色氨酸的吸收系統則相對受到了更多的關注[12-14]。大腸桿菌中主要由mtr、tnaB和aroP 3個基因編碼的通透酶參與調控色氨酸的吸收。其中AroP通透酶是芳香族氨基酸共用通透酶,還負責細胞對苯丙氨酸和酪氨酸的吸收;Mtr通透酶是高親和性的色氨酸專用通透酶;TnaB通透酶是低親和性的色氨酸專用通透酶[13]。本實驗室前期的研究發現色氨酸轉運系統mtr、tnaB和aroP 3個基因的單基因敲除均有利于大腸桿菌合成更多的色氨酸,其中mtr單基因的敲除對菌株生產色氨酸的促進作用最大,與對照菌相比色氨酸產量提高了約40% (數據另文發表)。本研究在mtr單基因敲除菌的基礎上,運用 Red重組技術分別構建了 mtr.tnaB和mtr.aroP雙基因敲除菌和mtr.tnaB.aroP三基因敲除菌,并通過發酵實驗著重考察了色氨酸轉運系統多基因敲除對大腸桿菌菌體生長及色氨酸生產的影響。
1 材料與方法
1.1 材料
1.1.1 菌株和質粒
出發菌株為色氨酸生產菌株大腸桿菌FB-T1/pSV03,其宿主菌FB-T1是大腸桿菌FB-02[15]的 mtr單基因敲除的衍生菌株,基因型為 W3110 (?trpR、?tnaA和?mtr)。質粒pSV03是帶有抗反饋調控作用的大腸桿菌色氨酸合成途徑關鍵酶基因aroF和trpED的低拷貝,且具有PR和PL雙啟動子的原核表達質粒[15]。菌株FB-T1/pSV03由實驗室前期通過基因工程手段構建。本研究以 FB-T1/pSV03為出發菌株,分別構建了mtr.tnaB和mtr.aroP雙基因敲除菌以及mtr.tnaB.aroP三基因敲除菌。敲除所需的工具質粒pKD13、pKD46和pCP20購自美國耶魯大學大腸桿菌菌株庫 (E. coli Genetic Stock Center,New Haven,USA)[16]。本研究中使用的菌株和質粒的具體特性見表1。
1.1.2 試劑和溶液
各種限制性內切酶、Taq DNA聚合酶、PrimeSTAR HS DNA聚合酶和T4 DNA連接酶購自寶生物工程 (大連) 有限公司;細菌質粒DNA抽提試劑盒、細菌基因組DNA抽提試劑盒、DNA凝膠回收試劑盒以及試劑氨芐青霉素 (Amp)、卡那霉素(Kan) 和 L-阿拉伯糖購自生工生物工程 (上海) 有限公司。
1.1.3 培養基和培養條件
種子培養基為LB培養基:10 g/L蛋白胨,10 g/L NaCl,5 g/L酵母膏。搖瓶發酵培養基的成分包括:3 g/L MgSO4·7H2O,0.015 g/L CaCl2·H2O,3 g/L KH2PO4,1 g/L NaCl,5 g/L (NH4)2SO4,0.07 g/L FeSO4·7H2O,0.1 g/L Na-Citrate,0.2 g/L酵母膏,20 g/L葡萄糖和 1.5 mL/L微量元素液 (2 g/L Al2(SO4)3·18H2O, 0.75 g/L CoSO4·7H2O,2.5 g/L CuSO4·5H2O,0.5 g/L H3BO3,2.4 g/L MnSO4·H2O,3 g/L Na2MoO4·2H2O,2.5 g/L NiSO4·6H2O,15 g/L ZnSO4·7H2O)。當在3 L發酵罐中進行分批發酵時,發酵培養基中的初始葡萄糖濃度降低至8 g/L,其余成分同搖瓶發酵培養基。
搖瓶發酵時,菌株在50 mL LB培養基中37 ℃培養8~10 h,按10% (V/V) 比例轉接至100 mL搖瓶發酵培養基中37 ℃振蕩培養,每隔4 h添加適量的濃氨水調節培養基pH值至pH 7.0~7.2。發酵罐發酵時,菌株在50 mL LB培養基中37 ℃培養8~10 h,按10% (V/V) 比例轉接至1.2 L發酵罐培養基中發酵。發酵初始溫度為33 ℃,當菌體生長至對數生長期前期時,升溫至38 ℃培養,誘導產色氨酸。當發酵液中初始葡萄糖基本耗盡時,開始流加500 g/L的葡萄糖溶液,并調控流速使發酵液中的葡萄糖濃度小于5 g/L。發酵過程中,通過流加濃氨水使培養基pH保持在6.8。
1.1.4 引物
根據大腸桿菌W3110的基因組序列,設計引物gene_p1和gene_p2,其中下劃線部分為目標基因上下游各50 bp的同源臂序列,以pKD13 DNA為模板,擴增 1 403 bp的目標基因打靶 DNA片段geneD50-Kan-geneD50。三對引物 gene_v1和 k1,k2和gene_v2,gene_v1和gene_v2分別用于鑒定目標基因的敲除,其中引物gene_v1和gene_v2分別是大腸桿菌W3110基因組中目標基因上游和下游的某段DNA序列,引物k1和k2分別為質粒pKD13中Kan基因內部序列[16]。本研究所用引物的DNA序列見表 2,引物的合成及相應的測序工作由生工生物工程 (上海) 有限公司完成。
1.2 方法
1.2.1 大腸桿菌基因的敲除
大腸桿菌基因的敲除參照文獻[16]。
1.2.2 胞外發酵代謝物的測定
發酵液中色氨酸濃度的測定參照文獻[15]。發酵液中的葡萄糖濃度由 SBA-40C生物傳感分析儀測定 (山東省科學院生物研究所)。發酵液中的菌體密度以在600 nm波長下分光光度計檢測的吸光值OD600表示,細胞干重根據前期構建的經驗公式獲得 (1 OD=0.492 g/L CDW)。

表1 菌株和質粒Table 1 Strains and plasmids

表2 本研究使用的引物Table 2 Primers used in this study
2 結果
2.1 mtr.tnaB雙基因敲除菌的構建
由于色氨酸合成關鍵酶的表達質粒pSV03和敲除用工具質粒pKD13都是Kan抗性標記,為避免質粒pSV03在基因敲除過程中產生不利影響,本研究首先在出發菌株FB-T1/pSV03的宿主菌FB-T1的基礎上進行色氨酸轉運系統多基因敲除菌的構建,進而通過質粒 pSV03轉化實驗獲得出發菌株FB-T1/pSV03的多基因敲除菌。以質粒pKD13 DNA為模板,利用引物tnaB_p1和tnaB_p2擴增得到的打靶PCR片段tnaBD50-Kan-tnaBD50,轉化至大腸桿菌 FB-T1/pKD46的感受態細胞中,同源重組后在Kan平板上初步篩選tnaB基因的敲除突變株。分別利用兩對引物tnaB_v1和k1,k2和tnaB_v2對tnaB敲除菌進行菌落PCR鑒定。根據序列分析,出發菌株不會獲得任何PCR片段,而 tnaB敲除菌經擴增后應分別獲得784 bp和991 bp的PCR片段。DNA凝膠電泳的結果與理論值相符,表明tnaB基因敲除成功 (圖1,泳道1~2)。將質粒pCP20轉化至tnaB基因敲除菌中,消除其Kan抗性基因,并利用引物tnaB_v1和tnaB_v2進行菌落PCR鑒定。根據序列分析,Kan基因消除后,PCR擴增應獲得643 bp的DNA片段。DNA凝膠電泳的結果與理論值相符 (圖1,泳道3)。將PCR片段連接至pMD18-T載體后送測序,測序結果驗證 tnaB基因敲除正確。命名mtr.tnaB敲除菌為FB-T2。
2.2 mtr. aroP雙基因和mtr. tnaB. aroP三基因敲除菌的構建

圖1 tnaB基因敲除菌的PCR鑒定Fig. 1 Identification of the tnaB knockout strain by PCR. M: DL 2 000 marker; 1: tnaB_v1→k1; 2: k2→tnaB_v2; 3: tnaB_v1→tnaB_v2.

圖2 aroP基因敲除菌的PCR鑒定Fig. 2 Identification of the aroP knockout strains by PCR. M: DL 2 000 marker; 1, 5: aroP_v1→k1; 2, 6: k2→aroP_v2; 3, 7: aroP_v1→aroP _v2.
在mtr單基因和mtr.tnaB雙基因敲除的基礎上,通過引物aroP_p1和aroP_p2擴增得到PCR片段aroPD50-Kan-aroPD50,用于菌株FB-T1和FB-T2基因組上aroP基因的敲除。利用兩對鑒定引物aroP_v1和k1,k2和aroP_v2分別進行兩種aroP基因敲除菌的PCR鑒定。DNA凝膠電泳的結果顯示兩種aroP基因敲除菌經PCR擴增后獲得的DNA片段大小均與理論值742 bp和961 bp相符 (圖2,泳道1~2為mtr.aroP 雙基因敲除菌的鑒定;泳道 5~6為mtr.tnaB.aroP三基因敲除菌的鑒定)。Kan基因消除后,利用引物aroP_v1和aroP_v2再次對兩種aroP基因敲除菌進行 PCR鑒定,電泳結果均與理論值571 bp相符 (圖2,泳道3為mtr.aroP雙基因敲除菌的鑒定;泳道7為mtr.tnaB.aroP三基因敲除菌的鑒定)。經測序證明兩種 aroP基因敲除均正確,從而分別獲得 mtr.aroP 雙基因敲除菌 FB-T3和mtr.tnaB.aroP三基因敲除菌FB-T4。
2.3 色氨酸基因工程菌的構建
將含有色氨酸合成關鍵酶基因的質粒 pSV03分別轉化至大腸桿菌色氨酸轉運系統多基因敲除菌 FB-T2、FB-T3和 FB-T4中,構建色氨酸基因工程菌 FB-T2/pSV03、FB-T3/pSV03和 FB-T4/ pSV03。
2.4 色氨酸基因工程菌的搖瓶發酵
為了初步考察大腸桿菌色氨酸轉運系統多基因敲除對菌株生產色氨酸的影響,本研究對出發菌株FB-T1/pSV03及構建的色氨酸工程菌FB-T2/pSV03、FB-T3/pSV03和 FB-T4/pSV03進行了搖瓶發酵實驗。由于菌體在利用發酵培養基中的葡萄糖之后,培養液中pH值將下降至pH 6以下,進而嚴重抑制菌體的生長及色氨酸合成,因此本實驗每隔4 h,利用濃氨水調節培養液中 pH值至 pH 7.0~7.2。如圖3A所示,與對照菌株相比,mtr.tnaB或者 mtr.aroP雙基因敲除對菌體的生長影響較小;但當3個色氨酸轉運基因mtr、tnaB和aroP均被敲除時,菌體的生長受到了明顯抑制。在色氨酸生產方面,mtr.tnaB雙基因敲除菌 FB-T2/pSV03的色氨酸產量為1.38 g/L,與對照菌株FB-T1/pSV03 (1.17 g/L) 相比提高了17%;mtr.aroP雙基因敲除菌FB-T3/pSV03的色氨酸產量為1.27 g/L,與對照菌株FB-T1/pSV03相比提高了 9%;而 mtr.tnaB.aroP三基因敲除菌FB-T4/pSV03生長緩慢,發酵過程中僅積累了0.63 g/L的色氨酸 (圖3B)。
2.5 色氨酸基因工程菌的補料分批發酵
由搖瓶發酵試驗得知,在構建的色氨酸轉運系統工程菌中,mtr.tnaB的雙基因敲除菌FB-T2/pSV03的產色氨酸能力最高,為了進一步考察其發酵生產色氨酸的潛力,本研究在3 L發酵罐中對出發菌株FB-T1/pSV03及 mtr.tnaB雙基因敲除菌 FB-T2/ pSV03進行了補料分批發酵實驗。如圖4所示,雖然在發酵罐中菌株FB-T2/pSV03的菌體生長滯后于對照菌FB-T1/pSV03,但在發酵過程中2個菌株最高可積累的生物量相近,分別為39.4 g/L和41.8 g/L (表3)。在色氨酸生產方面,菌株FB-T2/pSV03的發酵液中最高可以積累12.2 g/L色氨酸,與出發菌株FB-T1/pSV03 (9.6 g/L) 相比提高了 27%;菌株FB-T2/pSV03的葡萄糖轉化率為 9%,與對照菌FB-T1/pSV03 (6%) 相比提高 50% (表 3)。研究結果表明色氨酸轉運系統 mtr.tnaB雙基因敲除對菌體發酵生產色氨酸最為有利。
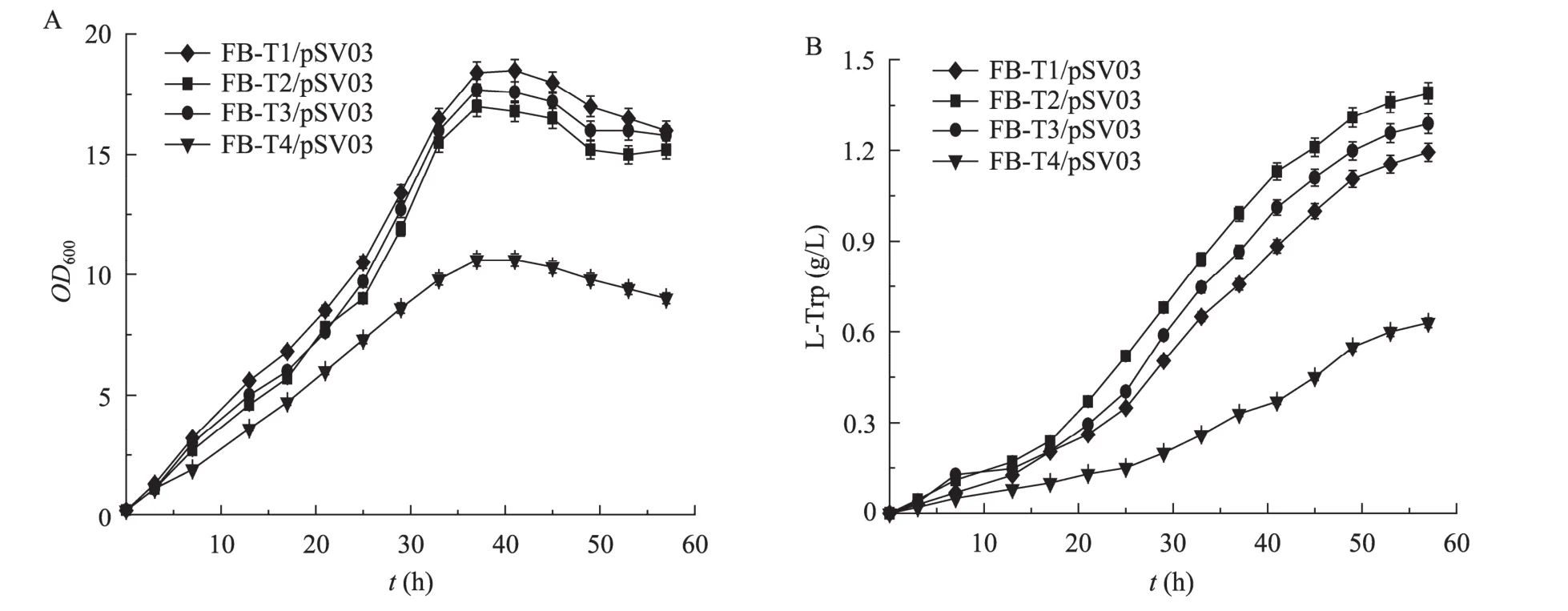
圖3 大腸桿菌FB-T1/pSV03色氨酸轉運系統多基因敲除菌的搖瓶發酵Fig. 3 Shake-flask fermentations of multi-gene knockout mutants of L-Trp transport system of E. coli FB-T1/pSV03. The data represent the ±s from three measurements.
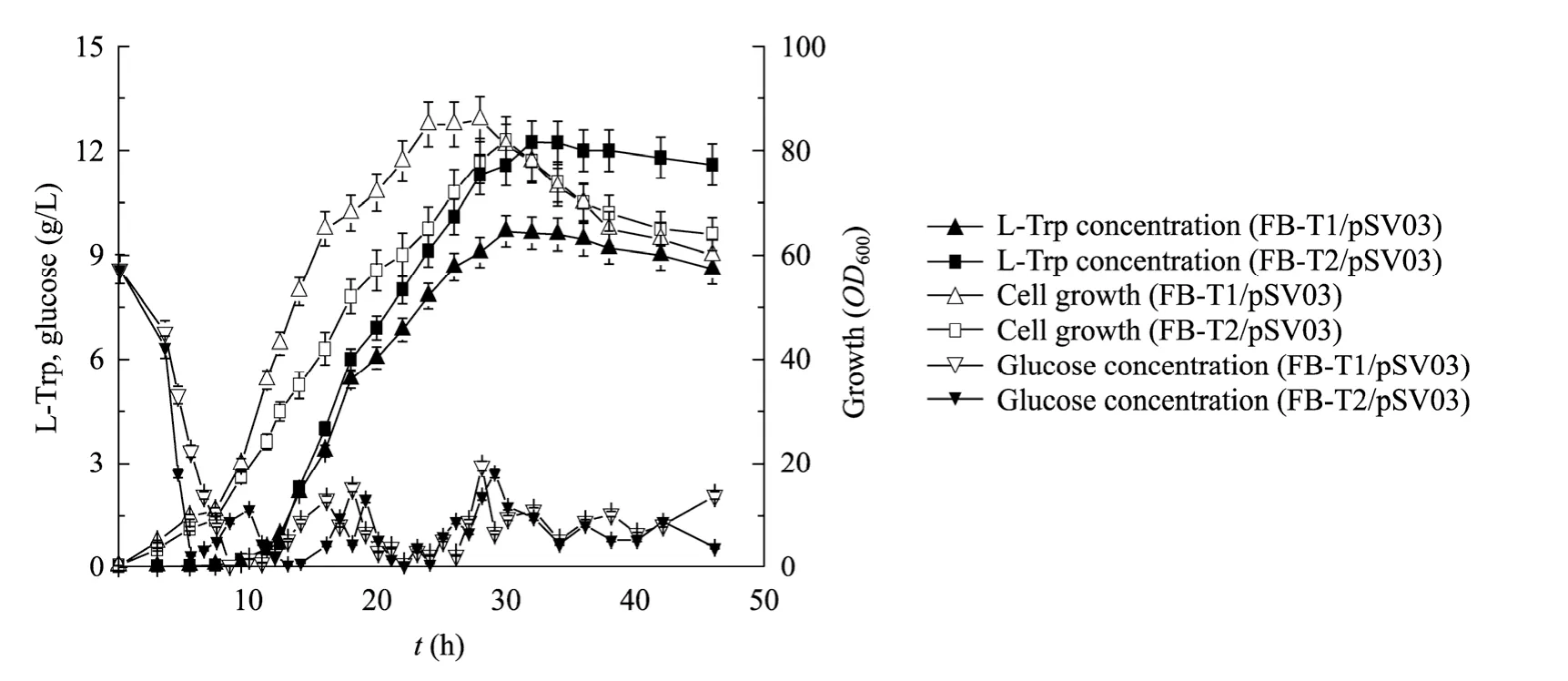
圖4 菌株FB-T1/pSV03和FB-T2/pSV03的分批發酵Fig. 4 Fed-batch fermentations of E. coli FB-T1/pSV03 and FB-T2/pSV03. The data represent the ±s from three measurements.

表3 大腸桿菌FB-T1/pSV03和FB-T2/pSV03分批補料發酵的參數比較Table 3 Comparison of fermentation parameters of E. coli FB-T1/pSV03 and FB-T2/pSV03
3 討論
在氨基酸合成途徑本身得到廣泛研究之后,轉運系統的改進被認為是今后氨基酸育種研究中的重要內容。但由于仍有許多氨基酸轉運系統的基因尚未得到鑒定,因此目前僅有少數文獻考察了轉運系統工程對相應氨基酸生物合成的影響[5]。就色氨酸而言,相關研究主要集中在谷氨酸棒桿菌上[12,14]。在谷氨酸棒桿菌中,色氨酸向胞內的轉運僅受到AroP通透酶的調控。Ikeda等以谷氨酸棒桿菌KY9225為出發菌株,通過誘變獲得了色氨酸吸收活性降低的 3株突變菌,其色氨酸產量與對照菌相比分別提高了 10%~20%,因此推測色氨酸吸收系統的受損有利于菌體的色氨酸合成[12]。但其不足之處是 Ikeda等[12]在色氨酸吸收系統突變菌的構建過程中多次采用了誘變的手段。由于誘變過程中往往會發生各種次級突變,無法確認這些次級突變是否也影響了菌體的色氨酸合成,進而也不能準確確定色氨酸吸收系統受損對色氨酸產量提高的貢獻量。在大腸桿菌方面,本實驗室在前期的研究中發現色氨酸轉運系統的單基因敲除均對菌體生產色氨酸有促進作用,其中 mtr單基因敲除的作用最大 (數據未顯示),但關于大腸桿菌轉運系統多基因缺失對菌株發酵生產色氨酸的影響仍未見報道。因此,本研究在mtr單基因敲除菌的基礎上,分別構建了mtr.tnaB和mtr.aroP雙基因敲除菌以及mtr.tnaB.aroP三基因敲除菌,著重考察了色氨酸轉運系統多基因敲除對菌株生產色氨酸的影響。結果表明,mtr.tnaB和mtr.aroP雙基因敲除均對菌體的生長影響較小,且mtr.tnaB和 mtr.aroP雙基因敲除菌的色氨酸產量與對照菌相比分別提高了17%和9%。在進一步的分批補料發酵實驗中 mtr.tnaB雙基因敲除菌最高可積累12.2 g/L的色氨酸,與對照菌相比提高了27%;此外,在獲得的相近菌體生物量的情況下,發酵過程中 mtr.tnaB雙基因敲除菌消耗了較少的葡糖糖,因此其葡萄糖轉化率達到 9%,與對照菌相比提高了50% (表3)。此外,由于本研究涉及的出發菌株及基因敲除菌均是通過基因工程手段構建而成,具有確定的基因組信息 (表 1),因此有助于準確反映色氨酸轉運系統受損對菌體生產色氨酸的影響,從而為色氨酸菌種的進一步改良提供依據。
值得注意的是,目前氨基酸轉運系統工程的研究仍然存在一些問題。例如,前期的研究發現過量表達某種氨基酸吸收基因會導致相應氨基酸的產量急劇下降[8,14],但當通過各種手段致使氨基酸吸收系統受損時,相應氨基酸的產量并沒有得到數倍的增長[12]。此外,在氨基酸分泌系統的研究中,盡管存在氨基酸分泌基因的過量表達促進相應氨基酸生產的實例[17-18],但研究中也發現個別氨基酸分泌基因的缺失對相應氨基酸的產量基本沒有影響[5,19]。這些問題一方面需要通過對氨基酸轉運機制的探索來尋找原因,但另一個不可忽視的方面是,受制于許多氨基酸轉運基因尤其是分泌基因尚未得到鑒定,目前大多數的相關研究都單獨對氨基酸吸收系統或者分泌系統進行考察,而氨基酸轉運系統作為一個有機整體,是其吸收系統和分泌系統的共同作用決定了微生物細胞內的氨基酸濃度,并最終影響了相應氨基酸的生物合成。因此,隨著越來越多的氨基酸轉運基因尤其是氨基酸分泌基因被鑒定和研究[10],氨基酸吸收系統和分泌系統必將作為一個整體同時進行考察和研究,從而使色氨酸以及其他氨基酸的轉運系統工程在氨基酸生產菌株的理性改造過程中發揮更加重要的作用。
REFERENCES
[1] Leuchtenberger W, Huthmacher K, Drauz K. Biotechnological production of amino acids and derivatives: current status and prospects. Appl Microbiol Biotechnol, 2005, 69(1): 1?8.
[2] Ikeda M. Towards bacterial strains overproducing L-tryptophan and other aromatics by metabolic engineering. Appl Microbiol Biotechnol, 2006, 69(6): 615?626.
[3] Azuma S, Tsunekawa H, Okabe M, et al. Hyper-production of L-tryptophan via fermentation with crystallization. Appl Microbiol Biotechnol, 1993, 39(4/5): 471?476.
[4] Ikeda M. Amino acid production processes. Adv Biochem Eng Biotechnol, 2003, 79: 1?35.
[5] Burkovski A, Kramer R. Bacterial amino acid transport proteins: occurrence, functions, and significance for biotechnological applications. Appl Microbiol Biotechnol, 2002, 58(3): 265?274.
[6] Lee KH, Park JH, Kim TY, et al. Systems metabolic engineering of Escherichia coli for L-threonine production. Mol Syst Biol, 2007, 3: 149.
[7] Daβler T, Maier T, Winterhalter C, et al. Identification of a major facilitator protein from Escherichia coli involved in efflux of metabolites of the cysteine pathway. Mol Microbiol, 2000, 36(5): 1101?1112.
[8] Okamoto K, Kino K, Ikeda M. Hyperproduction of L-threonine by an Escherichia coli mutant with impaired L-threonine uptake. Biosci Biotechnol Biochem, 1997, 61(11): 1877?1882.
[9] Vrljic M, Sahm H, Eggeling L. A new type of transporter with a new type of cellular function: L-lysine export from Corynebacterium glutamicum. Mol Microbiol, 1996, 22(5): 815?826.
[10] van Dyk TK. Bacterial efflux transport in biotechnology. Adv Appl Microbiol, 2008, 63: 231?247.
[11] Doroshenko V, Airich L, Vitushkina M, et al. YddG from Escherichia coli promotes export of aromatic amino acids. FEMS Microbiol Lett, 2007, 275(2): 312?318.
[12] Ikeda M, Katsumata R. Tryptophan production by transport mutants of Corynebacterium glutamicum. Biosci Biotechnol Biochem, 1995, 59(8): 1600?1602.
[13] Yanofsky C, Horn V, Gollnick P. Physiological studies of tryptophan transport and tryptophanase operon induction in Escherichia coli. J Bacteriol, 1991, 173(19): 6009?6017.
[14] Ikeda M, Katsumata R. Transport of aromatic amino acids and its influence on overproduction of the amino acids in Corynebacterium glutamicum. J Ferment Bioeng, 1994, 78(6): 420?425.
[15] Zhao ZJ, Zou C, Zhu YX, et al. Development of L-tryptophan production strains by defined genetic modification in Escherichia coli. J Ind Microbiol Biotechnol, 2011, 38: 1921?1929.
[16] Baba T, Ara T, Hasegawa M, et al. Construction of Escherichia coli K-12 in-frame, single-gene knockout mutants: the Keio collection. Mol Syst Biol, 2006, 2(1): 1?11.
[17] Pfefferle W, M?ckel B, Bathe B, et al. Biotechnological manufacture of lysine. Adv Biochem Eng Biotechnol, 2003, 79: 59?112.
[18] Simic P, Willuhn J, Sahm H, et al. Identification of glyA (encoding serine hydroxymethyltransferase) and its use together with the exporter ThrE to increase L-threonine accumulation by Corynebacterium glutamicum. Appl Environ Microbiol, 2002, 68(7): 3321?3327.
[19] Marin K, Kr?mer R. Amino acid transport systems in biotechnologically relevant bacteria. Microbiol Monographs, 2007, 5: 289?325.

