轉錄因子E2F-1與垂體腫瘤轉化基因(PTTG)在大鼠PRL瘤中的表達
程海梅,徐 春,楊雪梅,劉曉軍
(1.武警總醫院內分泌科,北京 100039;2.武警總醫院藥劑科,北京 100039)
催乳素瘤(PRL瘤)是最常見的功能性垂體腺瘤,可引起閉經、泌乳、不孕(育)、高泌乳素血癥等內分泌紊亂,垂體增大可壓迫鄰近組織出現視力減退、視野缺損、顱內高壓等表現,因其生長隱匿常不能早期發現,嚴重危害人類健康。PRL瘤主要是單克隆細胞起源,對于其確切的發病機制,目前還不是很統一。垂體腫瘤轉化基因(PTTG)是第一個在大多數垂體腺瘤中表達的腫瘤轉化基因,PTTG過度表達促進垂體腺瘤形成的機制目前仍無圓滿的解釋。細胞周期調節失控導致細胞增殖是腫瘤發生的重要原因,腺病毒E2啟動子結合因子1(E2F-1)是調控細胞周期的關鍵因子之一,其通過調控一系列靶基因的表達來促進細胞周期的進程。有研究發現,PTTG啟動子上存在 E2F-1的特異結合序列,PTTG的高表達是否與 E2F-1有關,E2F-1在PRL瘤形成過程中究竟起到什么作用,本研究采用免疫組化方法檢測轉錄因子E2F-1蛋白質和PTTG蛋白質在雌激素誘發的大鼠PRL瘤中的表達情況,探討兩者在PRL瘤發生發展中的作用及兩者之間是否有關。定后,常規脫水,石蠟包埋,切片厚約3 um,蘇木素-伊紅染色,封片進行顯微鏡觀察。
1 材料和方法
1.1 實驗動物和主要試劑
成年雄性W istar大鼠(體重120~150 g,由軍事醫學科學院實驗動物中心提供,編號:SCXK(軍) 2007-004);17β-雌二醇(由 Sigma公司提供);血清催乳素檢測試劑盒(購自福建邁新生物技術開發公司);兔抗鼠PTTG多克隆抗體(工作濃度1∶200~500),兔抗鼠E2F-1多克隆抗體(工作濃度1∶200~500),濃縮型DAB顯色液以及 SP染色試劑盒均購自北京博奧森生物技術有限公司。
1.2 實驗方法
1.2.1 大鼠 PRL瘤模型的制備:40只成年大鼠(120~150 g)隨機分為2組:正常對照組(C組,n= 20只)皮下植入空白硅膠管;PRL瘤組(P組,n=20只)皮下植入含有17β-雌二醇(約20 mg)的硅膠管;用藥10周后,用水合氯醛麻醉大鼠,心臟穿刺取血,4%多聚甲醛心臟灌流體內固定,取出垂體,稱重后放于4%多聚甲醛內固定。
1.2.2 垂體組織的病理學觀察:標本經多聚甲醛固
用藥10周后,實驗組大鼠與對照組比較,平均體重明顯降低(P<0.01);垂體重量明顯增加(P<0.01);血清PRL水平明顯升高(P<0.01)(表1)。
1.2.3 ELISA法測定血清 PRL水平:心臟穿刺取血1 m L,室溫自然凝固,離心(3000 rpm,15 min)后取血清,放入 -70℃冰箱保存。待標本收集完用ELASA測定大鼠血清催乳素水平。
1.2.4 免疫組化SP法檢測PTTG蛋白質、E2F-1蛋白質的表達:垂體經4%多聚甲醛固定、石蠟包埋、3μm連續切片。免疫組化染色操作步驟按說明書進行。采用已知陽性片為陽性對照,PBS液代替一抗作為陰性對照。
1.3 結果判定
PTTG蛋白質和E2F-1蛋白質陽性表達均為胞漿和胞核內棕黃色顆粒。本實驗結果判定標準參照Fromowitz[1]綜合計分法:隨機選擇5個高倍鏡視野(200×),按陽性細胞所占比例及細胞染色強度進行分級:陽性細胞數 <5%為0分,6~25%為1分,26%~50%為2分,51%~75%為3分,>75%為4分;染色強度評分:無顯色為0分,淺黃色為1分,棕黃色為2分,棕褐色為3分;兩項積分相加:0~1分為陰性,≥2分為陽性。
1.4 統計學處理
采用SPSS13.0統計軟件進行統計學分析,大鼠體重、垂體重量、PRL瘤以X±S表示,兩組間差異用t檢驗,免疫組化結果分析采用卡方檢驗,相關性分析應用Spearman相關性檢驗,P<0.05為有顯著性差異。
2 結果
2.1 兩組大鼠體重、垂體重量、血清 PRL水平的比較
2.2 兩組大鼠垂體組織病理學的比較
HE染色下,對照組垂體細胞排列規則,呈圓形,胞漿少,胞核大小一致,以嗜酸性粒細胞為主(封2圖1)。實驗組細胞排列紊亂,細胞數目明顯增加,細胞呈圓形或多角形,胞體增大,胞漿帶增寬,細胞分化差,核大小不一致,可見大核細胞,細胞增生明顯,以嗜酸性粒細胞為主(封2圖2)。
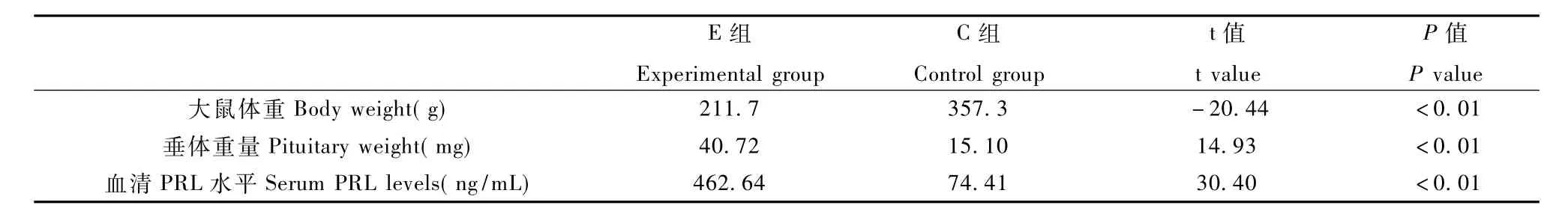
表1 兩組大鼠體重、垂體重量、血清PRL水平比較Tab.1 Comparation of body weight,pituitary weight,serum PRL levels
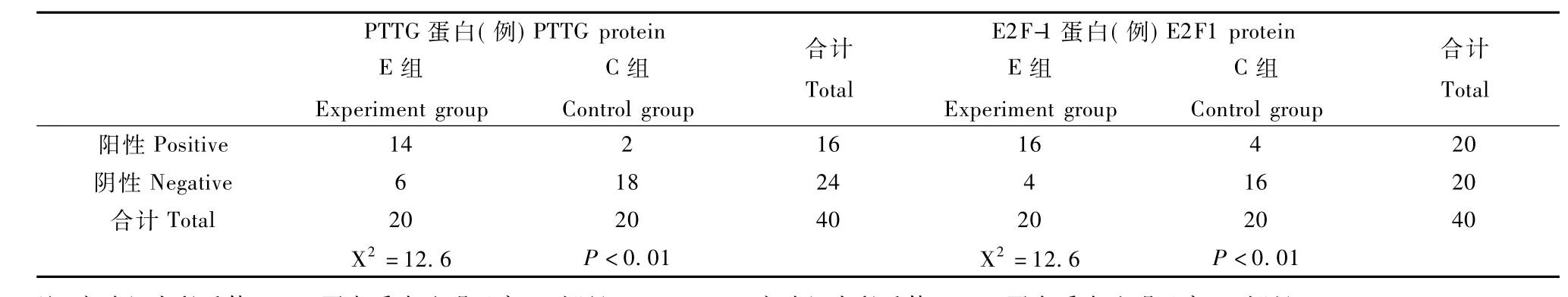
表2 兩組大鼠垂體中PTTG蛋白質、E2F-1蛋白質表達情況Tab.2 Comparation of PTTG、E2F-1 protein expression between the two groups
2.3 PTTG蛋白質在兩組大鼠垂體的表達
PTTG蛋白質在實驗組呈高表達70%(14/20),陽性顆粒主要出現在胞漿,部分位于細胞核,呈棕黃色或黃褐色顆粒(封2圖4),顯著高于對照組10%(2/20),對照組著色細胞數目少,細胞染色淺,與背景顏色難以區分(封2圖3),兩組差別具有統計學意義(P<0.05)(表2)。
2.4 E2F-1蛋白質在兩組大鼠垂體的表達
E2F-1蛋白質在實驗組呈高表達 80%(16/ 20),陽性顆粒胞漿和胞核中彌漫分布,染色較深(封2圖6),顯著高于對照組20%(4/20),且對照組陽性顆粒主要位于胞漿,染色較淺(封2圖5),兩組差別具有統計學意義(P<0.05),見表2。
2.5 PTTG蛋白質和E2F-1蛋白質在大鼠PRL瘤中表達的相關性
PRL瘤組14例 PTTG蛋白質陽性的標本中E2F-1蛋白陽性者13例,陰性1例;6例 PTTG蛋白陰性的標本中E2F-1蛋白質陽性者3例,陰性3例,兩者表達一致率為70%,統計學分析PTTG表達與E2F-1表達呈顯著正相關(γ=0.764,P<0.051)。
3 討論
雌激素是垂體催乳素(PRL)細胞增生和 PRL基因表達的強有力的刺激因子,雌激素長期作用引起垂體 PRL細胞增生、PRL分泌增加,最終形成PRL瘤。由于垂體的特殊性,正常垂體難以獲得,建立穩定、可靠的大鼠垂體腺瘤模型對研究腺瘤的發病機制和尋找有效的治療措施具有重要意義。有研究顯示,長期給予大鼠雌激素,可誘發大鼠PRL瘤。大鼠垂體腺瘤動物模型的成功與否可以從三個方面進行判斷:(1)一般認為大鼠垂體重量超過50 mg即可判斷為腺瘤[5],也有觀點認為大于30 mg即可判定建模成功[6];(2)血漿PRL濃度顯著增高; (3)組織病理學檢查。本實驗選用 W istar大鼠,用皮下植入含有雌激素的硅膠管,結合上述指標分析,10周后垂體瘤模型成功率達100%。
垂體腫瘤轉化基因(pituitary tumor transforming gene,PTTG)是Pei[4]等用mRNA差異顯示技術從大鼠垂體瘤細胞中分離出的新型原癌基因,體外研究它能誘導NIH3T3成纖維細胞的轉化,在體內能誘發裸鼠實體腫瘤的形成,是一種強有力的腫瘤轉化基因。PTTG通過促進細胞轉化、誘導血管形成、抑制姊妹染色單體分離、反式激活c-myc等癌基因的途徑參與腫瘤的形成。腫瘤細胞中PTTG cDNA的序列分析未發現突變,PTTGmRNA表達水平卻明顯升高,說明其致癌作用主要依賴于其表達水平的高低[5]。Donangelo[6]等發現,PTTG失活的小鼠表現出垂體增生不良,而PTTG過表達導致垂體局灶性增生說明PTTG含量與垂體增生和腫瘤的形成直接相關。本實驗研究發現,大鼠PRL瘤中PTTG蛋白質表達明顯增高,正常垂體組織中無明顯表達,說明PTTG在PRL瘤的發生發展過程中起重要作用。
E2F-1作為轉錄因子家族的一員,對于調節細胞由G1期進入S期起著至關重要的作用。在G0和G1早期,E2F-1與低磷酸化的 pRb結合,E2F-1轉錄活性受抑制;G1中后期,pRb被cyclin D/cdk4/ 6和 cyclin E/cdk2磷酸化后,E2F-1與 Rb分離,E2F-1被游離后與其靶基因結合,激活它們的轉錄[7]。
很多參與DNA復制和細胞周期調控的基因啟動子區存在E2F-1 DNA結合位點,E2F-1與其結合后,促使細胞由G1期進入S期,繼而推動細胞周期進程,導致細胞增殖和腫瘤的形成。迄今為止發現,E2F-1可以參與 1000多種基因的調控[8]。Zhou[9]等發現,PTTG啟動子上也存在 E2F-1的特異結合序列,E2F-1與 PTTG啟動子結合后,激活PTTG的轉錄。研究還發現,E2F-1和 PTTG在 Rb +/-鼠垂體組織和人垂體腫瘤中成一致高表達。體外 H1299細胞轉染表達 E2F-1的質粒后,PTTGmRNA表達水平明顯升高;將Rb siRNA轉染H1299細胞后,Rb被抑制,E2F-1表達水平升高,同時PTTG表達量也明顯上調,這些提示PTTG的表達可能受E2F-1的調控。本實驗研究發現,PTTG蛋白質和E2F-1蛋白質在雌激素誘導的大鼠PRL瘤中呈一致高表達,進一步證實了兩者之間的關系。
Yamasaki[10]等研究則發現,E2F-1缺失的 Rb1 (+/-)小鼠垂體腫瘤的發生率減少,提示 E2F-1可能在垂體腺瘤的發生中起到一定作用。本實驗發現:E2F-1蛋白在大鼠PRL瘤中的表達明顯高于正常垂體組織,并且E2F-1蛋白質與PTTG蛋白質表達呈明顯正相關,說明E2F-1在PRL瘤的發生發展中起著促進作用,作者推測可能是通過調控PTTG的表達來實現。
基于E2F-1在腫瘤中的異常表達及其對細胞周期和細胞凋亡的調控,出現了很多針對E2F-1作為靶點設計的腫瘤基因治療試驗,并取得了初步成效[11-13]。明確了E2F-1在垂體腫瘤形成過程中的作用,有利于從分子水平開展對垂體腫瘤基因治療的研究。
綜上,用皮下植入雌激素的方法能成功誘導Wistar大鼠PRL瘤的發生,PTTG蛋白質與E2F-1蛋白質在雌激素誘發的大鼠PRL瘤中呈一致高表達,兩者共同參與了大鼠PRL瘤的發生發展,這對以后垂體腫瘤的治療提供了更多的契機。
[1]Fromowitz FB,et al.Ras p21 expression in the progression of breast cancer[J].Hum Pathol,1987,18(12):1268-1275.
[2]Clifton KH,Meyer RK,Mechanism of anterior pituitary tumor induction by estrogen[J].Anat Rec.1956;125(1):65-68.
[3]薛毅瓏,段國升,張燦元。雌酮誘發大白鼠垂體腺瘤的動物模型[J]。中華實驗外科雜志,1992,9:1-36.
[4]Pei L,Melmed S.Isolation and characterization of a pituitary tumor transforming gene(PTTG)[J].Mol Endocrinol,1997; 11(4):433-441.
[5]Kanakis D,Kirches E,Mawrin C,et al.Promoter mutations are no major cause of PTTG overexpression in pituitary adenomas[J].Clin Endocrinol(Oxf),2003,58(2):151-155.
[6]Ines Donangelo.Pituitary tumor transforming gene overexpression facilitates pituitary tumor development[J].Endocrinology,2006,147(10):4781-4791.
[7]Harbour JW,Dean D C.The Rb/E2F pathway:expanding roles and emerging paradigms[J].Genes Dev,2000,14(19):2393 -2409.
[8]Fikret Sahin,Todd L.Sladek.E2F-1 has dual roles depending on the cell cycle[J].Biol.Sci.2010;6(2):116-128.
[9]Cuiqi Zhou,Kolja W,Serguei B,et al.E2F-1 induces pituitary tumor transforming gene(PTTG1)expression in human pituitary tumors[J].Molecular Endocrinology,2009,23(12):2000 -2012.
[10]Yamasaki L,Bronson R,Williams,et al.Loss of E2F-1 reduced tumorigenesis and extends the lifespan of Rb1(+/-)mice[J].Nat.Genet,1998,18:360-364.
[11]Gomez-Gutierrez JG, Garcia-GarciaA, HaoH,etal.Adenovirus-mediated expression of truncated E2F-1 suppresses tumor growth in vitro and in vivo[J].Cancer,2010;116(18):4420-32.
[12]Yan LH,Li L,Xie YB,etal.Effects of E2F-1 overexpression on apoptosis of gastric cancer cells and expressions of apoptosisrelated genes[J].Ai Zheng.2009;28(11):1176-80.
[13]Xie Y,Yin Y,Li L,et al.Short interfering RNA directed against the E2F-1 gene suppressing gastric cancer progression in vitro.Oncol[J].2009;21(5):1345-53.

