新型癌癥患者突發性疼痛治療藥——芬太尼
林 娜
(煙臺市毓璜頂醫院,山東煙臺 264000)
2011年 1月 7日,美國食品藥品管理局 (FDA)批準奧雷佐 (Orexo)公司及其合作伙伴普羅斯特拉坎集團 (ProStrakan Group)公司聯合開發的 Abstral(fentanyl,芬太尼)舌下含片,用于控制成人癌癥患者的突發性疼痛。Abstral直接貼于口腔粘膜(臉頰內部、牙齦及舌頭)或者鼻腔及咽喉,并在這些位置溶解吸收發揮作用。
通用名:Fentanyl
商品名:Abstral
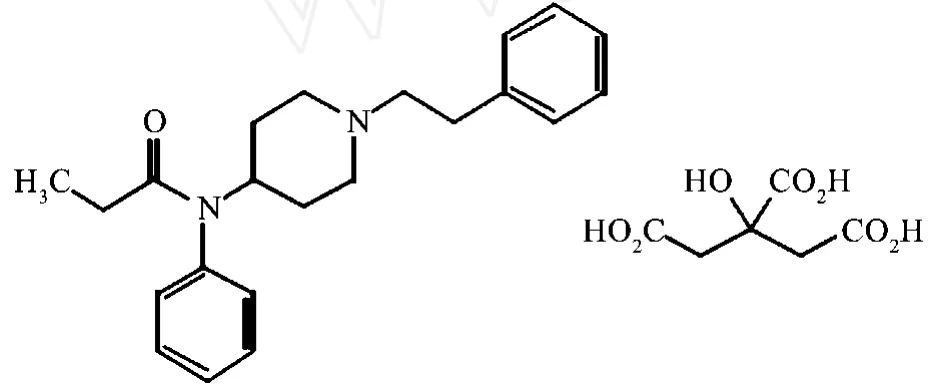
中文化學名:N-(1-苯乙基 -4-哌啶基)丙酰苯胺枸櫞酸(1:1)
英文化學名:N-(1-Phenethyl-4-piperidyl)propionanilide citrate(1:1)
結構式:
1 作用機制
芬太尼是一種阿片類激動藥,它的主要治療作用是鎮痛。其他已知的阿片類激動藥包括嗎啡、羥考酮、氫嗎啡酮、可待因和氫可酮。
2 藥效學
阿片類激動藥的藥理學作用包括抗焦慮、精神愉快、輕松感、呼吸抑制、便秘、瞳孔縮小、咳嗽抑制、痛覺消失。像所有阿片類激動鎮痛藥一樣,隨著芬太尼劑量的增加,疼痛感逐漸減輕。阿片類激動鎮痛藥沒有確定的最大劑量,止痛效果的升限僅限于副作用,更嚴重的可能包括嗜睡和呼吸抑制。
3 藥代動力學
吸收:芬太尼是一種高親脂的藥物。口服芬太尼有顯著的肝與腸的首過效應。Abstral舌下含片中芬太尼的吸收主要是通過口腔黏膜。Abstral舌下含片的生物利用度為54%。100~800μgAbstral劑量范圍內的藥物動力學參數見表 1。這 4個劑量的 Abstral達到最大血漿濃度 (Tmax)的中位時間從 30 min到 60 min不等(范圍:15~240 min)。分布:芬太尼脂溶性高。動物數據表明,口服后芬太尼迅速地分布于大腦、心臟、肺、腎和脾臟,接著經過緩慢地再分布至肌肉和脂肪。80%~85%的芬太尼與血漿蛋白結合。主要的結合蛋白是α-1-酸糖蛋白。酸血癥時芬太尼的游離部分增加,在穩定狀態(Vss)下平均分布容積為 4 L·kg-1。
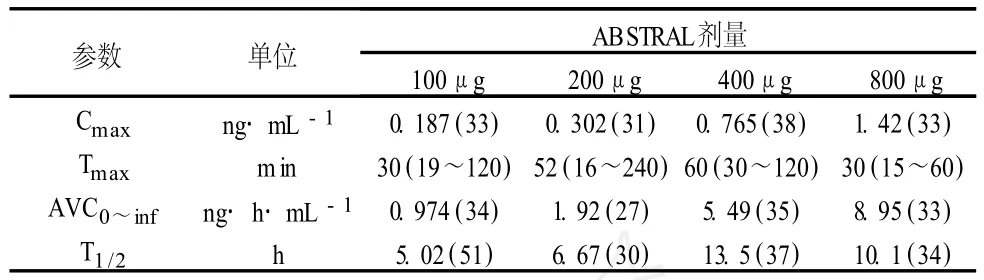
表 1 給予健康受試者 100、200、400和 800μg單次劑量的Abstral后芬太尼的平均(CV%)藥物動力學參數(每個劑量水平 n=12)
代謝:芬太尼是在肝臟和腸粘膜中被微粒體混合功能氧化酶 P450(CYP 3A4)代謝成為去甲芬太尼 (norfentanyl)。在動物研究中沒有發現去甲芬太尼有藥理學活性。
排泄:90%以上的芬太尼經生物轉化成N-脫烷基和羥基化無活性代謝產物后排除,少于 7%的芬太尼以原型從尿中排除,僅僅約 1%原型從糞便中排除。代謝產物主要從尿中排除,而很少經糞便排除。芬太尼的總血漿清除率為 0.5 L·(h·kg)-1[范圍:0.3~0.7 L·(h·kg)-1]。
4 臨床研究
一項采用雙盲法、安慰劑控制、正交研究對 Abstral治療突發性癌癥疼痛的功效進行評估。在容許的副作用下,100~800μg劑量范圍內采用標簽公開逐步增加劑量法鑒別哪個劑量下的患者得到了適當的痛覺缺失。在雙盲效能研究中,被鑒別為有效劑量的患者隨機地排序,接受 10種療法:7種Abstral劑量和 3種安慰劑。
在進入逐步增量期研究的 131名患者中,78名 (60%)在逐步增量期完成了有效劑量的鑒別,66名患者進入了雙盲試驗和 60名患者完成了研究。Abstral的劑量是從 100μg開始的逐步增量法來測定的。Abstral治療突發性癌癥疼痛的逐步增量的最終劑量不是預期的用于緩解持續的癌癥疼痛的阿片類藥物的每日維持劑量。在用相同的逐步增量法的二次標簽安全性研究中,139名患者中有 96名患者(69%)進入了逐步增量至某一劑量的研究,該劑量下,在可容許的副作用內患者獲得適當的痛覺缺失。雙盲效能和標簽公開安全性研究的逐步增量的最終劑量見表 2。
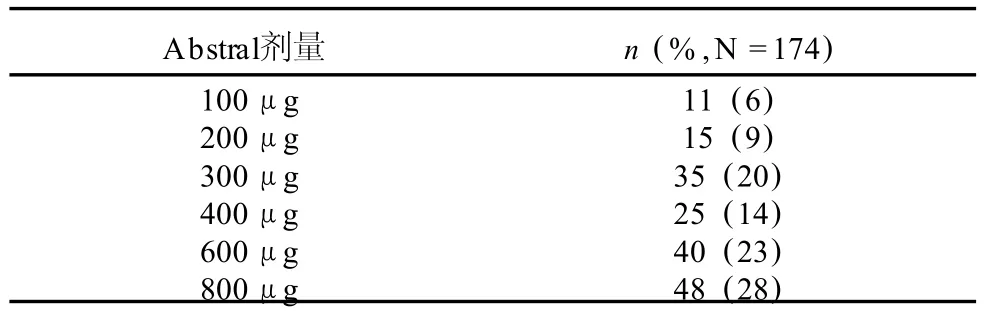
表 2 所有臨床效能和安全性研究中從最初逐步增量開始的Abstral的最終劑量
根據初期的結果計算,Abstral治療突發性疼痛平均疼痛強度差異之和(30 min),在統計學上比安慰劑治療更加有效(見圖 1)。
5 適應證
控制成人癌癥患者的突發性疼痛。
6 規格
100μg、200μg、300μg、400μg、600μg和 800μg。
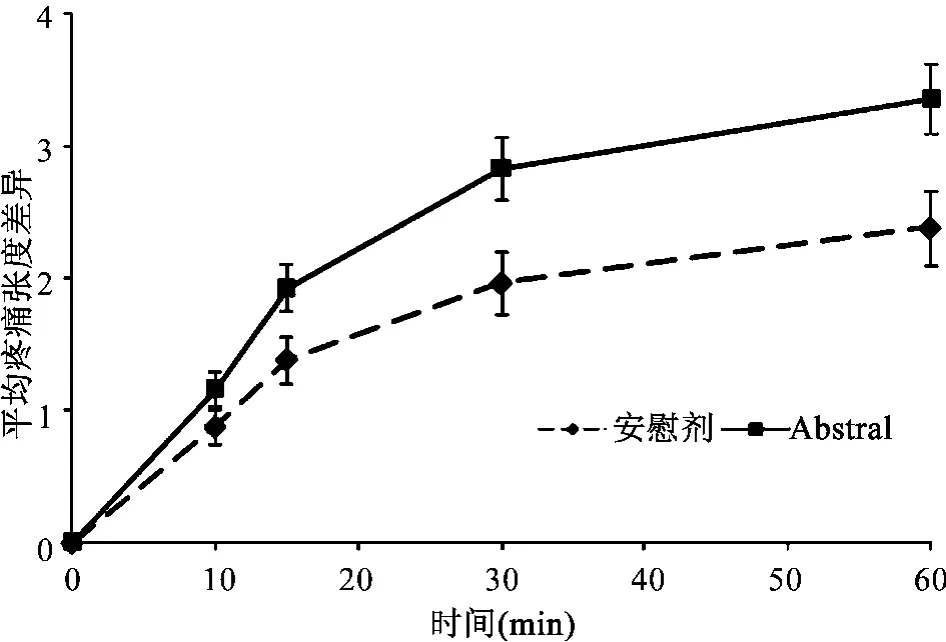
圖 1 與安慰劑比較Abstral的平均疼痛強度差別(±SE)
7 不良反應
常見不良反應包括惡心、便秘、嗜睡和頭痛。

