不同鹽對鯉魚肌原纖維蛋白結構和凝膠特性的影響*
孔保華,李明清,夏秀芳
鯉魚 (Comm on carp,Cyprinus carpio)在淡水魚中所占比例很大,是一種非常重要的淡水資源。淡水魚除了鮮活食用外,大部分加工成魚糜制品。影響魚糜制品質量的最主要的因素是肌原纖維蛋白,它是魚肉中含量最多的蛋白質,它結構和性質直接影響魚肉制品的結構和功能特性[1]。目前國內外研究較多的是以魚糜為原料,添加非肉蛋白質和膠類對魚糜質量的影響[2],而添加不同鹽對鯉魚肌原纖維蛋白的結構和功能性質影響的研究并不多。在加工過程中,一些鹽類會對肉糜類制品的品質產生影響,一定離子強度的鹽溶液可以提高肌原纖維蛋白的溶解性,改善凝膠特性,其中鈉離子和鈣離子對魚肉中肌原纖維蛋白的功能特性影響較大[3-4]。肌原纖維蛋白主要由肌動蛋白和肌球蛋白構成,是魚肉的結構蛋白,對魚肉制品的品質有重要的影響[5]。在肉制品加工中利用鹽溶液對肌肉蛋白的凝膠效應可以提高產品的品質,例如在肉中注入鹽水可以明顯提高肉的保水性和多汁性,并提高魚糜類制品的凝膠強度[6],在魚糜中添加焦磷酸鈉可以使魚糜凝膠的微觀網狀結構變得細膩致密,從而可以保留更多的水分[7-8]。因此,本文以鯉魚為原料,提取肌原纖維蛋白后,添加不同濃度的NaCl,CaCl2和 Na4P2O7,研究鹽類對鯉魚肌原纖維蛋白的結構特性和凝膠特性的影響。
1 材料與方法
1.1 材料
鮮活鯉魚 (購于家樂福超市),體重約為 600 g。
1.2 儀器與設備
HR2860型飛利浦斬拌機,AL-104型精密電子天平 (上海梅特勒-托利多儀器設備有限公司),HH-4型數顯恒溫水浴鍋 (常州國華電器有限公司),TA-XT plus型質構分析儀 (英國 Stable Micro System公司),冷凍離心機 (上海分析儀器公司),pHS-25型 pH計(上海精科雷磁儀器廠),JD500-2型電子天平 (沈陽龍騰電子稱量儀器有限公司),精密電子天平 AL-104(上海梅特勒-托利多儀器設備有限公司),紫外可見分光光度計UT-1800(北京普析通用儀器有限公司),精密增力電動攪拌器 JJ-1(常州國華電器有限公司),Mini-4型電泳槽 (美國 Bio-rad公司)。
1.3 試驗方法
1.3.1 鯉魚肌原纖維蛋白的提取
鯉魚宰殺去皮后,取背部白色肉。肌原纖維蛋白提取參照 Chin等的方法[9-10]并適當修改。將魚肉攪碎,加入 4倍體積的 20 mmol/L pH值 7.5的冰磷酸鹽緩沖溶液均質,均質 2次,每次 30 s,時間間隔 30 s,將其在 4℃冷凍離心機中 8 000 g離心 10 min,除去上清液。取沉淀用 4倍體積 pH值 7.5的 20 mmol/L的磷酸鹽緩沖溶液清洗沉淀,重復 3次,最后一次清洗后用 5層紗布過濾,所得濾液離心。沉淀為肌原纖維蛋白樣品,用凱氏定氮方法測定其蛋白含量。將肌原纖維蛋白配制為蛋白含量為 40 mg/mL的溶液,分別添加不同濃度的 NaCl、CaCl2和 Na4P2O7,進行肌原纖維蛋白的溶解性、凝膠性、凝膠微觀結構、濁度和表面疏水性等指標的測定。
1.3.2 肌原纖維蛋白等電點的測定
等電點的測定參照 Tang[11]的方法,稱取肌原纖維蛋白樣品與蒸餾水 1∶100(g∶mL)混合,用 0.1 mol/L NaOH調節 pH值 8.0,室溫下磁力攪拌 1h后,4 000 r/min離心 20 min,取等量上清液,用 0.1 mol/L HCl調至不同 pH值 (3~6.5)沉淀蛋白質,離心后采用雙縮脲法分別測定離心沉淀前后上清液中肌原纖維蛋白,上清液中蛋白質殘留率最低時的 pH值即為肌原纖維蛋白的等電點。其公式如下:

1.3.3 肌原纖維蛋白 SDS-聚丙烯酰胺凝膠電泳
參照 Laemmli的 SDS[12]不連續電泳方法,分離膠濃度 10%,濃縮膠濃度 5%,電極緩沖液為 0.05 mol/L Tris,0.384 mol/L甘氨酸,0.1%SDS(pH值8.3)的混合溶液。電泳膠的厚度為 1 mm,進樣量為15μL,進樣濃度為 1 mg/mL,電泳開始時調節電壓為80 V,當樣品進入分離膠后將電壓調節為 120V。
1.3.4 肌原纖維蛋白凝膠質構 (TPA)的測定
將肌原纖維蛋白溶液 (40 mg/mL),分別添加不同濃度的 NaCl、CaCl2和 Na4P2O7,在 80℃水浴下加熱 45 min,冷卻,放置 4℃冰箱 12 h,形成肌原纖維蛋白凝膠。肌原纖維蛋白凝膠 (直徑 30 mm高度 25 mm)在室溫下放置 30 min,用質構分析儀測定。將待測樣品置于測定平臺上固定好,室溫下利用物性分析儀進行測量。以質構剖面分析方法 (texture profile analyses,TPA)測定凝膠的硬度和彈性等,選用的參數分別為:S MS P/50探頭,測前速度 5 mm/s,測試速度 1 mm/s,觸發力 1g,壓縮距離 50%。所有樣品做 3次平行試驗,結果取平均值。
1.3.5 肌原纖維蛋白凝膠微觀結構的觀察(掃描電鏡)
取肌原纖維蛋白凝膠樣品,切成約 (2×5)mm的小條,用 pH值 6.8濃度為 2.5%的戊二醛浸泡 12 h固定。用 0.1mol/L pH值 6.8磷酸緩沖液洗滌 3次,每次 10 min。分別用體積分數 50%、70%、80%和 90%的乙醇進行脫水,每次 10 min;然后用 100%乙醇脫水 3次,每次 10 min。最后用三氯甲烷脫脂1h,再分別用 100%乙醇∶叔丁醇體積比為 1∶1和叔丁醇進行置換各 1次,每次 15 min。樣品用 ES-2030(H ITACH I)型冷凍干燥儀進行干燥。將凝膠樣品觀察面向上緊密粘貼在掃描電鏡樣品臺上,在離子濺射噴金過程中,用 E-1010(Giko)型離子濺射鍍膜儀將樣品表面噴金,處理好樣品之后,放入掃描電鏡的樣品盒中待檢,加速電壓為 5kV,放大倍數為 300倍,進行掃描電鏡觀察。
1.3.6 肌原纖維蛋白表面疏水性的測定
表面疏水性的測定依據 Chelh的方法[13]。將肌原纖維蛋白溶于 pH值 7、20 mmol/L的磷酸鹽溶液中,蛋白濃度為 5 mg/mL,在 80℃加熱 30 min,取 1 mL蛋白溶液,加入 200μL濃度為 1 mg/mL溴酚藍,以無肌原纖維蛋白的磷酸鹽溶液為對照。在 2 000 g離心 15 min,取上清液稀釋 10倍,在 595 nm處測定吸光值。表面疏水性用以下公式表示:
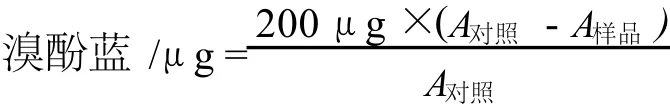
式中:A對照為對照組的吸光值,A樣品為處理組的吸光值。
1.3.7 肌原纖維蛋白濁度的測定
肌原纖維蛋白濁度的測定按照 Benjakul等的方法測定[14-15]。肌原纖維蛋白溶液配制為 1 mg/mL,溶液取 5 mL,分別在 80℃的水浴鍋中加熱 30 min,冷卻后在 600nm處測定吸光值。以不加蛋白的空白溶液為對照。
1.3.8 統計分析
每個試驗重復 3次,結果表示為平均數 ±SD。數據統計分析采用 Statistix 8.1(分析軟件,St Paul,MN)軟件包中 LinearModels程序進行,差異顯著性(P<0.05)分析使用 Tukey HSD程序。采用 sigmaplot 11.1軟件作圖。
2 結果與分析
2.1 鯉魚肌原纖維蛋白等電點的測定
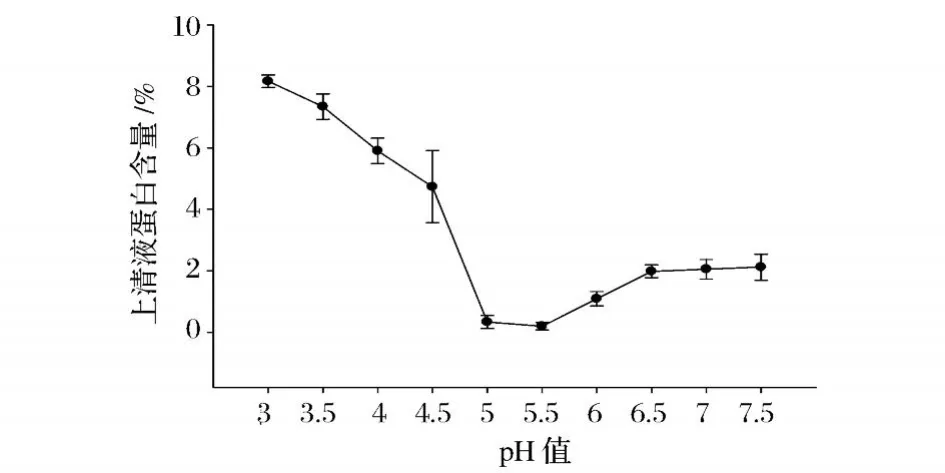
圖1 鯉魚肌原纖維蛋白的等電點
由圖1中可以看出,鯉魚肌原纖維蛋白在不同pH值條件下經過沉淀后,上清液中蛋白含量呈先下降后升高的趨勢。上清液中殘留的肌原纖維蛋白含量在 pH值 5.5時最低,蛋白含量趨向于 0,而在 pH值 5.5附近殘留蛋白質含量均較高。由此可見,pH值 5.5為肌原纖維蛋白的等電點,該結果與 Fennema[16]的結果一致。
2.2 肌原纖維蛋白 SDS-聚丙烯酰胺凝膠電泳
肌原纖維蛋白的電泳圖譜如圖2所示。從圖2中可以得出,肌原纖維蛋白主要包括 17~20 ku的肌球蛋白輕鏈、35 ku的肌原蛋白 (troponin,T)的一個亞基 (原肌球蛋白結合亞基)、36 ku的原肌球蛋白(tropomysin)、43 ku的肌動蛋白 (Actin)、100 ku的副肌球蛋白 (paramyosin)和 220 ku的肌球蛋白重鏈,結果與Lametsch等[17-18]相一致。在肌原纖維蛋白中添加 NaCl,CaCl2和 Na4P2O7的蛋白樣品中,會使肌動蛋白和肌球蛋白輕鏈條帶變深,同時在條帶上部(66~200 ku)出現分子質量較大細小條帶,而肌原蛋白 T的條帶變淺,說明添加這 3種鹽會使一些蛋白質發生一定的聚合作用。特別是添加磷酸鹽 Na4P2O7的樣品聚合程度要高一些。以上結果與 Glibowski[19]試驗一致。

圖2 肌原纖維蛋白 SDS-聚丙烯酰胺凝膠電泳圖譜
2.3 添加不同鹽對肌原纖維蛋白凝膠硬度和彈性的影響
由圖3可知,NaCl、CaCl2和 Na4P2O7的添加使肌原纖維蛋白凝膠的硬度下降。在添加Na4P2O7組中,肌原纖維蛋白凝膠硬度比添加 CaCl2組中凝膠硬度下降的較少 (P<0.05)。添加 NaCl組和添加Na4P2O7組的肌原纖維蛋白凝膠硬度差異不顯著 (P>0.05)。3種鹽的添加使肌原纖維蛋白凝膠彈性大都呈現下降的趨勢。在添加 NaCl和 CaCl2組中,肌原纖維蛋白凝膠的彈性隨著鹽添加量的增大而降低。添加 NaCl組中肌原纖維蛋白凝膠的彈性比添加CaCl2組的彈性要下降少。在添加 Na4P2O7組中,肌原纖維蛋白凝膠的彈性先增加然后減少,在添加量為0.5%處凝膠的彈性達到最大值。且添加 Na4P2O7組凝膠的彈性顯著高于 NaCl和 CaCl2組 (P<0.05)。
鹽對肌原纖維蛋白的變性機理仍在研究中,因此蛋白凝膠的形成過程中鹽的作用也不是很明確。以上試驗結果可能的原因是,一些鹽可以提高蛋白變性的溫度,這些鹽可以加強蛋白的水合作用,且與水價鍵結合能力較弱;而另一些鹽使蛋白凝膠的變性溫度降低,這些鹽降低蛋白的水合作用且水合能力較強,此外,加熱形成凝膠中,由于鹽濃度提高蛋白變性溫度,影響了凝膠形成的第二階段的蛋白之間聚合[20]。也可能因為魚肉中含有大量的轉谷氨酰胺酶,這些酶在離子強度較低時更加有效地將肌球蛋白交聯,鹽的添加降低了轉谷氨酰胺酶的活性,使凝膠的強度下降,此外,添加焦磷酸鈉提高了肌原纖維蛋白的溶解性,超出了凝膠的最適條件。因此添加 3種鹽蛋白凝膠的硬度和彈性呈現下降的趨勢。
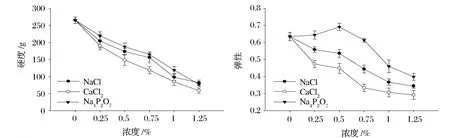
圖3 不同鹽對肌原纖維蛋白凝膠硬度和彈性的影響
2.4 添加鹽對肌原纖維蛋白凝膠微觀結構的影響
肌原纖維蛋白添加 0.5%NaCl、CaCl2和 Na4P2O7后形成凝膠微觀結構的變化如圖4所示。由圖4中可以看出,添加 NaCl所成凝膠結構比對照組凝膠樣品致密,使細膠束聚集增加,網狀孔隙變小,網絡結構比較有序,這樣的結構能更好的保持住凝膠的水分。添加 CaCl2凝膠微觀結構變粗糙,膠束分布不均勻,并且結構中出現碎片,有的形成斷層狀,使凝膠的吸水和保持水分的能力降低,凝膠的孔徑變大結構松散。添加Na4P2O7的肌原纖維蛋白凝膠表面致密,孔徑很小,而對照組凝聚空間多孔不規則、粗糙。

圖4 不同鹽對肌原纖維蛋白凝膠微觀結構的影響(×300)
2.5 鹽濃度對肌原纖維蛋白濁度和表面疏水性的影響
濁度可以表明蛋白質的凝聚程度,反映了溶液中蛋白質懸浮粒子的大小和數量。沒有發生凝聚的蛋白質分散時懸浮顆粒直徑較小,濁度小;蛋白質聚集后,懸浮顆粒直徑增大,濁度升高。不同添加物對肌原纖維蛋白濁度的影響如圖5所示。
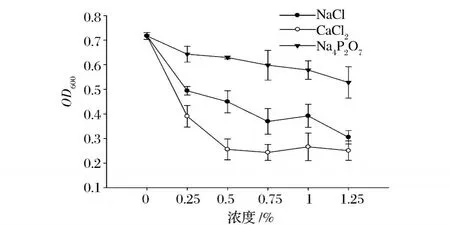
圖5 不同添加物對肌原纖維蛋白濁度的影響
3種鹽明顯降低了肌原纖維蛋濁度,在同一鹽濃度下 CaCl2影響最明顯,且與對照組相比差異顯著 (P<0.05)。這是因為肌原纖維蛋白是鹽溶性蛋白,在鹽溶液中蛋白溶解蛋白分散,吸光值下降,在水溶液中蛋白聚集,吸光值最大。因此,在生產魚類制品時要充分利用肌原纖維蛋白更易溶解于鹽溶液中的特性,來提高魚糜類制品的質量。圖6為不同鹽對鯉魚肌原纖維蛋白表面疏水性的影響。NaCl和 Na4P2O7顯明的降低肌原纖維蛋白的表明疏水性,這也說明蛋白質的溶解性增加。在添加 Na4P2O7的肌原纖維蛋白組中下降程度比添加 NaCl組的表面疏水性下降程度大 (P<0.05)。在添加 NaCl條件下,肌原纖維蛋白表面疏水性在 0~0.25%下降顯著 (P<0.05),進一步增大濃度,肌原纖維蛋白的表面疏水性變化不顯著 (P>0.05),可能因為肌原纖維蛋白是鹽溶性的蛋白,在一定離子強度的鹽溶液中,可以增加肌原纖維蛋白的溶解性[7]。添加 CaCl2的組中,由于 CaCl2與溶液中的試劑反應,方法不適用,所以沒有將數據列出。
3 結論
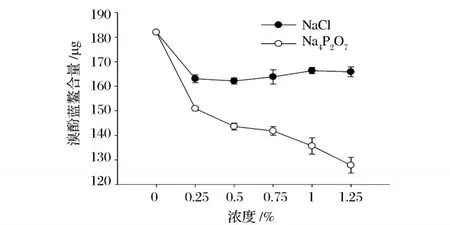
圖6 不同鹽濃度對鯉魚肌原纖維蛋白表面疏水性的影響
將 NaCl、CaCl2和 Na4P2O7添加到鯉魚魚糜中,對肌原纖維蛋白的結構和凝膠特性產生不同的影響:鹽類使肌原纖維蛋白發生一定程度的聚集和降解、表面疏水性降低,溶解性增加;同時也降低了肌原纖維蛋白凝膠硬度、彈性、濁度,且隨著鹽濃度的增加影響越明顯,其中 CaCl2對肌原纖維蛋白的影響最明顯。從肌原纖維蛋白凝膠微觀結構可以看出,NaCl和Na4P2O7使凝膠的微觀結構變致密,CaCl2使凝膠微觀結構變松散。3種鹽對鯉魚肌原纖維蛋白的分子量影響不明顯。因此,在鯉魚制品深加工過程中,適當添加各種鹽類可明顯影響制品的質量。
[1] 宋廣磊,戴志遠.魚肉蛋白質冷凍變性研究進展 [J].食品科技,2006,3:17-20.
[2] Hernández-Briones A,Velázquez G,Vázquez M,et al.Effects of adding fish gelatin on Alaska pollock surimi gels[J].Food Hydrocolloids,2009,23(8):2 446-2 449.
[3] Takahashi K.Non-enzymatic weakening of myofibrillar structures during conditioning ofmeat:calcium ions at 0.1 mM and their effect on meat tenderization[J].Biochi mie,1992,74(3):247-250.
[4] TaylorM,JetheringtonD J.The solubilization ofmyofibrillar proteins by calcium ions[J].Meat Science,1991,29(3):211-219.
[5] 孔保華,馬麗珍.肉品科學與技術 [M].北京:中國輕工業出版社,2003:333.
[6] Xiong Y L.Role of myofibrillar proteins in water-binding in brine-enhanced meats[J].Food Research International,2005,38(3):281-287.
[7] JulavittayanukulO,Benjakul,Svisessanguan W.Effect of phosphate compounds on gel-forming ability of surimi from bigeye snapper(Priacanthus tayenus)[J].Food Hydrocolloids,2006,20(8):1 153-1 163.
[8] Xiong X L,Robert J.Salt-and pyrophosphate-induced structural changes in myofibrils from chicken red and white muscles[J].Journal of the Science of Food and Agriculture,2000,80(8):1 176-1 182.
[9] Chin KB,Xiong YL.Konjac flour improved textural and water retention properties of transglutaminase-mediated,heat-induced porcine myofibrillar protein gel:Effect of salt level and transglutaminase incubation[J].Meat Science,2009,81(3):565-572.
[10] Jiang X J,Zhang Z J,Cai H N,et al.The effect of soybean trypsin inhibitor on the degradation of myofibrillar proteins by an endogenous serine proteinase of crucian carp[J].Food Chemistry,2006,94(4):498-503.
[11] Tang C H.Functional properties and in vitro digestibility of buckwheat protein products: Influence of processing[J].Journal of Food Engineering,2007,82(4):568-576.
[12] LaemmliU K.Cleavage of Structural Proteins during the Assembly of the Head of Bacteriophage T4[J].Nature,1970,227(5 259):680-685.
[13] Chelh I,Gatellier P V.Technical note:A simplified procedure for myofibril hydrophobicity deter mination[J].Meat Science,2006,74(4):681-683.
[14] Benjakul S,Visessanguan W,Ishizaki S,et al.Differences in gelation characteristicsof natural actomyosin from two species of bigeye snapper,priacanthus tayenus and priacanthus macracanthus[J].Journal of Food Science,2001,66(9):1 311-1 318.
[15] Visessanguan W,Ogawa M,Nakai S,et al.Physicochemical changes and mechanism of heat-induced gelation of arrowtooth flounder myosin[J].Journal of Agricultural and Food Chemistry,2000,48(4):1 016-1 023.
[16] Fennema O R.Food Chemisty.Food Science and Technology(3rd ed)[M].New York:Marcel Dekker Inc,1996:1 055.
[17] Lametsch R,Roepstorff PM,Ller H S,et al.Identification of myofibrillar substrates for calpain[J].Meat Science,2004,68(4):515-521.
[18] Mignino L,AparediM E.Physico-chemical and functional properties ofmyofibrillar proteins from different species ofmolluscs[J].Food Science and Technology,2006,39(1):35-42.
[19] Glibowski P.Rheological properties and structure of inulin-whey protein gels[J]. International Dairy Journal,2009,19(8):443-449.
[20] TotosausA,Montejano J G,Salazar J A,et al.A review of physical and chemical protein-gel induction[J].International Journal of Food Science and Technology,2002,37(6):589-601.

