東北紅豆杉的愈傷組織誘導
高明波,李興泰,阮成江
(大連民族學院a.生命科學學院;b.生物化學工程國家民委-教育部重點實驗室,遼寧大連 116605)
東北紅豆杉的愈傷組織誘導
高明波a,b,李興泰a,阮成江a,b
(大連民族學院a.生命科學學院;b.生物化學工程國家民委-教育部重點實驗室,遼寧大連 116605)
提取并檢測東北紅豆杉莖和葉中紫杉醇的含量,莖和葉中均含有微量紫杉醇,莖中含量稍高一些。以莖和葉為外植體,MS為基礎培養基,采用10種激素配比在黑暗條件下誘導愈傷組織。綜合愈傷組織誘導率、愈傷組織生長狀態和愈傷組織傳代過程中的褐化情況,2,4-D 1.0 mg·L-1和6-BA 1.0 mg·L-1為東北紅豆杉莖愈傷誘導和傳代的最佳激素配比。低溫預處理外植體有利于減輕愈傷組織的褐化情況,但卻降低了愈傷組織誘導率。在愈傷組織及培養基中未檢測到紫杉醇。
東北紅豆杉;MS培養基;愈傷誘導
植物是天然化合物的寶庫,含有大量有用的次生代謝物質,是人類藥物和工業原料的重要來源。已經有超過10萬種化合物從植物中分離鑒定,并且以每年大約4千種新化合物的速度增加[1]。美國醫藥市場的藥物有25%來自植物[2]。
紅豆杉的提取物紫杉醇(paclitaxel,Taxol?)具有獨特的抗癌機理,是繼阿霉素、順鉑以后國際市場最暢銷的新型抗癌藥物,對多種癌癥具有良好療效且副作用較小。紫杉醇最初從短葉紅豆杉(T.brevifolia)樹皮中提取[3],這種樹在全世界僅有1千萬株左右。在含量最高的樹皮中,紫杉醇的含量也僅有萬分之幾,1公斤紫杉醇需要2 000~3 000棵短葉紅豆杉的樹皮或1萬多公斤枝葉。紫杉醇供給問題引起了醫藥界的廣泛關注,資源不足成為制約紫杉醇臨床應用的主要因素。
目前市售的紫杉醇按原料來源不同,一般分為兩類:一類是直接從紅豆杉植物中提取;另一類為半合成紫杉醇,即從紅豆杉嫩枝條或樹葉等可再生資源中提取10-去乙酰巴卡亭Ⅲ,或用提取紫杉醇過程中的副產物如7-木糖紫杉醇、10-去乙酰紫杉醇、三尖杉寧堿等為原料經化學半合成生產紫杉醇或多烯紫杉醇[4]。
采用植物細胞培養技術生產紫杉醇具有很大潛力。植物細胞培養生產次生代謝產物的基本方法如圖1[5]。首先篩選含有目標次生代謝物的植物及最好的基因型,選擇合適的部位作外植體進行愈傷組織誘導。在愈傷誘導過程中篩選合適的生長培養基,進行傳代培養,再經過多代培養,得到穩定生產的細胞系。然后從多個細胞系中篩選生長和生產狀況最好的穩定的細胞系,對之進行生物合成途徑、誘導、固定化及基因修飾等方面的研究,最終在反應器中進行放大生產,以及過程工程調控。
植物細胞培養生產次生代謝產物是有效利用植物資源生產藥物的潛在技術。但產率偏低一直是制約該項技術實現產業化的瓶頸。要有效提高次生代謝物的產量,需要綜合考慮多方面的因素,有時需將多種方案綜合使用才能達到理想的效果[6-8]。首先就是外植體的選擇。不同外植體誘導愈傷組織的能力和誘導的愈傷組織合成次生代謝產物的能力均不同。選擇外植體時應考慮到外植體部位、取材季節、器官生理狀態和發育年齡以及外植體的大小等。本實驗即希望在紅豆杉愈傷組織誘導的外植體選擇及處理環節上給出有意義的結果。
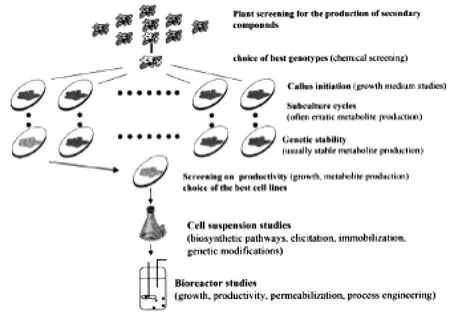
圖1 植物細胞培養生產次生代謝產物的基本方法
1 材料與方法
1.1 材料
東北紅豆杉Taxus cuspidata在大連化物所園區內栽培。
1.2 方法
1.2.1 東北紅豆杉莖和葉中紫杉醇的提取和檢測
取東北紅豆杉莖干粉2 g,葉干粉5 g,置于50 mL離心管中,加入8倍體積分析純甲醇(含體積比為0.01%冰醋酸),超聲提取2次,每次30 min。提取液于4 000 r·min-1下離心10 min,合并上清,25℃旋轉蒸發,定容至25 mL色譜純甲醇,0.22 μm膜過濾備做HPLC。
HPLC條件:Agilent 1100,Hypersil ODS C18柱(4.6 mm×250 mm,5 μm);流動相:V(乙腈)∶V (水)=52∶48,流速1 mL·min-1,檢測波長227 nm,進樣量10 μL。
1.2.2東北紅豆杉愈傷組織誘導
取東北紅豆杉新生莖和幼嫩葉片,按照以下程序,在誘導接種前進行表面消毒:自來水反復沖洗莖和葉片3~4 h;75%乙醇浸泡莖和葉片30 s;取出莖和葉片,用無菌水浸泡5~6次,洗去表面乙醇;用0.1%升汞浸泡莖和葉片,莖泡15 min,葉片泡10 min;用無菌水將莖和葉片反復浸泡洗滌8次,洗凈表面消毒液;取出進行過表面消毒并洗滌過的莖和葉片于滅菌后的培養皿中,用無菌剪刀將其剪成1 cm長的小段(莖)或1 cm2的小塊(葉片),以備接種用。接種時,將剪好的莖和葉片貼服接種于固體培養基表面,每瓶培養基表面均勻排布4個莖段或葉片,每個激素濃度接種10瓶。
部分幼莖采摘后于4℃冰箱中保存3 d,按照以上步驟消毒接種。
東北紅豆杉莖和葉片接種于MS基礎培養基,蔗糖濃度為3%,瓊脂濃度為0.7%,水解乳蛋白質量濃度為600 mg·L-1。激素配比見表1。
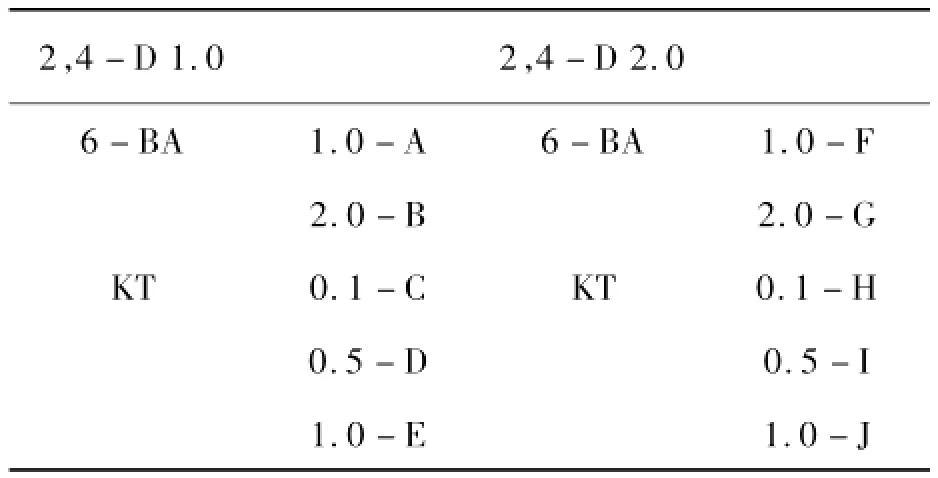
表1 東北紅豆杉愈傷誘導中的激素質量濃度mg·L-1
培養基在高溫滅菌前均調pH=5.8,115℃高壓滅菌15 min。外植體接種后,置于黑暗條件下誘導,培養室溫度(25±2)℃。誘導后,每天觀察有否污染及出愈情況,統計誘導率,并記錄愈傷組織的顏色、質地及生長狀況。誘導率計算公式為:誘導率=(形成愈傷組織的外植體塊數/總接種外植體的塊數)×100%。
1.2.3愈傷組織繼代
愈傷組織繼代周期為30 d/代。繼代時使用無菌手術刀切下無褐化的新鮮愈傷組織,接種至新的培養基表面。繼代培養基同誘導愈傷組織的培養基相同。
2結果與討論
2.1 東北紅豆杉莖和葉中紫杉醇的質量分數
東北紅豆杉紫杉醇的質量分數:莖為0.0081%,葉為0.006 0%。因莖和葉中均含有紫杉醇,故均被選為外植體來誘導愈傷組織,期望獲得含有紫杉醇的愈傷組織進而建立液體懸浮細胞系。
2.2 東北紅豆杉不同外植體愈傷組織誘導率比較
東北紅豆杉不同外植體愈傷組織誘導情況見表2。

表2 東北紅豆杉不同外植體愈傷組織誘導率%
葉子在10種培養基上均基本沒有愈傷產生。莖在10種培養基上均有較高的誘導率,總誘導率為90.9%,低溫處理并沒有提高其誘導率,而是有一定程度的降低,這與文獻報道有所不同。
2.3 東北紅豆杉不同激素處理莖愈傷組織誘導率比較
東北紅豆杉不同激素處理莖愈傷組織誘導情況見表3。
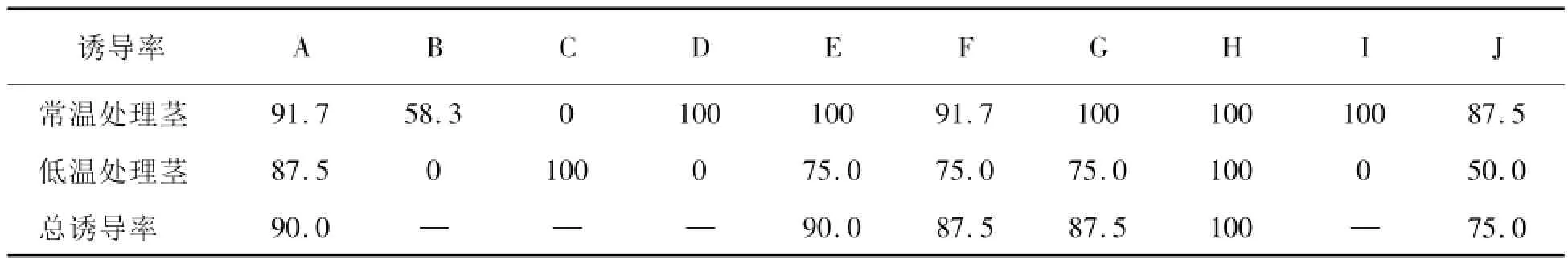
表3 東北紅豆杉不同激素處理莖愈傷組織誘導率%
本試驗中,2,4-D 2.0 mg·L-1,KT 0.1 mg·L-1系以東北紅豆杉莖為外植體誘導愈傷組織最佳的激素配比,莖直接誘導和經低溫處理3 d后誘導的誘導率均達100%,愈傷生長情況分別如圖2、圖3。其次依次為2,4-D 1.0 mg·L-1,6-BA 1.0 mg·L-1;2,4-D 1.0 mg·L-1,KT 1.0 mg·L-1。對于莖愈傷的誘導,最不適合的激素配比為2,4-D 1.0 mg·L-1,6-BA 2.0 mg·L-1,其次為2,4-D 1.0 mg·L-1,KT 1.0 mg·L-1。
愈傷誘導中,有兩個值得注意的現象:粗的莖、較細的莖出愈早且長得好;低溫處理的莖誘導出的愈傷較直接由莖誘導的愈傷褐化程度低。

圖2 東北紅豆杉莖直接誘導得到的愈傷組織(培養基為MS+2,4-D 2.0 mg·L-1,KT 0.1 mg·L-1)

圖3 東北紅豆杉莖經低溫處理后誘導得到的愈傷組織(培養基為MS+2,4-D 2.0 mg·L-1,KT 0.1 mg·L-1)
2.4 東北紅豆杉愈傷傳代
傳代時,愈傷集中接種到新培養基中央較分散傳代長得更快,有新嫩黃愈傷長出。傳代后的愈傷組織生長狀況如圖4。但愈傷整體上生長緩慢,容易褐化。2,4-D 2.0mg·L-1,KT 0.1 mg·L-1雖然是誘導莖產生愈傷組織的最佳培養基,但愈傷傳代過程中出現明顯褐化。比較愈傷誘導和傳代過程中褐化情況,2,4-D 1.0 mg·L-1,6-BA 1.0 mg·L-1為誘導莖產生愈傷組織及愈傷組織傳代的最佳培養基。
2.5 愈傷組織及培養基中紫杉醇的檢測
按照1.2.1的方法提取檢測愈傷組織及其培養基中的紫杉醇,沒有檢測到紫杉醇,只檢測到紫杉烷。這說明雖然活體時紅豆杉莖中含有微量紫杉醇,但經離體培養后其體內的生物合成代謝途徑發生了變化,不再生產紫杉醇。其中的機理留待進一步的實驗研究。

圖4 東北紅豆杉愈傷組織傳代后生長狀況(培養基為MS+2,4-D 1.0 mg·L-1,6-BA 1.0 mg·L-1)
3 結論
2,4 -D 1.0 mg·L-1和6-BA 1.0mg·L-1為東北紅豆杉莖愈傷誘導和傳代的最佳激素配比。低溫預處理外植體可以減輕愈傷組織的褐化,但卻降低了愈傷組織誘導率。在東北紅豆杉愈傷組織及其培養基中均未檢測到紫杉醇,說明外植體在活體和離體情況下次生代謝活動有所不同,內在原因需進一步探索。
[1]VERPOORTE R,VAN DER HEIJDEN R,TENN HOOPEN H J G,et al.Metabolic engineering of plant secondary metabolite pathways for the production of fine chemicals[J].Biotechnol Lett,1999,21:467-479.
[2]RAO S R,RAVISHANKAR G A.Plant cell cultures: Chemical factories of secondary metabolites[J].Biotechnol Adv,2002,20:101-153.
[3]WITHERUP K M,LOOK S A,STASKO M W,et al.Taxus spp.needles contain amounts of taxol comparable to the bark of Taxus brevifolia:analysis and isolation[J].J Nat Prod,1990,53:1249-1255.
[4]元英進,葛志強,馮霞.抗癌新藥紫杉醇和多烯紫杉醇[M].北京:化學工業出版社,2002.
[5]BOURGAUD F,GRAVOT A,MILESI S,et al.Production of plant secondary metabolites:a historical perspective[J].Plant Sci,2001,161:839-851.
[6]SRINIVASAN V,CIDDI V,BRINGI V,et al.Metabolic inhibitors,elicitors,and precursors as tools for probing yield limitation in taxane production by Taxus chinensis cell cultures[J].Biotechnol Prog,1996,12(4):457-465.
[7]QIAN Zhigang,ZHAO Zhenjiang,XU Yufang,et al.Highly efficient strategy for enhancing taxoid production by repeated elicitation with a newly synthesized jasmonate in fed-batch cultivation of Taxus chinensis cells[J].Biotech and Bioeng,2005,90(6):516-521.
[8]周忠強,梅興國.代謝調節劑對紫杉醇和Taxuyunnanine C生物合成的調控作用[J].天然產物研究與開發,2005,17(4):401-403.
Calli Induction of Taxus Cuspidata
GAO Ming-boa,b,LI Xing-taia,RUAN Cheng-jianga,b
(a.College of Life Science;b.Key Laboratory of Biochemical Engineering(SEAC-ME),Dalian Nationalities University,Dalian Liaoning 116605,China)
Taxol of stems and leaves of Taxus cuspidata has been extracted and determined,which shows that both stems and leaves contain trace taxol,while the content of stems is a little higher than that of leaves.Taken stems and leaves as explants,and taken MS basal media as media,ten kinds of hormone combinations have been applied to induce calli in dark.According to the calli inductivity,calli vegetative state,and browning degree during the calli subculture,2,4-D 1.0 mg·L-1and 6-BA 1.0 mg·L-1are the best hormone combination to induce and subculture calli from stems of T.cuspidata.Low temperature pretreatment is good to alleviate browning of calli,while reduces the calli inductivity.Taxol is not detected in the calli and media.
Taxus cuspidata;MS media;calli induction
Q813.11
A
1009-315X(2011)03-0256-04
2010-12-07;最后
2011-03-01
大連民族學院青年科研基金項目(2009A202)。
高明波(1974-),女,山東萊陽人,講師,博士,主要從事植物細胞工程研究。
(責任編輯 鄒永紅)

