硫酸氫銨分解NH4Cl制備NH3和HCl工藝研究
張憲軍,李樹春,張振霞,崔美琴
(大連化工研究設計院,遼寧 大連 116023)
科學試驗
硫酸氫銨分解NH4Cl制備NH3和HCl工藝研究
張憲軍,李樹春,張振霞,崔美琴
(大連化工研究設計院,遼寧 大連 116023)
對氯化銨分解的硫酸氫銨法進行了驗證性的研究。同傳統的專利及其它報道相比,采用本文的工藝,可使氯化銨的轉化率達到95%。結果表明,當NH4HSO4:NH4Cl的摩爾比為4∶1時,反應溫度在220~350℃之間,氯化銨轉化率≥95%,氨氣收率、氯化氫收率均≥95%。
氯化銨分解;硫酸氫銨;氨氣;氯化氫
由于聯堿的快速發展,氯化銨產量越來越多,面臨過剩的問題。目前氯化銨主要用途是農業肥料,工業上少量使用,由于氯化銨用途的限制,開辟氯化銨新用途勢在必行,這樣可以促進具有自主知識產權的聯堿工業健康地發展。尋求新的技術將氯化銨分解成氯化氫和氨,使氯化銨成為化工原料,將純堿化工與有機氯化工緊密地聯系到一起。所以氯化銨分解技術對于聯堿的發展具有戰略意義。
目前,在世界上氯化銨分解技術還沒有大規模工業化應用,只有少量的專利和文獻對氯化銨分解的工藝提出了一些設想并進行了初步探索。美國專利、日本專利,還有 Kessler等[1~3]提出將氯化銨固體或氣體通過與硫酸銨或硫酸氫銨共混熔融后分步反應的方法進行分解。清華大學的翟廣偉等人論述了硫酸銨或硫酸氫銨法[4],氯化銨的轉化率不到20%,HCl收率不到20%。當然還有其它的方法,比如堿金屬化合物法等等。
上述文獻大多數對硫酸氫銨法分解氯化銨進行了簡單的描述或有限的實驗論證,缺乏詳細的工藝和理論研究,并據此得出該方法的NH4Cl轉化率低,操作困難,易升華,不具有可行性。本工作著重對硫酸氫銨法進行了驗證性研究,最終找到了優化的工藝條件。
1 氯化銨分解原理
NH4Cl受熱分解成NH3和 HCl,但同時會有大量的NH4Cl升華,為了得到NH3和HCl,一種可行的方法就是在反應物中加入一種可循環使用的酸性物質或者堿性物質,簡單的說,先固定一種氣體(NH3或 HCl),釋放另一種氣體(HCl或NH3)。無論何種NH4Cl分解方法,歸結起來可表示[5]:
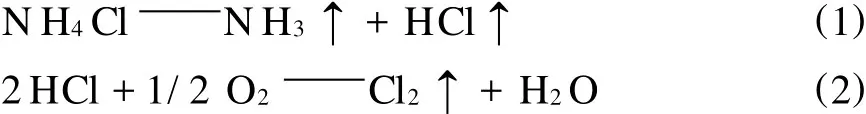
從化學熱力學觀點看,反應所需要的能量為狀態函數,在任何一定的溫度及壓力下,反應物和生成物的相態一定,無論采用哪種方法及循環過程,制取NH3和Cl2(HCl)其所需能量不能小于指定條件下發生反應(1)、(2)理論所需要的能量。但是由于分解方法不同,即反應溫度、壓力及相態有差異,則能量的消耗不一致。在實際循環過程中有能量的損失,所以能耗遠遠超過理論能量。因此,不管采用哪種分解方法,在過程中能否做到能量的合理利用及降低能量的損失,是評價NH4Cl分解方法優劣的標志。當然,在選擇方法時,過程的復雜程度、設備與材質的利用和腐蝕狀況、反應條件的難易程度等,也是必須考慮的問題。
硫酸銨的熱分解[6]已有詳細研究,本文主要研究通過不同的反應方式提高氯化銨的轉化率以及產物的收率。
2 試 驗
2.1 試驗原理
將NH4Cl加到硫酸氫銨熔融物中使硫酸氫鹽溫度為220~270℃,將游離態的HCl放出。此時,相當于NH3“被固定”,另一生成物基本為硫酸銨;

繼續升溫至330~350℃,硫酸銨分解釋放出NH3,另一產物基本為硫酸氫銨。硫酸氫銨進行下一次反應,循環使用。

2.2 試驗方法
試驗方法分為兩種反應方式。一是將一定配比的NH4Cl加入到常規反應的硫酸氫銨熔融物中;二是將一定配比的NH4Cl加入到半連續接觸式反應的硫酸氫銨熔融物中。兩種反應方式進行對比。
2.2.1 常規反應NH4Cl分解試驗
在常規反應器中將已處理NH4HSO4加熱,加入一定量的NH4Cl,繼續升溫到220~270℃,用pH試紙檢測有 HCl氣體放出,收集并計量。待無HCl放出后,繼續升溫至330~350℃后,用pH試紙檢測有NH3放出,收集并計量。直至無NH3放出,停止反應。稱重反應器,計算NH4Cl轉化率。反應過程中可觀察到有升華的白色NH4Cl固體結晶。試驗結果如表1所示。

表1 NH4Cl和NH4HSO4常規反應的試驗結果
2.2.2 半連續接觸反應NH4Cl分解試驗
在半連續接觸反應器中將已處理NH4HSO4加熱,通過調節加料器加入一定量的NH4Cl,升溫到220~270℃,用pH試紙檢測有 HCl氣體放出,收集并計量生成的HCl氣體。待無HCl氣體放出后,繼續升溫至330~350℃后,用pH試紙檢測有NH3氣體放出,收集并計量生成的NH3氣體。直至無NH3氣體放出,停止反應。計算NH4Cl轉化率。反應過程中沒有明顯觀察到有升華的白色NH4Cl固體結晶。試驗結果如表2所示。
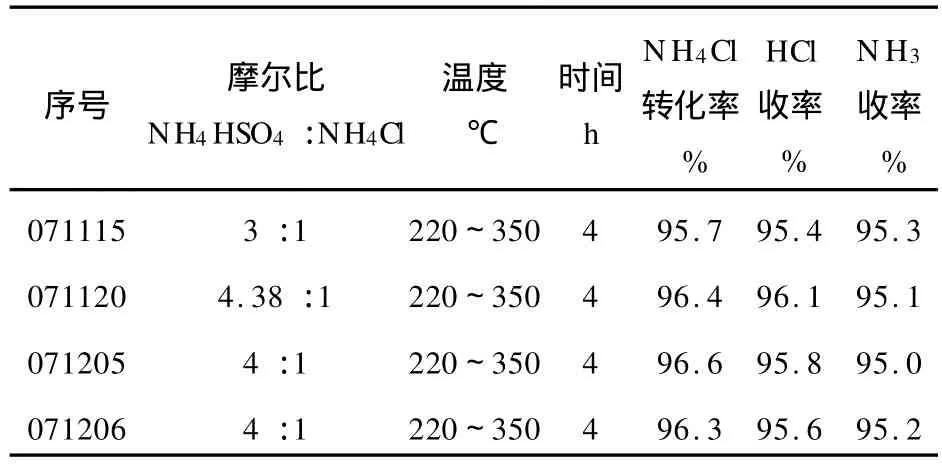
表2 NH4Cl和NH4HSO4半連續接觸反應的試驗結果
3 試驗結果與討論
1)硫酸氫銨法分解氯化銨的試驗工藝是可行的。通過我們的半連續接觸反應方法,氯化銨的轉化率以及HCl、NH3收率有明顯提高。
2)工業應用上需要選擇能夠在高溫下耐酸堿腐蝕的金屬材質。若解決了材質問題,工業應用就變得容易。
3)升華的氯化銨可通過回收重復利用。這樣可提高氯化銨的利用率和轉化率。
4)硫酸氫銨法分解氯化銨的最佳工藝條件是:
①NH4HSO4:NH4Cl的摩爾比=4∶1;
②加料方式:半連續接觸法;
③反應溫度:220~270℃分解回收 HCl氣體; 330~350℃分解回收NH3氣體;
④反應時間:4h。
在此條件下,NH4Cl轉化率≥95%;NH3、HCl氣體的收率為≥95%。
[1] 平賀要一.[P].JP:58-161902,1983-09-26
[2] SasakiH,TakaharaY.[P].US:4293532,1981-10-16
[3] ClaflinC.H.[P].US:2787524,1957-04-02
[4] 翟廣偉,韓明漢,梁耀彰,高光華.氯化銨分解制氨氣和氯化氫工藝 [J]過程工程學報.2009,9(1):59~62
[5] 張洪如.氯化銨的分解[J].純堿工業,1982(5):41~43
[6] 劉科偉.硫酸銨的熱分解[J].化學研究與應用,2002, 14(6):737~738,765
TQ113.7;TQ114.162
A
1005-8370(2011)04-03-03
2011-03-22
張憲軍(1970—)大學本科,高級工程師。1996年畢業于華北工學院,現從事純堿及純堿生產助劑方面的研發工作。

