低磷脅迫對山核桃幼苗根系形態和生理特征的影響
李永夫,金松恒,葉正錢,黃堅欽,姜培坤
(1.浙江林學院 環境科技學院,浙江 臨安 311300;2.浙江林學院-中國科學院南京土壤研究所森林土壤與環境聯合實驗室,浙江 臨安 311300;3.浙江林學院 浙江省現代森林培育技術重點實驗室,浙江 臨安 311300)
缺磷是植物生長的主要限制因素之一[1]。以往的不少研究結果表明,植物在低磷脅迫條件下會呈現出一系列的適應性反應。例如,植物根變長、根毛數量和密度增大、形成排根等[2]以及根構型發生改變,從而有利于植物對土壤磷的吸收[3]。缺磷還會導致光合作用產物分配,從而使根冠比增加[2]。另外,葉片酸性磷酸酶活性和根系分泌酸性磷酸酶活性增加也是很多植物對低磷脅迫的反應之一[4]。因此,如何挖掘植物自身抵抗低磷脅迫的能力,為緩解土壤磷素生物有效性低下的問題提供了新的途徑[5]。而深入系統研究植物對低磷脅迫的適應性機制對于能否有效應用上述新途徑具有非常重要的意義。山核桃Carya cathayensis是中國特有的名優干果和木本油料作物,具有非常高的營養、保健、美容及藥用價值[6]。近幾年來,浙江省臨安市山核桃生產迅速發展,也為當地農民的收入增加起到了重要的作用。初步調查發現,品質好的山核桃大部分都生長于石灰性母質發育的土壤上。而這種類型的土壤,養分(特別是磷養分)一般都比較貧瘠,并且養分的有效性也低。然而,在野生狀態下,山核桃樹營養狀況正常。因此,我們可以推測,山核桃在適應低磷脅迫方面具有主動性適應機制。就目前調查的資料而言,關于山核桃根系形態和生理特性對低磷脅迫的反應方面的研究在國內外還鮮有報道。筆者以1年生山核桃幼苗為試驗材料,通過溶液培養試驗,研究低磷脅迫處理對山核桃根性形態、葉片光合作用特性以及葉片和根系分泌酸性磷酸酶活性的影響,為提高山核桃磷養分的利用效率提供依據。
1 材料與方法
1.1 供試材料
本研究植物材料為1年生山核桃苗。
1.2 試驗設計和方法
水培試驗于2007年3-6月在浙江林學院人工智能氣候室內進行。營養液按照霍格蘭營養液作一定調整后配制。營養液配方如下:Ca(NO3)2·4H2O 2.00 mmol·L-1,KH2PO40.10 mmol·L-1,MgSO4·7H2O 0.50 mmol·L-1,KCl 0.10 mmol·L-1,K2SO40.70 mmol·L-1,H3BO310.00·mol·L-1,MnSO4·H2O 0.50 μmol·L-1,ZnSO4·7H2O 1.00 μmol·L-1,CuSO4·5H2O 0.20 μmol·L-1,(NH4)6Mo7O240.01 μmol·L-1,Fe-EDTA 100 μmol·L-1。供試山核桃植株取自山核桃栽培基地,運回實驗室后用自來水沖洗干凈,選擇大小均一的山核桃幼苗移植到含有36 L正常培養液的塑料培養槽中。培養2周后(山核桃達1片真葉時)按照以下處理繼續培養:試驗設 2 個供磷水平:0.02 mmol·L-1(低磷處理),0.10 mmol·L-1(正常供磷處理)。磷以KH2PO4形態供應。試驗設3個重復。在處理后的培養過程中每天用pH計測定營養液pH值,并用 0.1 mol·L-1氫氧化鈉或 0.1 mol·L-1氯化氫調節營養液至 pH 5.8,保持 24 h連續通氣,6 d換1次營養液。連續處理36 d后收獲。
1.3 樣品處理和測定方法
1.3.1 氣體交換參數測定 山核桃葉片的氣體交換參數用Li-6400紅藍光源 6400-02(Li-Cor公司,USA)測定。該儀器可以原位測定葉片的光合速率、胞間二氧化碳摩爾分數、氣孔導度等參數。測定的葉片為山核桃的第1片完全展開葉。時間為不同磷處理后第28天上午8∶30-10∶00。葉室設定參數如下:溫度為 28 °C,二氧化碳摩爾分數為 390 μmol·mol-1,光合有效輻射(PAR)為 1 000 μmol·m-2·s-1。
1.3.2 根系形態 收獲植株后,先用自來水沖洗干凈,然后立即將根系樣品保存于體積分數為25%的乙醇溶液中。采用 Win-Rhizo(Regent Instruments,Canada)根系分析儀對根系根長、根表面積和根體積進行定量分析。
1.3.3 酸性磷酸酶活性 山核桃幼苗葉片酸性磷酸酶活性的測定參照 McLachlan等[7]的方法略作改動。取山核桃幼苗的第一完全展開葉,去掉葉基和葉尖部分,稱取一定質量的鮮樣(0.1~0.2 g)后,快速用液氮冷凍。樣品加入5.00 mL濃度為0.20 mol·L-1的冰醋酸-醋酸鈉緩沖液(pH 5.8),在冰浴中研磨勻漿,將勻漿溶液轉入10.00 mL離心管,27 000×g離心10 min(4°C)。上清液為酶測定液。測定反應如下:0.05 mL酶液 +0.45 mL緩沖液 +4.50 mL 5 mmol·L-1對硝基苯酚磷酸鹽,30°C黑暗中保溫30 min后,加2.00 mL 2.00 mol·L-1氫氧化鈉中止反應。在405 nm處測定吸光度值,以無酶反應作空白調0。同時作對硝基苯酚的標準曲線,根據標準曲線算出反應體系中生成的對硝基苯酚的量。山核桃幼苗葉片酸性磷酸酶活性以單位時間單位鮮質量所生成的對硝基苯酚的微摩爾數來表示。山核桃幼苗根系分泌酸性磷酸酶活性的測定參考 Ni等[8]的方法。取正常供磷處理和低磷處理的山核桃幼苗各1株,用去離子水將山核桃根系洗干凈,然后將山核桃植株移至盛有500.00 mL營養液的三角瓶中(正常供磷處理和低磷處理的山核桃植株分別移至正常營養液和低磷營養液中,營養液中對硝基苯酚磷酸二鈉的濃度均為1.00 mmol·L-1)。三角瓶外面用2層黑色塑料薄膜包住。以不培養植株作為對照。正常光溫條件下培養2 h,吸取1.00 mL反應液加入到含5.00 mL 1.00 mol·L-1氫氧化鈉的試管中,搖勻后在405 nm處測定吸光度值,以無酶反應作空白調0。試驗結束后,剪取根系,稱其鮮質量。山核桃幼苗根系分泌酸性磷酸酶活性以單位時間單位根鮮質量所生成的對硝基苯酚微摩爾數來表示。1.3.4 根系干質量和磷質量分數 地上部和地下部樣品用去離子水沖洗幾遍。將鮮樣先在105℃下殺青30 min,再在70℃下烘48 h(至恒量),測定其干物質量。再用萬能不銹鋼粉碎機磨細,過60目篩,放在封口袋里,供礦質元素分析測定用。植物樣品用濃硫酸-過氧化氫消煮,采用鉬蘭比色法測植株全磷[9]。
1.4 數據統計
數據進行方差分析,并用新復極差法進行多重比較。數據的統計分析均在Microsoft Excel和SAS 8.0軟件上進行。
2 結果與分析
2.1 低磷脅迫對山核桃植株干質量和根冠比的影響
從圖1可以看出,與正常供磷相比,低磷脅迫處理顯著降低山核桃植株的干重(P<0.05)。低磷脅迫條件下的根干質量為正常供磷條件下的74.7%(圖1-A);低磷脅迫下的植株地上部干質量為正常供磷的53.2%(圖1-B)。低磷脅迫顯著增加山核桃植株的根冠比(P<0.05)(圖1-C)。
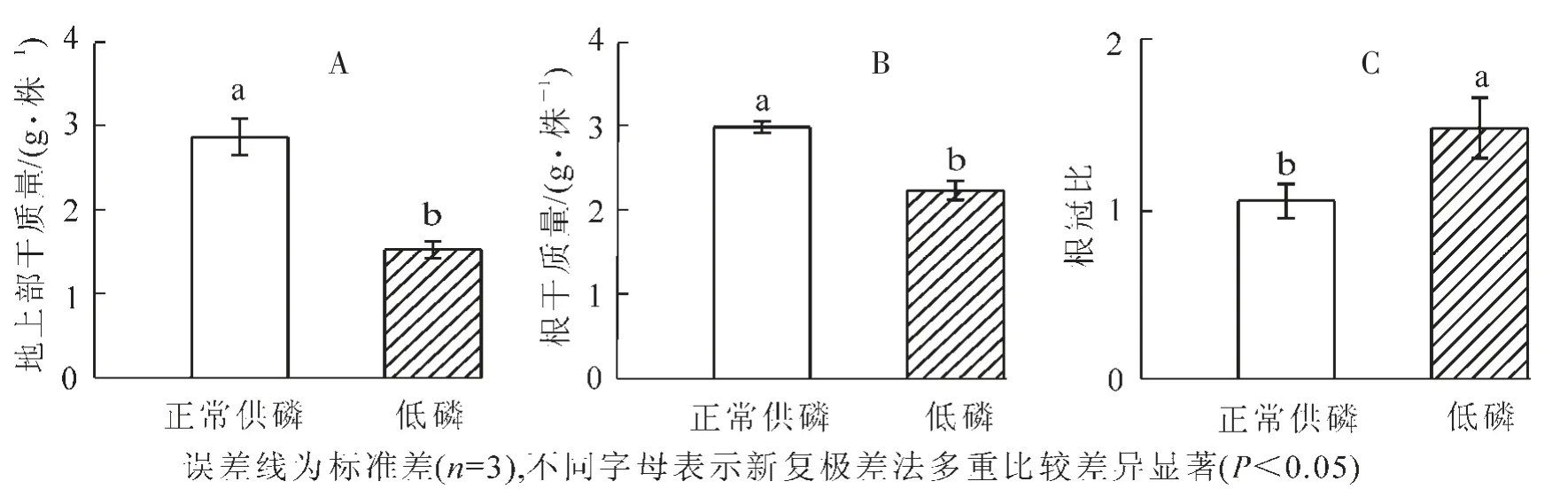
圖1 低磷處理對山核桃干物質量(A,B)和根冠比(C)的影響Figure 1 Effect of low P treatment on the dry weight and root/shoot dry weight ratio of hickory
2.2 低磷脅迫對山核桃磷營養特性的影響
從表1可見,低磷處理顯著降低山核桃植物的磷質量分數和磷積累量。與正常供磷相比,低磷處理條件下山核桃地上部和根系磷質量分數分別下降81.1%和79.4%;與正常供磷相比,低磷處理條件下山核桃地上部和根系磷積累量分別下降89.1%和85.9%。與正常供磷條件相比,低磷處理顯著增加磷在根部的分布(P<0.05)(表1)。
2.3 低磷脅迫對山核桃根系形態特性的影響
從圖2可見,低磷脅迫對于山核桃的根系形態具有非常顯著的影響。與正常供磷相比,低磷處理顯著降低山核桃的根長、根表面積和根體積(P<0.01)。低磷處理條件下山核桃根長、根表面積和根體積分別為正常供磷條件下的66.1%,66.0%和72.7%。
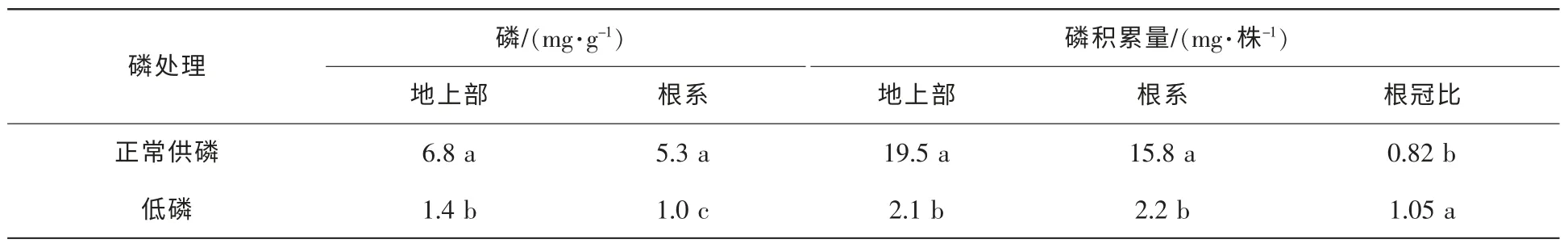
表1 低磷處理對山核桃地上部和根系的磷質量分數和磷積累量的影響Table 1 Effect of low P treatment on the concentration and accumulation of P in shoots and roots of hickory

圖2 低磷處理對山核桃根長(A),根表面積(B)和根體積(C)的影響Figure 2 Effect of low P treatment on root length(A),root surface area(B),and root volume(C)of hickory seedlings
2.4 低磷脅迫對山核桃葉片光合作用特性的影響
從圖3可見,低磷處理顯著降低山核桃葉片的光合速率和氣孔導度(P<0.05)。與正常供磷的植株相比,低磷處理使山核桃葉片光合速率下降30.3%(圖3-B)。但是對葉片胞間二氧化碳摩爾分數沒有顯著的影響(圖3-C)。

圖3 低磷處理對山核桃葉片光合速率(A),氣孔導度(B)和胞間二氧化碳(C)的影響Figure 3 Effect of low P treatment on photosynthetic rate(A),stomatal conductance(B),intercellular CO2concentration(C)in the leaf of hickory
2.5 低磷脅迫對山核桃葉片和根系分泌酸性磷酸酶活性的影響
正常供磷和低磷處理條件下山核桃葉片酸性磷酸酶活性和根系分泌酸性磷酸酶活性如圖4所示。低磷脅迫使山核桃葉片酸性磷酸酶活性和根系分泌酸性磷酸酶活性顯著增加(P<0.05),分別為正常供磷處理下的135%和159%。
3 討論
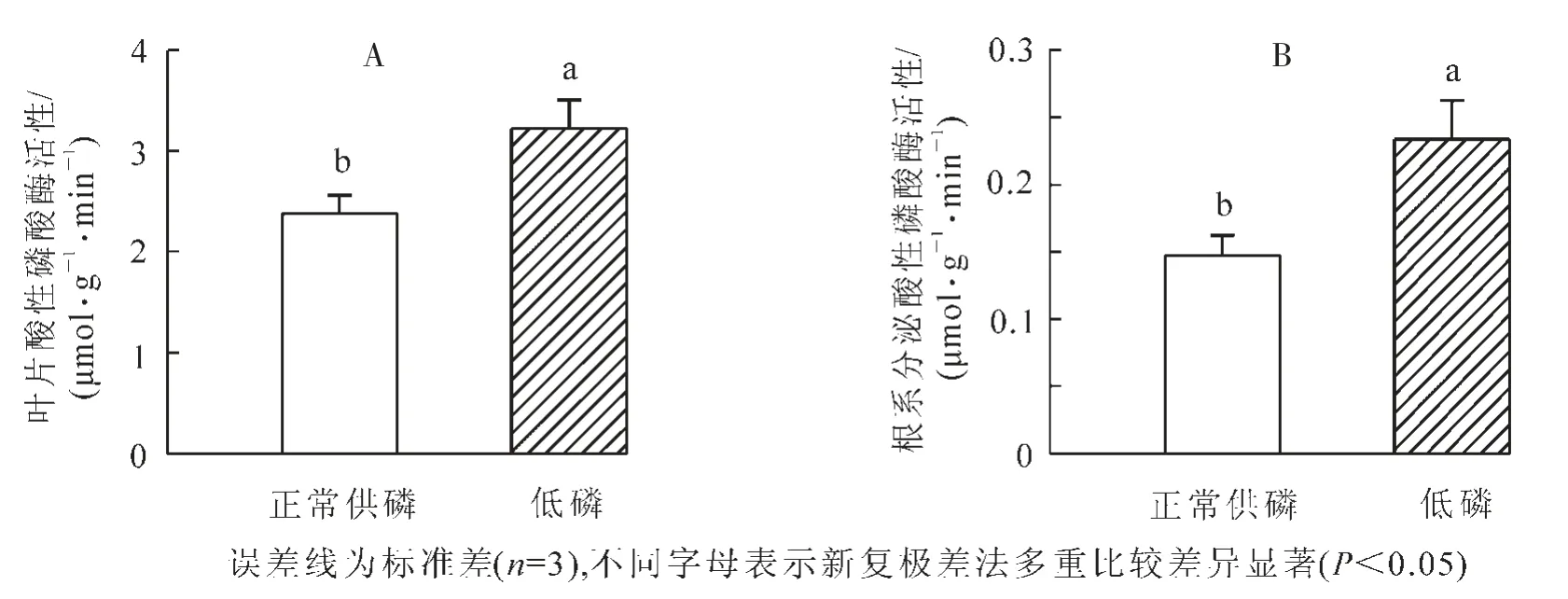
圖4 低磷處理對山核桃葉片酸性磷酸酶活性(A)和根系分泌酸性磷酸酶活性(B)的影響Figure 4 Effect of low P treatment on leaf acid phosphotase activity(A)and root secreted acid phosphotase activity(B)in hickory
以往的大量結果表明,植物的生長發育以及產量會在很大程度上受到磷供應水平的影響[2]。本研究結果表明,低磷處理顯著降低山核桃植株幼苗地上部和根系的干質量,但是兩者降低的幅度不同。低磷處理對地上部植株干質量的影響要顯著高于對根系干質量的影響。另外,低磷處理顯著增加山核桃植株的根冠比。這跟其他植物如水稻 Oryza sativa[10],大豆 Glycine max[11],馬尾松 Pinus massoniana[12],水曲柳Fraxinus mandshurica[13]等的報道相似。上述結果表明,低磷處理條件下,盡管地上部和根系干質量都顯著下降,但是植物受到低磷脅迫時,會首先保證根系的生長。也有研究報道,低磷處理條件下地上部干物質質量顯著降低,而根系干質量非但沒有降低甚至還有少許增加[14]。從本研究根冠比的結果也可以說明,低磷處理條件下,山核桃會分配更多的干物質到根系,從而優先保證根系的生長,使根系能夠盡可能地吸收養分,從而減少植物生長受到低磷脅迫的影響。
大量研究結果表明,植物根系形態特征和磷素養分的吸收有著非常密切關系[15]。例如,Newman等[16]報道小麥Triticum aestivum的吸磷量與根系總長度呈顯著正相關。李海波等[2]的研究結果表明低磷條件下,根系總表面積、側根總長度以及側根數量均與水稻的吸磷量存在顯著正相關。Borkert等[17]的研究結果表明,大豆吸磷量只與根系總表面積呈顯著正相關,而與根長、平均根軸和根干質量等都沒有顯著相關性。這表明,植物的根系形態會與植物吸收磷素養分具有非常密切關系。同時,以往不少研究還發現,低磷脅迫會誘導根系形態發生變化(如根變長、根毛數量和密度增大等)[15]。上述這些變化無疑會促進植物對磷素的吸收。而在本研究結果中,我們并沒有發現低磷處理增加山核桃根長或者根表面積的現象。這可能與低磷脅迫的程度以及植物種類有關。一般來講,當植株受到輕度低磷脅迫的時候,植物會出現根長變長,側根增加的現象。然而,隨著低磷脅迫程度的加深,植株整個根系的生長可能會受到影響,從而使植株根系的各個形態特征(如根長、根表面積和根體積)都有顯著下降。因此,從本研究結果來看,山核桃的根系形態反應不是山核桃適應低磷脅迫的主要機制之一。
低磷處理顯著降低植株葉片光合速率在C3和C4植物上均有報道[18-19]。本研究結果表明,低磷處理導致山核桃植株的葉片光合速率下降33.3%。一般來講,導致光合速率下降主要有2個因素:①氣孔因素,主要受氣孔數量、氣孔孔徑和氣孔開度等的影響[20]。②非氣孔因素,主要受內部的酶活力和光合組分控制。而在以往的研究中,低磷處理影響植物葉片光合速率的機制既包括氣孔因素又包括非氣孔因素[18-19]。本研究結果表明,低磷處理顯著降低山核桃植株的氣孔導度,但對山核桃葉片胞間二氧化碳摩爾分數并沒有顯著的影響。這表明低磷脅迫對山核桃葉片光合速率的抑制作用主要是由于非氣孔因素引起的。Fredeen等[18]的研究結果也表明,磷缺乏引起菜豆Phaseolus vulgaris光合速率的下降主要是由非氣孔因素引起的。由于磷缺乏造成葉片光合速率下降的影響因子較多,因此,還需在以后的試驗中作深入研究。
低磷脅迫下植物根系分泌酸性磷酸酶活性的增加已經被許多研究學者認為是植物適應低磷脅迫的機制之一[4]。以往的研究結果表明,玉米 Zea mays[21]和羽扇豆 Lupinus micranthus[22]受到低磷脅迫時,根系分泌酸性磷酸酶活性顯著增加。本研究的結果表明,與正常供磷的植株相比,低磷脅迫使山核桃根系分泌酸性磷酸酶活性增加了59%。由于有機磷是土壤磷素的重要組成部分[23],因此,根系分泌磷酸酶活性的增加將促進土壤中有機磷的水解,從而提高土壤中磷的生物有效性。如Asmar等[24]的研究結果表明5個大麥Hordeum vulgare基因型根際NaHCO3-Po的虧缺程度與根系分泌的酸性磷酸酶活性呈顯著的正相關。另外,從本研究的結果表明,低磷處理顯著增加了山核桃葉片酸性磷酸酶活性,這與以往在其他植物如玉米[21,25]、 小麥[26]、 菜豆[27]和大豆[28]上的研究結果基本一致。植物葉片酸性磷酸酶活性的提高,可以促進植物利用有機磷,從而提高植物的磷利用效率。因此,低磷處理條件下,根系分泌酸性磷酸酶和葉片酸性磷酸酶活性的提高可能是山核桃適應低磷脅迫的機制之一。
[1]HINSINGER P.Bioavailability of soil inorganic P in the rhizosphere as affected by root-induced chemical changes:a review[J].Plant Soil,2001,237:173-195.
[2]李海波,夏銘,吳平.低磷脅迫對水稻苗期側根生長及養分吸收的影響[J].植物學報,2001,43(11):1154-1160.LI Haibo,XIA Min,WU Ping.Effect of phosphorus deficiency stress on rice lateral root growth and nutrient absorption[J].Acta Bot Sin,2001,43(11):1154-1160.
[3]LIAO Hong,YAN Xiaolong.Adaptive changes and genotypic variation for root architecture of common bean in response to phosphorus deficiency[J].Acta Bot Sin,2000,42(2):158-163.
[4]VANCE C P,UHDE-STONE C,ALLAN D L.Phosphorus acquisition and use:critical adaptations by plants for securing a nonrenewable resource[J].New Phytol,2003,157:423-447.
[5]戴開杰,沈有信,周文君,等.在控制條件下云南松幼苗根系對低磷脅迫的相應[J].生態學報,2005,25(9):2423-2426.DAI Kaijie,SHEN Youxin,ZHOU Wenjun,et al.Mechanism of Pinus yunnanensis seedlings root response to phosphorus deficiency under controlled conditions[J].Acta Ecol Sin,2005,25(9):2423-2426.
[6]錢新標,徐溫新,張圓圓,等.山核桃果仁微量元素分析初報[J].浙江林學院學報,2009,26(4):511-515.QIAN Xinbiao,XU Wenxin,ZHANG Yuanyuan,et al.Trace elements in kernels of Chinese hickory(Carya cathayensis)grown in limestone and noh-limestone soils[J].J Zhejiang For Coll,2009,26(4):511-515.
[7]MCLACHLAN K D,ELLIOTT D E,De MARCO D G,et al.Leaf acid phosphatase isozymes in the diagnosis of phosphorus status in field-grown wheat[J].Aust J Agr Res,1987,38:1-13.
[8]NI Junjian,WU Ping,LUO Ancheng,et al.Low phosphorus effects of the metabolism on rice seedlings[J].Commun Soil Sci Plan Anal,1996,27:3073-3084.
[9]魯如坤.土壤農業化學分析方法[M].北京:中國農業科技出版社,1999:312-314.
[10]李永夫,羅安程,黃繼德,等.不同磷效率水稻基因型根系形態和生理特性的研究[J].浙江大學學報:農業與生命科學版,2006,32(6):658-664.LI Yongfu,LUO Ancheng,HUANG Jide,et al.Study on the morphological and physiological characteristics of roots in rice genotypes with contrasting P efficiency[J].J Zhejiang Univ Agric & Life Sci,2006,32(6):658-664.
[11]CAKMAK I,HENGELER C,MARSCHNER H.Partitioning of shoot and root dry matter and carbohydrates in bean plants suffering from phosphorus,potassium and magnesium deficiency[J].J Exp Bot,1994,45:1245-1250.
[12]徐向華,丁貴杰.馬尾松適應低磷脅迫的生理生化響應[J].林業科學,2006,42(9):24-28.XU Xianghua,DING Guijie.Physiological and biochemical responses of Pinus massoniana to low phosphorus stress[J].Sci Silv Sin,2006,42(9):24-28.
[13]吳楚,范志強,王政權.氮磷供應狀態對水曲柳幼苗氮磷吸收與生長的影響[J].林業科學,2005,41(5):196-200.WU Chu,FAN Zhiqiang,WANG Zhengquan.Influences of nitrogen and phosphorus supply on their absorption and growth of Fraxinus mandshurica seedlings[J].Sci Silv Sin,2005,41(5):196-200.
[14]MING Feng,MI Guohua,ZHANG Fusuo,et al.Differential response of rice plants to low-phophorus stress and its physiological adaptive mechanism[J].J Plant Nutr,2002,25:1213-1224.
[15]RAGHOTHAMA K G.Phosphate acquisition[J].Ann Rev Plant Physiol Plant Mol Biol,1999,50:665-693.
[16]NEWMAN E I,ANDREWA R E.Uptake of phosphorus and potassium in relation to root growth and root density[J].Plant Soil,1973,38:49-69.
[17]BORKERT C M,BARBER S A.Effect of supplying P to a portion of the soybean root system on root growth and P up-take kinetics[J].J Plant Nutr,1983,6:685-910.
[18]FREDEEN A L,RAO I M,TERRY N.Influence of phosphorus nutrition on growth and carbon partitioning in Glycine max[J].Plant Physiol,1989,89:225-230.
[19]JACOB J,LAWLOR D W.Stomatal and mesophyll limitations of photosynthesis in phosphate deficient sunflower,maize and wheat plants[J].J Exp Bot,1991,42:1003-1011.
[20]QUICK W P,CHAVES M M,WENDLER R,et al.The effect of water stress on photosynthetic carbon metabolism in four species grown under field conditions[J].Plant Cell Environ,1992,15:25-35.
[21]YUN S J,KAEPPLER S M.Induction of maize acid phosphatase activities under phosphorus starvation[J].Plant Soil,2001,237:109-115.
[22]WASAKI J,YAMAMURA T,SHINANO T,et al.Secreted acid phosphatase is expressed in cluster roots of lupin in response to phosphorus deficiency[J].Plant Soil,2003,248:129-136.
[23]DALAL R C.Soil organic phosphorus[J].Adv Agron,1997,29:83-117.
[24]ASMAR F,GAHOONIA T S,NIELSEN N E.Barley genotypes differ in activity of soluble extracellular phosphatase and depletion of organic phosphorus in the rhizosphere soil[J].Plant Soil,1995,172(1):117-122.
[25]GEORGE C E,LAUCHLI A.Evaluation of an acid phosphatase assay for detection of phosphorus deficiency in leaves of maize(Zea mays L.)[J].J Plant Nutr,1986,9:1469-1477.
[26]MCLACHLAN K D.Effects of drought,aging and phosphorus status on leaf acid phosphatase activity in wheat[J].Aust J Agric Res,1984,35:777-787.
[27]YAN Xiaolong,LIAO Hong,MELANIE C,et al.Induction of a major leaf acid phosphatase does not confer adaptation to low phosphorus availability in common bean[J].Plant Physiol,2001,125:1901-1911.
[28]TIAN Jiang,LIAO Hong,WANG Xiurong,et al.Phosphorus starvation-induced expression of leaf acid phosphatase isoforms in soybean[J].Acta Bot Sin,2003,45:1037-1042.

