Pd/C和Raney Ni催化劑的制備及其催化活性比較
李 平 , 劉金廷, 王 偉
(1. 銀川大學 石油化工學院,寧夏 銀川 750105; 2. 長春工業大學 化工學院,吉林 長春 1320012)
呋喃的加氫類似于苯加氫,條件較為苛刻[1]。氫化反應中使用最多的催化劑是鈀系列催化劑[2~4],但存在價格昂貴、容易失活、轉化率不高等缺點。Co或Mo催化劑也有過報道[5]。
本文制備了Pd/C和Raney Ni催化劑,其結構和性能經XRD, BET和SEM表征。以呋喃加氫制備THF為探針反應,對兩種催化劑的催化活性進行了比較。探討了反應溫度、反應壓力和催化劑用量對呋喃轉化率和THF選擇性的影響,旨在尋找最佳的加氫催化劑和工藝條件。
1 實驗部分
1.1 儀器與試劑
GS-0.25型不銹鋼高壓釜(威海金鑫石化廠);Agilent Technologies 6890型氣相色譜儀(安捷倫公司)。
呋喃,自制,純度>99.9%;粉末活性炭,工業純,江蘇麗陽活性炭聯合工廠;二氯化鈀,分析純,北京化學試劑廠;乙醇,分析純,北京化學試劑廠;高純氫(99.99%);鹽酸,分析純,北京化工廠;鎳鋁合金,分析純,國藥集團化學試劑有限公司。
1.2 催化劑的制備
(1) Pd/C的制備
活性炭的預處理:將活性炭25 g置于燒瓶中,加入鹽酸20 mL后沸煮4 h。冷卻至室溫,過濾,濾餅用蒸餾水洗至中性,烘干得純化的活性炭(AC)。
PdCl2溶解: 將PdCl210 mg用10 mmol·L-1HCl(pH 2)25 mL溶解得PdCl2的HCl溶液。
PdCl2浸漬: 在燒瓶中加入AC 25 g和蒸餾水20 mL,加熱至沸騰后加入PdCl2的HCl溶液25 mL,攪拌下沸騰2 h后超聲(頻率28 KHz,功率30 W)15 min。抽濾,濾餅用蒸餾水反復沖洗。加入30%氫氧化鈉,使pH大于10,攪拌下滴加37%甲醛(繼續用30%氫氧化鈉調pH大于10,直到pH值不再下降),滴畢,還原3 h。冷卻至室溫,過濾,濾餅用蒸餾水反復洗滌得Pd/C催化劑,置干燥器中備用。
(2) Raney Ni的制備
用固相浸漬法(該法已申請中國專利):將氫氧化鈉40 g和鎳鋁合金20 g放入三口瓶中,攪拌下于60 ℃緩慢滴加蒸餾水250 mL,滴畢,于60 ℃活化2 h。傾去上層堿液后用蒸餾水洗至中性;用無水乙醇洗3次~4次,在無水乙醇中保存備用。
1.3 THF的合成
在高壓釜中加入呋喃20 mL,溶劑甲醇[V(呋喃) ∶V(甲醇)=2 ∶ 3]和催化劑,于一定的壓力下反應一定的時間。取樣進行氣相色譜分析,確定呋喃的轉化率和THF的收率。
2 結果與討論
2.1 催化劑的表征
(1) Raney Ni催化劑的XRD分析
圖1為鎳鋁合金和Raney Ni的XRD譜圖。由圖1可知,合金主要由Al3Ni和Al3Ni2兩種晶相組成,只有當鎳鋁合金生成了這兩種晶相,經活化得到的骨架鎳催化劑才會具有加氫活性。Al3Ni脫鋁后,殘余鋁量少,而Al3Ni2相脫鋁后,形成的鎳晶體以孿晶相及重孿晶形式出現,顆粒中存在著納米孔洞,保有空位和缺陷,為吸附、活化反應物分子提供良好的環境;而Al3Ni2不易破碎,在顆粒中心合金結構幾乎不變,殘留鋁多。Al3Ni2的多少是判斷Raney Ni活性高低的重要指標。
由圖1還可見,Raney Ni中Al3Ni晶相基本消失,說明鋁的脫出比較好。這是因為Al3Ni晶相比Al3Ni2晶相更容易脫鋁。固相浸漬法制備的Raney Ni保留了更多的Al3Ni2晶相,而Al3Ni2的多少是判斷Raney Ni活性高低的重要指標,而且Raney Ni的Al3Ni2晶相衍射強度也強于傳統法制備的樣品。
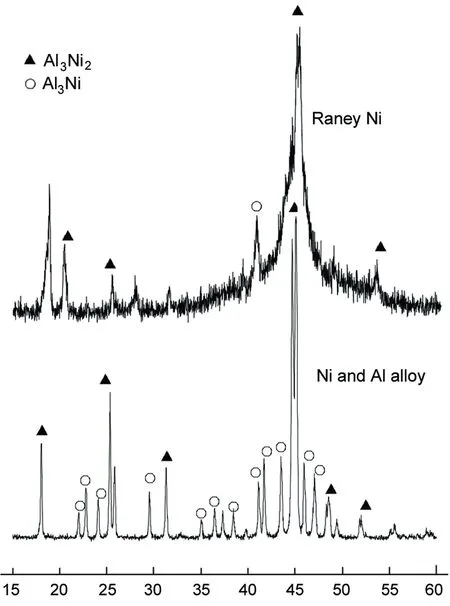
2θ/(°)圖1 鎳鋁合金和Raney Ni的XRD譜圖Figure 1 XRD pattern of nickel aluminum alloy and Raney Ni

Raney Ni比表面積/m2·g-1孔容/cm·g-1孔徑/nm新鮮277.912 70.342 27949.264 20失活2.838 10.005 9588.484 12
(2) Raney Ni的BET分析
新鮮Raney Ni和失活Raney Ni的BET比較見表1。由表1可見,新鮮Raney Ni的比表面積為277.912 7 m2·g-1,孔容為0.342 279 cm·g-1,孔徑為49.264 2 nm,說明其具有較高的表面積、較大的空容和較大的孔徑,使之在加氫反應中表現出良好的催化活性。失活的Raney Ni的比表面積明顯下降,約為新鮮催化劑的1/100倍,空容也下降為約原來1/60倍,孔徑約為原來的1/6。這也說明了Raney Ni失活的原因。Raney Ni為骨架鎳催化劑,呈蓬松的海綿狀結構使其具有的較高的表面積,而失活的Raney Ni的骨架結構塌陷,不再呈現海綿狀結構,比表面積明顯降低,空容和孔徑也隨之降低,因此在加氫反應中活性極低。
(3) Pd/C和Raney Ni的SEM分析

圖2 Raney Ni的SEM照片(×3 190)Figure 2 SEM photograph of Raney Ni


a(×500)b(×5 200)圖3 Pd/C的SEM照片Figure 3 SEM photograph of Pd/C
圖2為Raney Ni的SEM照片。由圖2可見,催化劑呈現多孔的骨架結構,為其提供較高的表面積;顆粒大小分布均勻,大顆粒直徑約為6μm~10μm,小顆粒約為2μm~4μm,說明固相浸漬法的浸漬效果好。
圖3為Pd/C的SEM照片。由圖3(a)可以看出活性炭顆粒為多孔性物質,有較高的表面積,為制備高分散的負載型鈀催化劑提供了有利條件。從圖3(b)可以看出催化劑表面平整光滑,粒徑在1μm~2μm的灰色顆粒為載體活性炭顆粒,粒徑在0.5μm~1.0μm的白色顆粒為活性組分金屬鈀顆粒。
2.2 Raney Ni和Pd/C的催化活性比較
以呋喃加氫制備THF為探針反應,對兩種催化劑的催化活性進行了比較,并篩選最佳的反應條件。
(1) 反應溫度對加氫反應的影響
呋喃加氫反應為放熱反應,反應受溫度的影響明顯,當增加到一定溫度時,大大增加了副反應的發生。呋喃中碳碳雙鍵的活化能為34.28 KJ·mol-1,而碳氧醚鍵的活化能為37.20 KJ·mol-1,兩者差距不大,過高的溫度有會使碳氧醚鍵的斷裂,使反應的選擇性大為降低。
呋喃20 mL,甲醇30 mL,于一定的條件[Raney Ni 10%, 4 MPa, 3 h; Pd/C 3%, 3 MPa, 3 h]下反應,考察反應溫度對加氫反應的影響,結果見圖4和圖5。
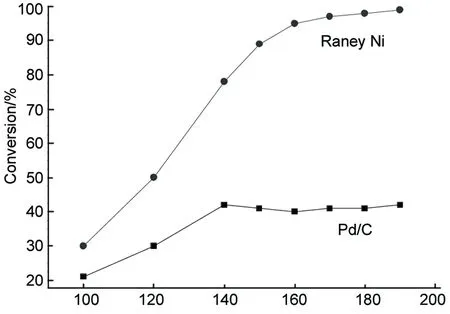
Temperature/℃圖4 反應溫度對轉化率的影響*Figure 4 Effect of reaction temperature on conversion*呋喃20 mL,甲醇30 mL, Raney Ni 10%, 4 MPa, 3 h; Pd/C 3%, 3 MPa, 3 h
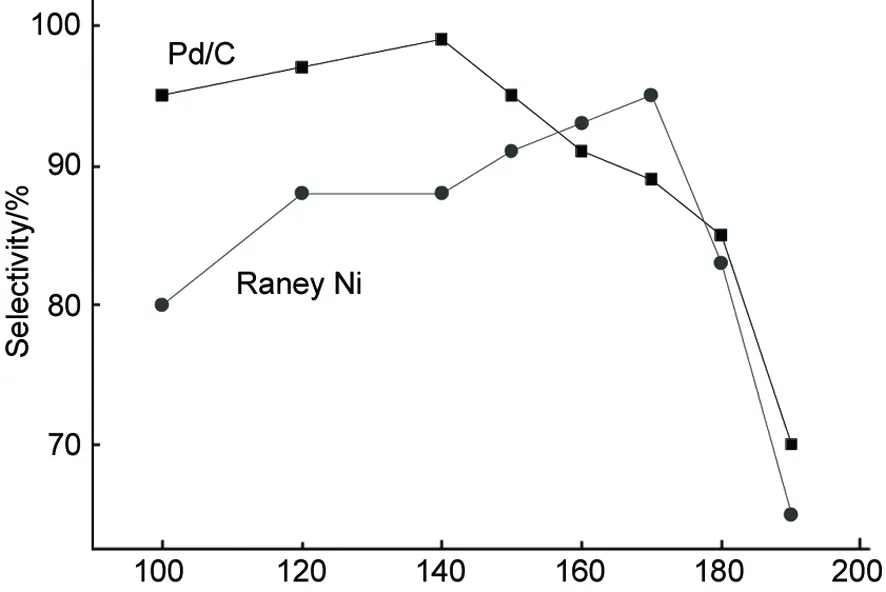
Temperature/℃圖5 反應溫度對選擇性的影響*Figure 5 Effect of reaction temperature on selectivity*反應條件同圖4
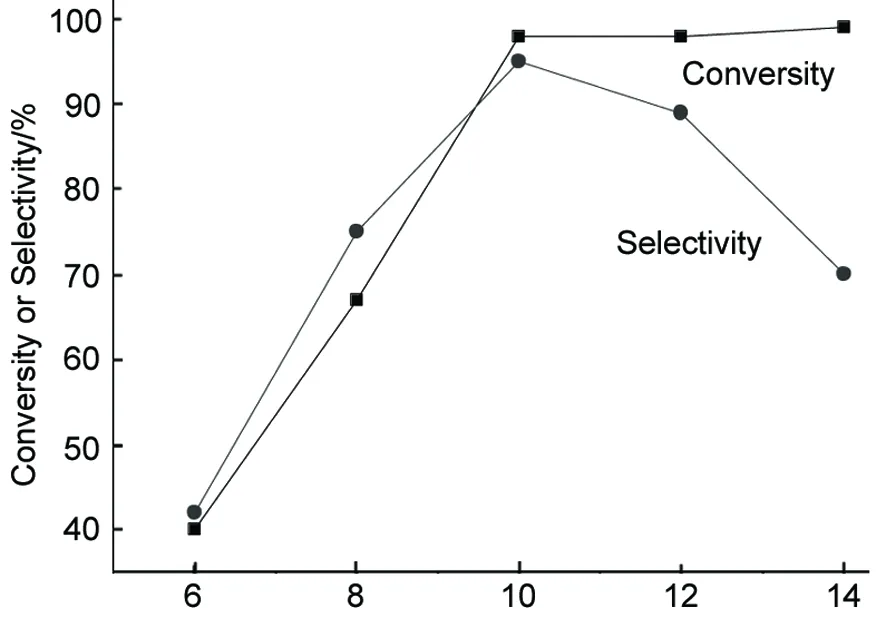
由圖4可見,隨著反應溫度的逐漸升高,兩種催化劑下的轉化率也隨之增加;原因是溫度較低時,加溫度可以增強催化劑的催化活性從而增加反應速率,提高轉化率。當溫度分別達到一定值后轉化率增加不再明顯。Raney Ni催化下的轉化率明顯高于Pd/C,這主要是由于Raney Ni的催化表面活性位多于Pd/C。
由圖5可見,隨著反應溫度的增加,兩種催化劑的選擇性都是先增加,在一定溫度后又明顯降低。溫度較低時,增加溫度有利于產物THF的生成,從而增加THF的選擇性;但是當溫度增加到一定值后,呋喃環上的C-O鍵開始斷裂,生成開環的副產物,從而降低THF的選擇性。但是Pd/C催化下的選擇性高于Raney Ni,原因可能是Pd/C的催化能力比較溫和而Raney Ni比較劇烈,從而導致了Pd/C雖然轉化率較低,但是選擇性較高;而Raney Ni轉化率高,但選擇性較低的原因。
由此可見,在呋喃加氫反應合成THF的實驗中,Pd/C催化下的最佳反應溫度可確定為140 ℃(轉化率40%,選擇性達98%),Raney Ni催化下最佳反應溫度為170 ℃(轉化率95%,選擇性95%)。
(2) 反應壓力對加氫反應的影響
壓力對氣相反應的影響較大,壓力越大,反應向體積減少方向進行,增加壓力對提高轉化率有利。呋喃加氫制備THF的反應是一個體積減小的反應,增加壓力有利于加氫反應。另外,從碰撞理論可知,增加壓力,分子間距變小,增加碰撞機會,也可以加快反應速度。
呋喃20 mL,甲醇30 mL,于一定的條件[Raney Ni 10%, 170 ℃, 3 h; Pd/C 3%, 140 ℃, 3 h]下反應,考察反應壓力對加氫反應的影響,結果見圖6和圖7。由圖6和圖7可見,隨著反應壓力的增加,在兩種催化劑的作用下,轉化率也隨之增加,可以明顯的看出Raney Ni作用下的轉化率高于Pd/C,原因是Raney Ni的表面積高于Pd/C;但是Pd/C的選擇性高于Raney Ni,原因可能是Raney Ni的催化活性過于激烈,在壓力過高時,C-O呋喃環上的醚鍵開始斷裂,生成開環的副產物,從而降低了THF的選擇性。
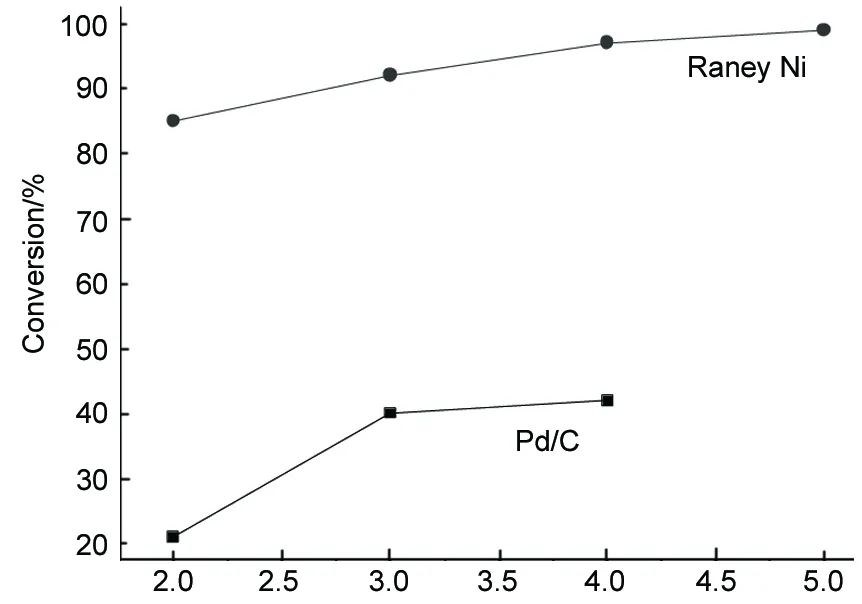
Pressure/MPa圖6 反應壓力對轉化率的影響*Figure 6 Effect of reaction pressure on conversion*呋喃20 mL,甲醇30 mL, Raney Ni 10%, 170 ℃, 3 h; Pd/C 3%, 140 ℃, 3 h
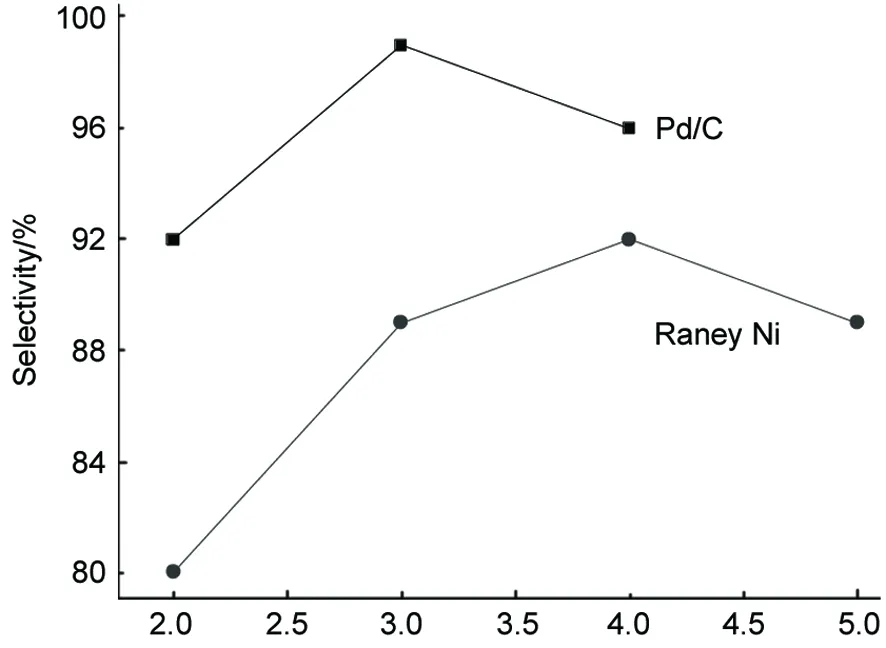
Pressure/MPa圖7 反應壓力對選擇性的影響*Figure 7 Effect of reaction pressureon on selectivity*反應條件同圖6
(3) 催化劑用量對加氫反應的影響
呋喃加氫制備THF為氣-液-固多相反應。根據L-H吸附理論和Hougen-Watson模型可以得出呋喃的消耗速率方程(-rA=krθfuranθH2)[6]。也就是說催化劑的用量越多,所提供的活性吸附位就越多,反應速率就越高。
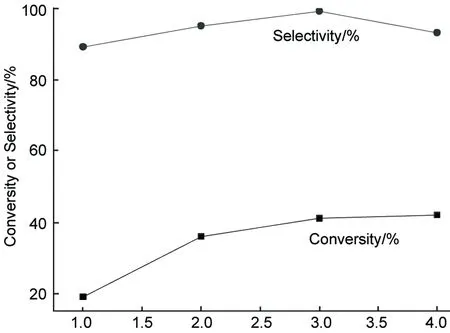
w(Cat.)/%圖8 催化劑用量對轉化率的影響*Figure 8 Effect of catalyst amount on conversion*呋喃20 mL,甲醇30 mL, Raney Ni, 170 ℃, 4 MPa, 3 h; Pd/C, 140 ℃, 3 MPa, 3 h;w(Cat)=m(Cat.)/m(呋喃)×100%
w(Cat.)/%圖9 催化劑用量對選擇性的影響*Figure 9 Effect of catalyst amount on selectivity*反應條件同圖8
呋喃20 mL,甲醇30 mL,于一定的條件[Raney Ni, 170 ℃, 4 MPa, 3 h; Pd/C, 140 ℃, 3 MPa, 3 h]下反應,考察催化劑用量[w(Cat.)=m(Cat.)/m(呋喃)×100%]對加氫反應的影響,結果見圖8和圖9。從圖8和圖9結果來看,隨著兩種催化劑用量的逐漸增加,轉化率也隨之增加;當催化劑用量超過一定值后轉化率增加幅度不再顯著,同時選擇性開始有所下降。
也就是說催化劑用量超過一定范圍時,過多的活性位也會加速副產物的生成,從而降低了選擇性。從過程經濟性原則考慮,過多的催化劑用量會增加成本。因此催化劑的使用有最佳值。從實驗結果看出,w(Pd/C)的最佳用量為3%,w(Raney Ni)最佳用量為10%。
3 結論
制備了Pd/C和Raney Ni催化劑,其在呋喃加氫制備THF的反應中具有不同的反應活性。
(1) 在反應溫度過140 ℃, 壓力3 MPa的條件下,以Pd/C(3%)為催化劑,可以使呋喃的轉化率達到40%, THF的選擇性達到97%;
(2) 在反應溫度170 ℃, 壓力4 MPa的條件下,以Raney Ni(10%)為催化劑,可以使呋喃的轉化率達到95%, THF的選擇性達到93%;
(3) 從呋喃的轉化率來看,Raney Ni的效果明顯優于Pd/C;從THF的選擇性來看,Pd/C的效果略優于Raney Ni。
[1] F J 布羅克爾. 使二氫呋喃類加氫成四氫呋喃的方法[P].CN 1 203 595,1998.
[2] Lejeble P, Gaset A, Kalck P. From biomass to furan through decarbonylation of furfural under mild conditions[J].Biomass,1984,4(4):263-265.
[3] Fischer. Method of producing 1,4-butanediol and tetrahydrofuran from furan[P].US 5 905 159,1999.
[4] Godawa C, Rigal L, Gaset A. Palladium catalyzed hydrogenation of furan:Optimization of production conditions for tetrahydrofuran[J].Resources, Conservation and Recycling,1990,3(4):201-216.
[5] Furimsky E. The mechanism of catalytic hydrodeoxygenation of furan[J].Applied Catalysis,1983,6(2):159-164.
[6] 李紹芬. 反應工程.第二版[M].北京:化學工業出版社,2000.

