Fe2O3的制備及其電化學性能研究*
陳召勇, 張建利, 朱華麗, 朱 偉, 李杉杉
(長沙理工大學 物理與電子科學學院,湖南 長沙 410114)
鋰離子電池負極材料的研究目前主要集中在兩類:一是碳材料,包括石墨與無定形碳。石墨作為負極材料已經成功商品化;由于碳材料結構和形貌的多樣性[1],碳材料成為負極材料的一個熱點。另一類是非碳材料,主要包括合金和金屬氧化物,如Si, Li-Al, SnO2[2], MnO2[3]等。與其它負極材料相比,Fe2O3具有資源豐富、環境友好、理論比容量高[4]等優點,是一種潛在的鋰離子電池負極材料。M M Thackeray等[5,6]研究表明,Fe2O3在電化學充放電過程中發生尖晶石到鹽相結構的晶體轉變,導致其循環性能差,這極大地限制了Fe2O3的廣泛應用。Bui Thi Hang等[7]采用不同形式的碳材料對Fe2O3進行了修飾,但并未明顯提高其循環性能。Sho Kanzaki等[8]通過化學氧化,Yanna NuLi等[9,10]通過控制Fe2O3的顆粒尺寸和形貌在一定程度上改善了其循環性能,但仍然滿足不了實際使用要求。雖然科研人員對Fe2O3進行了廣泛研究,但較少文獻直接研究Fe2O3在充放電過程中的結構變化。
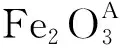
1 實驗部分
1.1 儀器與試劑
Netzsch STA409PC型綜合熱分析儀;日本理學Rigaku D/MAX-2000/PC型X-射線衍射儀(XRD); Philips quanta 200型掃描電鏡(SEM); Land電池測試儀(電壓范圍2.5 V~3.9 V, 0.1 C倍率); CHI 660B型電化學工作站。
所用試劑均為分析純。
1.2 Fe2O3的制備
(1) A法
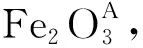
(2) B法

1.3 負極材料的制備
以Fe2O3為負極活性物質,乙炔黑為導電劑,PVDF乳液為粘結劑,其質量比為8 ∶1 ∶1,以銅箔為集電極進行涂膜,打片烘干后作為負極片,然后以金屬鋰片為對電極,美國Celgard2400為隔膜, 1 mol·L-1LiPF6/[碳酸乙烯酯+碳酸二甲酯(體積比1 ∶1)]為電解液,在真空手套箱內裝配出模擬電池。
2 結果與討論
2.1 反應機理
圖1為FeC2O4·2H2O(a,對應A法)和添加KCl的FeC2O4·2H2O(b,對應B法)在空氣中的TG-DSC曲線。

圖 1 樣品的TG-DSC曲線*Figure 1 TG-DSC curves of samples*空氣, 升溫速率10 ℃·min-1; a: FeC2O4·2H2O(對應A法); b: 添加KCl的FeC2O4·2H2O(對應B法)
由圖1可見,a和b在200 ℃附近都存在一定失重和明顯的吸熱峰,失重主要是由于草酸亞鐵的吸附水和結晶水引起的; 在200 ℃~300 ℃呈現較強的放熱峰,并伴隨明顯的失重,這說明此階段為草酸亞鐵分解為Fe2O3的主要階段。溫度高于400 ℃以后兩者重量基本保持不變,卻存在一些較小的吸熱峰存在,這可能主要是Fe2O3晶胞參數調整或晶型轉變引起的。由此可以得出草酸亞鐵分解過程的反應機理如式(1)所示。
(1)
從圖1還可以看出,A法(a)在200 ℃之前失重20.0%, 200 ℃~300 ℃失重36.3%,與式(1)的理論失重20%和34.52%基本吻合。而B法(b)在200 ℃以前和200 ℃~300 ℃分別失重6.5%和11.5%,也與式(1)理論失重吻合。這說明以草酸亞鐵為原料采用兩種方法制備Fe2O3的反應機理基本一致。
2.2 Fe2O3的結構與形貌
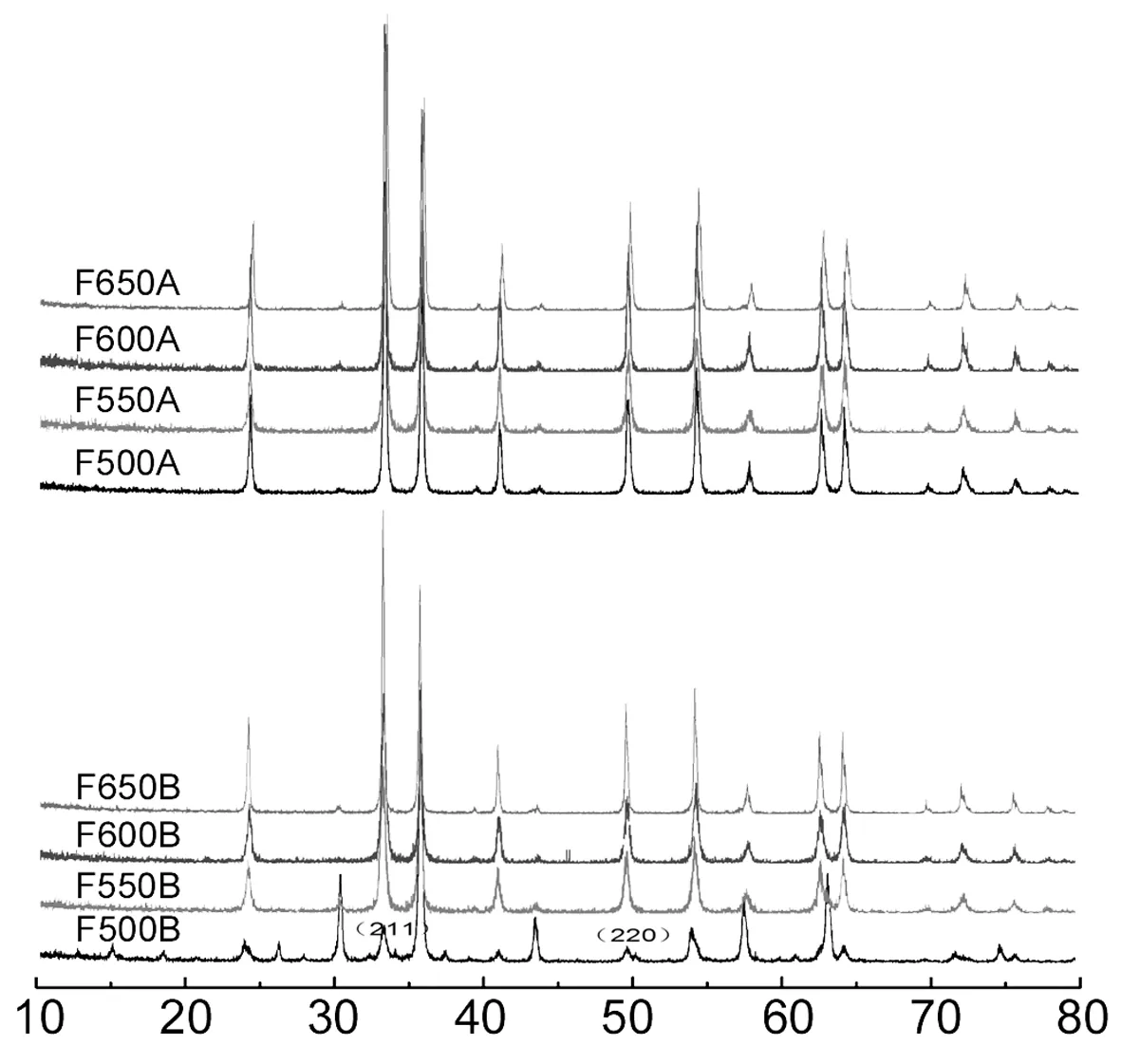
2θ/(°)圖和的XRD譜圖Figure 2 XRD spectra of and
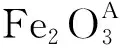
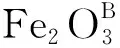
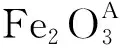
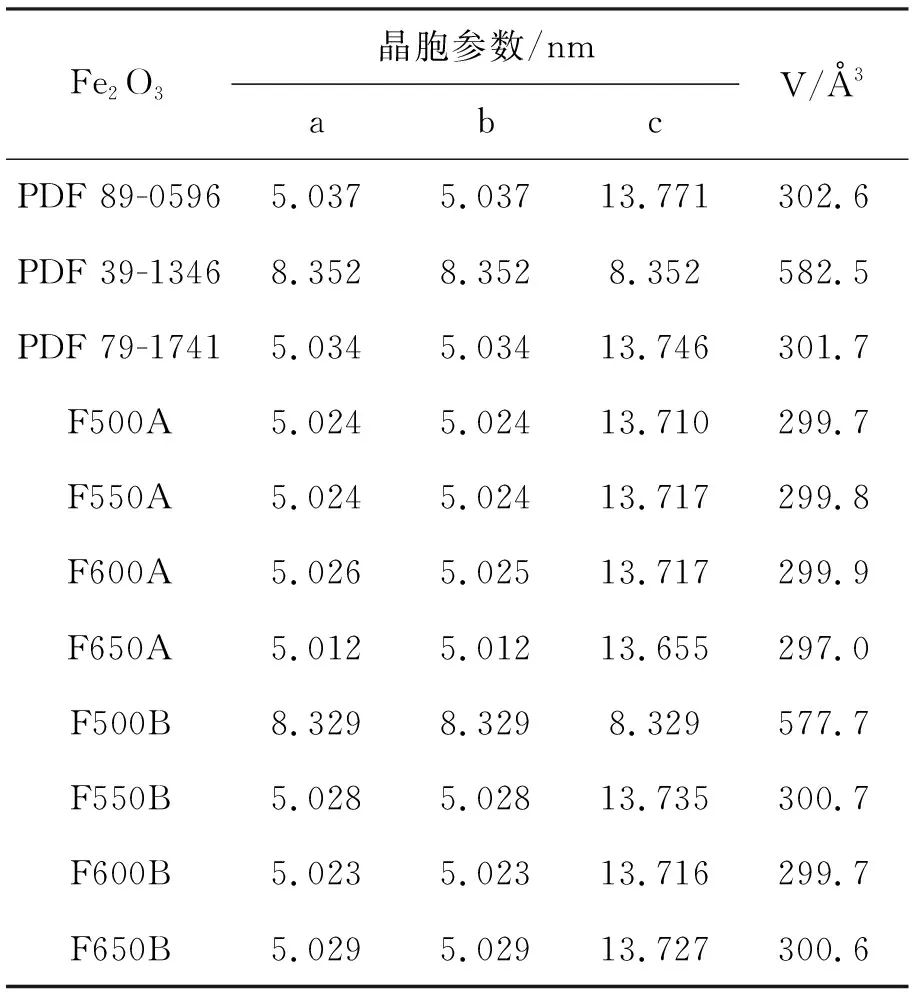
表 1 Fe2O3的晶胞參數修正結果Table 1 Amendment result of Fe2O3 cell parameters
圖3為F550A和 F550B的SEM照片。從圖3可以發現,F550A形貌比較規則,呈類球形,由片狀結構團聚而成;F550B中也能發現少量片狀結構存在,但大部分由無規則納米顆粒團聚而成。
2.3 Fe2O3的電化學性能
(1) 放電容量
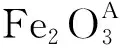

圖 3 F550A和 F550B的SEM照片Figure 3 SEM image of F550A and F550B
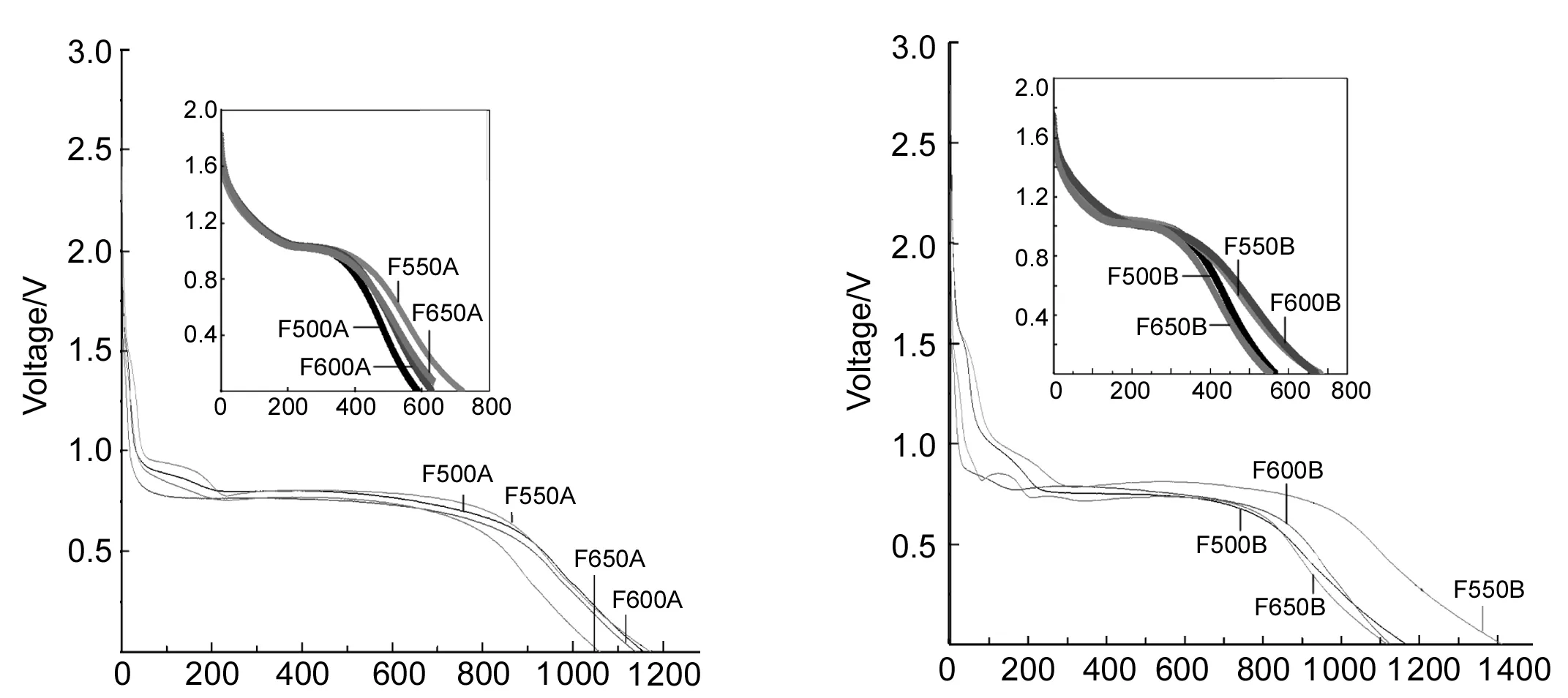
Capacity/mAh·g-1 Capacity/mAh·g-1圖 4 Fe2O3的首次和第二次(插圖)放電容量-電壓曲線Figure 4 The initial and the second(insert) discharge capacity against voltage curves of Fe2O3
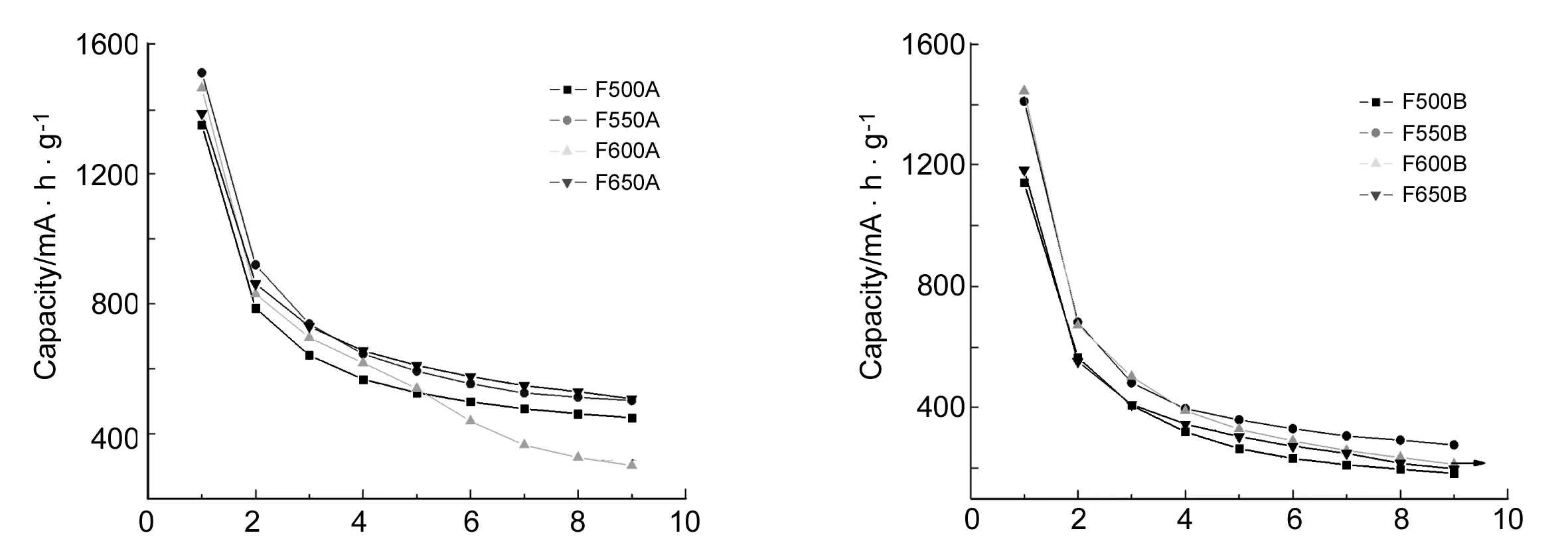
Cycle number Cycle number圖 5 Fe2O3的首次放電容量-循環次數曲線Figure 5 The initial discharge capacity against cycle number curves of Fe2O3
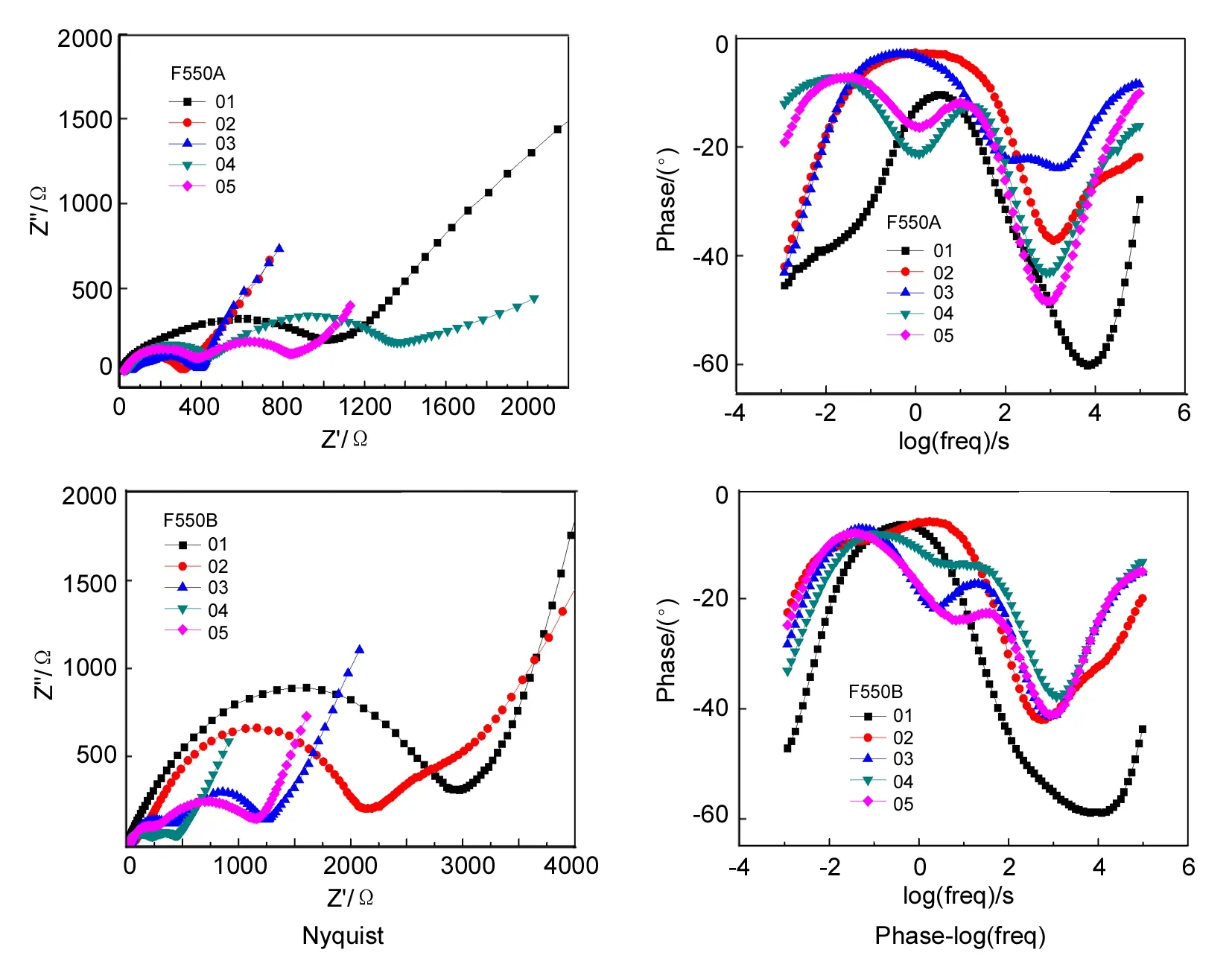
Ⅰ Ⅱ圖 6 Fe2O3的EIS譜圖*Figure 6 EIS spectra of Fe2O3*掃描頻率1 mHZ ~10 kHZ,正弦波振幅5 mV;在充放電過程中的平臺位置選取5個點進行EIS表征,其中01表示未嵌鋰,02表示第一次嵌鋰過程中(0.60 V), 03表示第一次脫鋰過程中(1.4 V),04表示第二次嵌鋰過程(1.0 V), 05表示第二次脫鋰完畢(0 V);Ⅰ中RΩ為溶液電阻,Cdl為材料固液界面雙電層電容,Rct為異相電荷轉移電阻,Zω為Warburg電阻; Ⅱ中RΩ為溶液電阻,Cdl為材料固液界面雙電層電容,Rct為異相電荷轉移電阻,Zω為Warburg電阻,Rj, Cj分別為SEI處電阻和電容
(2) 循環壽命
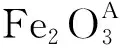
(3) EIS譜圖
F550A和F550B在不同脫嵌鋰階段的EIS譜圖[Nyquist和phase-log(freq)]見圖6。phase-log(freq)圖反應材料表面的弛豫效應,一般認為圖譜中的“峰”和“谷”的個數與材料的時間常數相對應。而每個時間常數在Nyquist圖中也有相應圖形體現。在phase-log(freq)圖中,材料表面的時間常數由原來的兩個增加到三個,與之相對應的Nyquist圖也從一個半圓與一條傾斜直線的組合增加到兩個半圓與一條傾斜直線組合。對于03階段中高頻區兩個時間常數而未出現對應兩個半圓,可能是由于時間常數接近而導致半圓重疊的結果。
Nyquist圖由半圓和傾斜直線可以由等效電路進行近似模擬。未經過鋰離子脫嵌的材料可以用Randles等效電路[12~14](圖6-Ⅰ)進行模擬。高頻區此時體現為半圓,而低頻區表現為一條直線為45°的傾斜直線。而經過鋰離子脫嵌過程之后圖形呈現兩個半圓和一條直線,采用Voigt-FMG[12~14]電路(圖6-Ⅱ)進行模擬比較適宜。
結合phase-log(freq)圖,Nyquist圖和等效電路我們發現,隨著鋰離子脫嵌的進行,Fe2O3時間常數和Nyquist圖半圓個數增加,加上兩種電路的模擬解釋為高頻區的半圓與鋰離子在SEI膜擴散相關,中高頻區半圓與電荷在膜與活性物質的轉移相關,這表明伴隨著首次鋰離子的脫嵌過程,Fe2O3表面產生了化學變化,即SEI膜逐漸生成。對于低頻區直線的解釋一般認為與鋰離子在材料中的擴散緊密聯系。而直線已經偏離45°的現象,可能是由于鋰離子的脫嵌過程產生容抗效應[15]。也有研究表明傾角大的直線表現出較小阻抗。
(4) 循環伏安
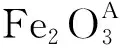
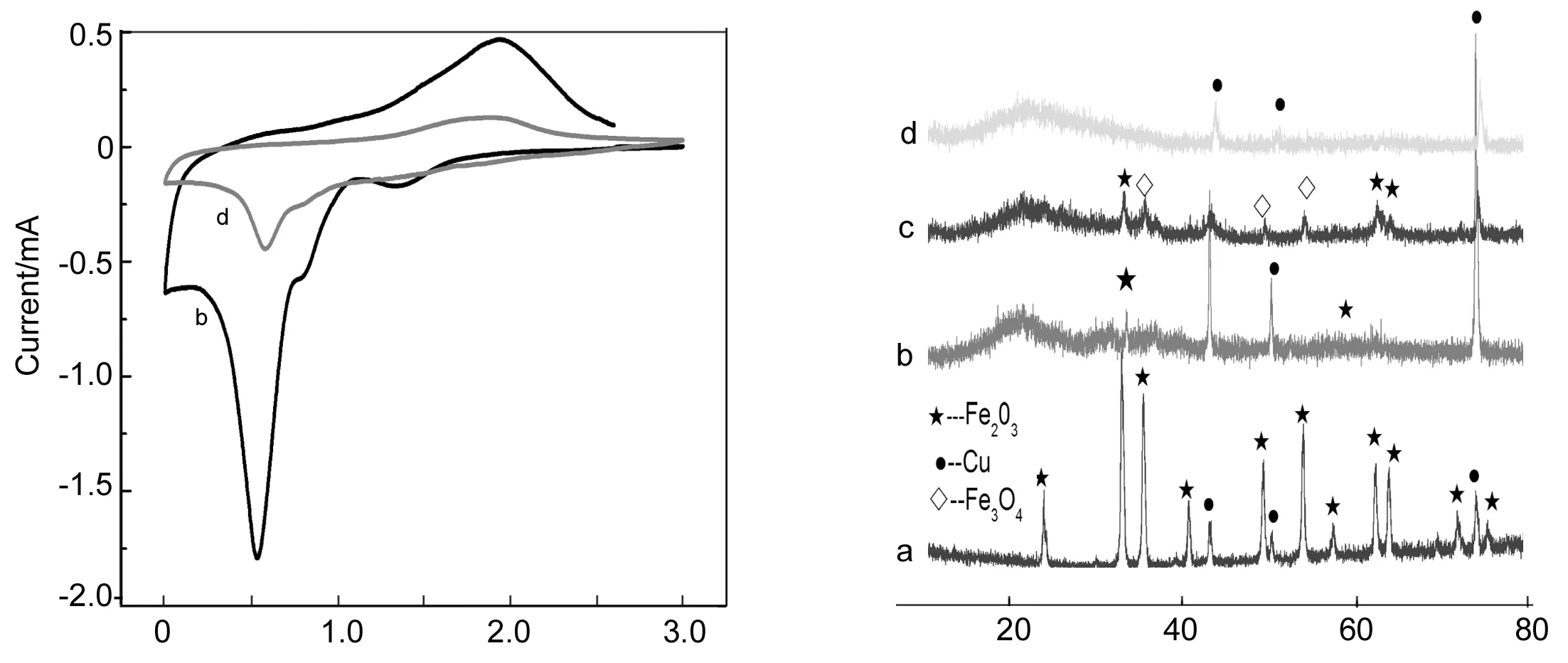
Potential/V 2θ/(°)圖 7 F550A的循環伏安(CV)曲線及其XRD譜圖*Figure 7 The cyclic voltammeter curves and XRD spectra of F550A*a為未經過電化學處理的F550A電極片; b為僅經過CV測試的F550A電極片; c為經過一次放電過程的F550A電極片; d為經過一次充放電和CV測試的F550A電極片

2Fe3O4+ Li2O(Fe2O3)5
(2)
3 結論
本文采用高溫分解法和鹽熔法制備了鋰離子電池負極材料Fe2O3,通過對其進行XRD分析以及充放電測試和CV, EIS研究,可以得到以下結論:(1) 通過高溫熱分解法和熔鹽法可以制備三方晶相的Fe2O3,形貌呈類球形,由片狀結構堆積而成; (2) 熔鹽法制備的Fe2O3具有更高的首次嵌鋰容量; (3) Fe2O3在鋰離子首次脫嵌過程中發生相變,逐步轉化為Fe3O4,并形成SEI膜。
[1] Michio Inagaki. Carbon materials Structure,texture and intercalation[J].Solid State Ionics,1996,86-88:833-839.
[2] L Yuan, Z P Guo, K Konstantinov,etal. Nano-structured spherical porous SnO2anodes for lithium-ion batteries[J].Journal of Power Sources,2006,159:345-348.
[3] M S Park, W Y Yoon. Characteristics of Li/MnO2battery using a lithium powder anode at high-rate discharge[J].Journal of Power Sources,2003,114:237-243.
[4] Michel Rosso, Claire Brissot, Anna Teyssot,etal. Dendrite short-circuit and fuse effect on Li/polymer/Li cells[J].Electrochimica Acta,2006,51:5334-5340.
[5] Thackeray M M, Coetzer a preliminary investigation of the electrochemical performance of e-Fe2O3and Fe3O4cathodes in high temperature cells[J].Mat Res Bull,1981,16:591-597.
[6] M M Thackeray, W I F David, J B Goodenough. High-temperature lithiation ofα-Fe2O3:A mechanistic study[J].Solid State Chemistry,1984,55:80-286.
[7] Bui Thi Hang, Takayuki Doi, Shigeto Okada,etal. Effect of carbonaceous materials on electrochemical properties of nano-sized Fe2O3-loaded carbon as a lithium battery negative electrode[J].Journal of Power Sources,2007,174:493-500.
[8] Sho Kanzaki, Atsuo Yamada, Ryoji Kanno. Effect of chemical oxidation for nano-sizeγ-Fe2O3as lithium battery cathode[J].Journal of Power Sources,2007,165:403-407.
[9] Yanna NuLi, Rong Zenga, Peng Zhanga,etal. Controlled synthesis ofα-Fe2O3nanostructures and their size-dependent electrochemical properties for lithium-ion batteries[J].Journal of Power Sources,2008,184:456-461.
[10] P C Wang, H P Ding, Tursun Bark,etal. Nanosizedα-Fe2O3and Li-Fe composite oxide electrodes for lithium-ion batteries[J].Electrochimica Acta,2007,52:6650-6655.
[11] 唐萬軍,陳棟華. 二水草酸亞鐵熱分解反應動力學[J].物理化學學報,2007,23(4):605-608.
[12] Bernard A BOUKAM. A package for impedance/admittance data analysis[J].Solid State lonics,1986,18-19:136-140.
[13] 王連亮,孫志中,伊文濤,等. 電化學阻抗譜在鋰離子電池正極材料LiFePO4研究中的應用[J].鹽湖研究,2008,16(4):21-26.
[14] Doron Aurbach, Mikhail D. Levi,etal. Common electroanalytical behavior of Li intercalation processes into graphite and transition metal oxides[J].J Electrochem Soc,1998,145(9):3024-3034.
[15] Doron Aurbach, Boris Markovsky,etal. Review on electrode-electrolyte solution interactions,related to cathode materials for Li-ion batteries[J].Journal of Power Sources,2007,165:491-499.

