豬流行性腹瀉病毒基因及其疫苗的研究
王 鳳,湯德元,李春燕,王 彬,張曉杰,甘振磊,劉志杰
(貴州大學動物科學學院,貴州 貴陽 550025)
豬流行性腹瀉(PED)是由豬流行性腹瀉病毒(porcine epidemic diarrhea virus,PEDV)引起豬的一種急性腸道傳染病。豬流行性腹瀉病毒屬于冠狀病毒科(coronaviridae)冠狀病毒屬(coronavirus)的成員。主要引起豬流行性腹瀉。各種年齡、各個品種豬均可感染發病,哺乳仔豬、架子豬、育肥豬的發病率可達100%,成年母豬發病率為15%~90%。其發病特點是:日齡小,癥狀重,日齡大,癥狀輕。1 周齡哺乳仔豬常在腹瀉3~4 d 后脫水死亡,病死率達50%。斷奶豬、育肥豬癥狀較輕,腹瀉可持續4~7 d,成年豬僅發生嘔吐和厭食。PEDV 與豬傳染性胃腸炎病毒(TGEV)同屬于尼多病毒目冠狀病毒科冠狀病毒屬,2 種病毒感染后所引起發病豬的臨床癥狀、流行特點和病理變化都極其相似,均給養豬業帶來嚴重危害。當前PED 發生率居高不下,發病情況也越來越復雜,出現混合感染的現象時有發生,目前倍受廣大研究者的重視。本文主要針對PEDV 的基因組結構、功能和PED 疫苗的研究進展進行了綜述,為豬流行性腹瀉基因的深入研究及對PED的預防提供參考。

1 PEDV的基因結構及功能
PEDV 基因組是單股正鏈具有感染性的RNA,與其他冠狀病毒相似,其基因組5′端有一個帽子結 構(cap),3 ′ 端 有 一 個Poly(A)尾,基因組全長為28 033 nt(PEDV CV777 毒株)。基因組5′端非翻譯區(5′UTR)位于復制酶多聚蛋白基因上游,長296 nt;5′UTR 內含有長為65~98 nt 的前導序列(L)和一個AUG 為起始密碼子并擁有Kozak 序列(GUUCaugC)和編碼12 個氨基酸的開放閱讀框架(ORF)。目前,除人冠狀病毒HCV229E 外,已知的其他冠狀病毒成員都有Kozak 序列,但序列有所差異。基因組3′端非翻譯區(3′UTR)長度為334 nt,末端連有Poly(A)序列,3′UTR 內含有由8 個堿基(GGAAGAGC)組成的保守序列,起始于poly(A)上游的73 nt處,所有冠狀病毒成員都包含這個序列,只是在基 因組中位置不同。剩余基因組序列包括6 個ORFs(見圖1),從5′→3′端依次為編碼復制酶多聚蛋白lab(pplab)、纖突蛋白(S)、ORF3 蛋白、小膜蛋白(E)、膜糖蛋白(M)和核衣殼蛋白(N)的基因。復制酶多聚蛋白基因占全基因組2/3,長20 346 nt,包括ORFIa(12 354 nt)和ORFIb(8 037 nt)2 個開放閱讀框架,二者之間有46 nt 的重疊序列,重疊處有滑動序列(UUUAAAC)和假結節結構,它們能使核糖體進行移碼閱讀(frameshifting)從而保證基因l 的正確翻譯。S 基因、E 基因、M 基因和N 基因分別編碼病毒的結構蛋白,長度分別為4 152 nt、231 nt、681 nt、1 326 nt。ORF3 基因長675 nt,編碼非結構蛋白,在每兩個相鄰基因之間有基因間隔序列(interval sequence,IS),它與基因組和亞基因組mRNA 的L 序列3′端有7~18 nt 相同,在病毒基因組復制和翻譯過程中發揮重要作用。
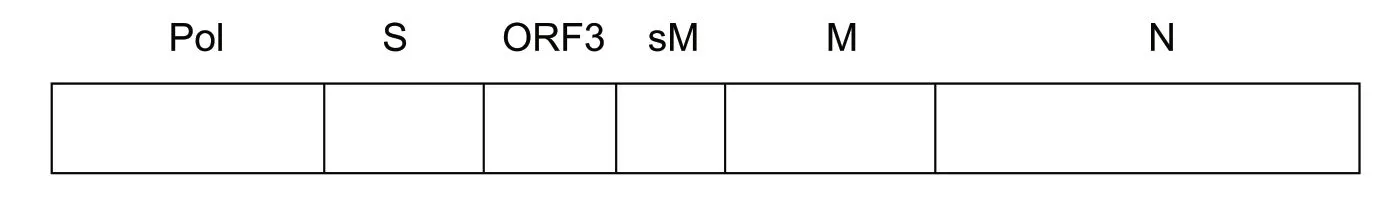
圖1 PEDV 基因組結構
1.1 Pol 基因
Pol 基因編碼依賴于RNA 的非結構蛋白,即復制酶多聚蛋白1ab(pp1ab),為RNA 多聚酶。復制酶多聚蛋白分子質量約為753 ku,有13 個預測蛋白酶切割位點。PEDV 基因組中S 基因上游除編碼多聚酶的基因外并無其它基因。這同缺乏PEDV 相關的血細胞凝集酶活性結果一致。因為,如果冠狀病毒基因組存在這樣一種基因,它必定總是存在于S 和多聚酶基因之間。多聚酶基因由2 個大的重疊的開放性閱讀框架ORF1a(12 354 nt)和ORF1b(8 037 nt) 組 成, 其 中ORF1a 和ORF1b 共有46 個核苷酸 的重疊,重疊區有一特異性7 核苷酸序列(UUUAAAC)和一假結節結構。多聚酶基因翻譯成2 個多蛋白前體,即pp1a和pp1ab,較大的蛋白pp1ab 則是通過核糖體移碼機制合成,并需要特異性7核苷酸序列和假結節結構。ORFla 主要編碼蛋白水解酶,包括分別切割復制酶多聚蛋白N 端和C 端的類木瓜蛋白酶(PL-PRO)和類脊髓灰質炎病毒3C 蛋白酶(3CL-PRO)。PL-PRO 的切割活性對鋅具有強依賴性。3CL-PRO 識別底物的核心序列是(ILMF)-Q-I-(SAGC)。另外,ORF1a 編碼蛋白還含有3 個轉膜域(TM)。ORFlb 主要編碼RNA 依賴性RNA 聚合酶(RdRp),同時有3 個蛋白結構域分別是鋅指蛋白域(Z)也稱金屬結合域、螺旋酶域(He1)和保守序列域(C)。
復制酶多聚蛋白經共轉譯處理后產生與病毒基因組復制相關的一系列蛋白質,主要功能包括負鏈RNA、前導RNA、sgmRNA( 亞基因組RNA)和子代病RNA 的轉錄作用以及對多聚蛋白切割產生具有功能產物的蛋白酶切割作用。因此,在病毒感染早期發揮重要作用[2]。
1.2 S(Spike)基因
PEDV S 基因的啟動密碼子通常并不是用于啟動蛋白質的合成,而是翻譯分子量為180~220 ku 的1 383 個氨基酸的多肽,即S 蛋白,該多肽含有29個潛在的N-連接的糖基化位點,是PEDV 的1 個重要的結構蛋白,是位于病毒粒子表面的纖突糖蛋白,并有與其他冠狀病毒纖突蛋白相似的結構特點。序列同一性比較表明,PEDVS 基因與HCV229E(人冠狀病毒)的序列分別有60%(S2 區)和37.0%(S1 區)的同源性;與FIPV(貓傳染性腹膜炎病毒)、TGEV、和CCV( 犬冠狀病毒)的S 序列分別有59.%~60.0%(S1 區)和35.5%~35.9%(S2 區)的同源性。PEDV 和HCV229E 旁側序列在迄今所測定的所有S 蛋白基因中都顯示了保守性。
S 蛋白在免疫反應中起重要作用,在病毒感染宿主機體后介導中和抗體產生的過程中發揮重要生物學作用,如識別靶細胞、促進病毒和細胞膜融合的作用[3],故S 蛋白被認為是發展有效抵抗冠狀病毒的主要靶抗原。
此外,S 蛋白有27~29 個潛在的糖基化位點,在低滲非離子溶劑中溶解度最大。當pH 值為4 時,S 蛋白溶解度最大,而N 蛋白則要求pH 為9。制備的S 蛋白和N 蛋白可用作ELISA 抗原,分別命名為S-ELISA 和N-ELISA。S-ELISA 比N-ELISA 更 為 有 效。感染PEDV 豬血清中的抗S 蛋白抗體比抗N 蛋白抗體更為持久,即可在更長的時間中檢測到抗S 蛋白的抗體。
1.3 ORF3 基因
ORF3 基 因 能 編 碼ORF3 蛋 白。ORF3 蛋白為223 個氨基酸的多肽,分子質量為25.3 ku,是一種非結構蛋白,其位置在116~784 個核苷酸之間。ORF3 基因編碼的產物存在一個含6 個His 的尾。ORF3 基因至少存在3 個可變區,有短的核苷酸缺失(2~7 nt)。對PEDV 的2 個不同分離株CV777 和Br1/87 的測序后發現,這些核苷酸缺失2 個分離株都有。ORF3 序列中還發現了兩個功能基序(Motif):精氨酸酶信號肽和ATP/GTP 結合位點。由于ORF3 基因中核苷酸缺失的存在,所以不能通過細胞培養復制ORF3 基因產物。對PEDV CV777 和Br1/87 兩個不同分離株的研究發現,雖然有時核苷酸缺失是在相同的位置,但缺失并不總是相同。可以認為,CV777 和Br1/87 起源于相同的病毒群,但以后各自進化了。
Park 等(2007)對PEDV DRl3 強、弱毒的ORF3 序列進行了分析,發現致弱的DRl3 在ORF3 有17 個氨基酸的缺失,為強、弱毒鑒別診斷方法的建立提供了依據。說明ORF3 基因與病毒毒力有關[4]。
1.4 sM(small membrane)基因
sM 基 因 編 碼E 蛋 白,E 蛋 白 是PEDV 最小的結構蛋白,由76 個氨基酸組成,預測分子量為8.8 ku,其散在分布于病毒囊膜上,在病毒的自我組裝和出芽過程中起至關重要的作用。PEDV 的sM 基因序列與HCV229E 和TGEV 的相比,分別有54%和29%的同源性。PEDV 2 個病毒分離株 CV777和Brl/87 的sM 基 因 嚴 格 保 守。Northern 雜交分析PEDV 亞基因組RNA 時發現,編碼sM 多肽的mRNA同預測的RNA5(成熟的病毒粒子中的第5 個RNA 組分)電泳遷移率相同。目前,研究者將PEDV 的sM 基因和M 基因導入甲病毒載體(pS~FV),在BHK-21 細胞中得到了成功的表達,為進一步探討E 蛋白和M 蛋白在抗病毒中的作用奠定了基礎。
1.5 M(Membrane)基因
M 基 因 編 碼M 蛋 白,M 蛋 白 是一種穿膜蛋白,由226 個氨基酸組成,分子量介于27~32 ku 之間。對M基因的序列比較分析表明,PEDV 與HCV229E 和TGEV 的同源性分別為57%和53%。CV777 和Br1/87 核苷酸序列比較分析表明,在M 基因上僅有2 個核苷酸的差異。M 基因非常保守,PCR 檢測時PEDV 的引物一般都是針對M 基因而設計的。
M 蛋白在病毒粒子的組裝和出芽過程中具有重要作用,同時也是病毒刺激機體產生免疫保護的重要結構蛋白。另外,M 蛋白能介導機體產生干擾素,所以M 蛋白可以作為PEDV 基因工程疫苗的候選基因[5]。因此獲得M 基因在體外有效的蛋白表達產物,無論是對PEDV 感染增殖的基礎性研究,還是利用M 蛋白進行病原鑒定或疾病免疫預防,均具有重要的理論和實踐意義。現已用兔抗肽血清鑒定PEDV M 蛋白,并用桿狀病毒進行了表達。
活性的M 蛋白為N-糖基化,分子量約為27 ku,而重組體桿狀病毒合成的M 蛋白(相對分子質量)Mr 為23ku,且與未糖基化的M 蛋白有著相同的電泳遷移率。
1.6 N(nucleocapsid)基因
PEDV N 基 因 編 碼N 蛋 白。N 蛋白是PEDV 的主要結構蛋白之一,主要作用是形成核衣殼,相對分子量為大小為55~58 ku,由441 個氨基酸組成。對PEDV CV777 和Brl/87 2 個分離株N 基因序列分析發現僅有2 個堿基的差異,用套式PCR 擴增4 個分離株PEDV N 基因540 nt 的片段后發現,其核苷酸序列基本相同。N 基因1 323個核苷酸的序列表明,PEDV 與其他冠狀病毒N 基因序列有相當部分相同。但PEDV N 基因明顯比HCV229E 和TGEV 大,其中有一段大約135 nt 的潛在插入存在,其可能位于N 基因中央。PEDV 與TGEV、HCV229E 的N 蛋 白的明顯不同之處就是在PEDV N 蛋白中央部分有一段接近40 個氨基酸的特別殘基,其中富含天門冬酰胺,絲氨酸和精氨酸。N 基因在氨基酸和核苷酸水平上與HCV229E 有很大的同源性,其序列與MHV、IBV、HCV 的同源性為12%~19%,與FIPV、CCV、PRCV、TGEV、HCV229E 的同源性較高,為32%~37%。N 蛋白氨基酸序列比較,PEDV 和HCV229E 有63 個 相 同 的 殘基,而和TGEV 有49 個相同的殘基。PEDV、TGEV、HCV229E 的N 端 序列的一致性比C 端高。
N 基因處于PEDV 基因組3′端,N 基因的3′端和poly(A)尾之間有一個11 個核苷酸的保守序列,這一序列是病毒復制過程中RNA 負鏈合成的識別位點。N 基因的5′端也存在一個類似于內部保守基因為7 nt 的序列。N基因還有一個336 個核苷酸的ORF,編碼富含Leu 的蛋白。適應細胞生長的PEDV N 基因含有3 個內部開放閱讀 框(internal open reading frames,I ORF),分別命名為I-1(113 個密碼子),I-2(63 個密碼子)和I-3(72個密碼子),3 個I ORF 均絕對保守。而牛的冠狀病毒(BCV)I ORF (208 個密碼子)表達一個與膜有關的23 Ku的蛋白,但其生物學作用仍有待測定。MHV(鼠肝炎病毒)的I ORF (207 個密碼子)編碼一結構蛋白,該蛋白與病毒復制無關。PEDV 所有3 個I ORF 的共同編碼作用與BCV 或MHV 大約相當。野生型PEDV CV777 分離株3′端整個N 基因和非編譯區的1 800 個核苷酸序列分析表明,野生型PEDV 同適應細胞生長的PEDV 相似,N 基因下游未發現其他基因。病毒的細胞培養不會導致該基因組區任何核苷酸的變化,然而,適應細胞生長的PEDV 對新生仔豬的致病力是明顯減弱了,這證明了該段基因及其基因產物對PED 病毒致弱無關。
不同冠狀病毒N 蛋白比較顯示:在PEDV N 蛋白中央有相當長的親水區域。另外N 蛋白除和基因組RNA 纏繞形成核糖核蛋白(Ribonucleoprotein,RNP)復合體外,還參與病毒的復制和轉錄[6]。N 蛋白等電點高,缺少糖基化和RNA 結合位點,PEDV 完整的N 蛋白等電點為10.5,但C 端50 個殘基的等電點很低,僅為3.4,這是由于其C端殘基通常是帶負電荷或呈中性。病毒感染細胞中N 蛋白較豐富,N 蛋白能與病毒多聚酶作用,或許還有可能同細胞因子作用,從而改變宿主細胞的轉錄。N 蛋白有6~7 個潛在的磷酸化位點,在pH 9.0 低滲非離子溶劑中溶解度最大。N 蛋白有3 個相對保守的結構域,位于中間的是一個能與病毒RNA 前導列結合的RNA 結合域。
此外,在對冠狀病毒一些成員N 蛋白亞細胞定位的研究中表明N 蛋白在細胞核(或核仁)中定位的特征,進而也闡明了N 蛋白的一些功能,N 蛋白作為一個調節蛋白起作用,能夠干擾宿主細胞周期,參與細胞通信,N 蛋白還可以抑制干擾素的產生,誘導細胞調亡。而對PEDV N 蛋白亞細胞定位特征的研究還沒有報道。N 蛋白在PEDV 的結構蛋白中所占比例最大,在感染的細胞中能得到大量表達。豬在感染PEDV 的早期,體內就能產生抗N 蛋白的高水平抗體。又鑒于其冠狀病毒N 蛋白保守性強,所以利用N 蛋白來建立PEDV 分子生物學診斷技術具有很好的應用前景[7]。
2 PED疫苗的研究
對PED 的預防和控制應以接種疫苗為主,國內外的研究者在PED 疫苗的研究方面已經做了大量的工作,但到目前為止還沒有研制出特別有效的疫苗可以控制PED 疾病的發生。下面僅就豬流行性腹瀉各類疫苗的研究應用現狀及前景進行概述。
2.1 滅活疫苗
滅活疫苗包括組織滅活疫苗和細胞滅活疫苗。由于組織滅活苗效果很好,目前應用最為廣泛。哈爾濱獸醫研究所、上海農科院牧醫所和江蘇農科院牧醫所等單位試生產。王明等[8]用PED滬株研制氫氧化鋁滅活苗接種后海穴,以0.1mL/頭主動免疫3 日齡仔豬,保護率為77.28%;以0.5mL/頭主動免疫接種3~22 日齡豬,保護率為85%;以5mL/ 頭被動接種妊娠母豬,其所產3 日齡仔豬的保護率為97.06%。接種疫苗后14d 開始產生免疫力,免疫期可達6 個月。
細胞滅活苗制備方便,應用也越來越廣泛。馬思奇等[9](1994)研制的氫氧化鋁細胞滅活疫苗的主動免疫試驗和被動免疫試驗的保護率分別為88.89%及90.7%,并研制了豬傳染性胃腸炎與豬流行性腹瀉病毒二聯氫氧化鋁細胞滅活疫苗,滅活前毒價均為107.0~107.5TCID50/0.3 mL, 主動免疫保護率:TGE 為100%、PED為92%,被動免疫保護率:TGE 為87.9%、PED 為 82.4%,免疫期均為6個月。疫苗保存期1 年,田間試驗保護率92%~96.35%。
2.2 細胞弱毒苗
由于滅活苗產生完全免疫力需要2周時間,且劑量偏大,不利于緊急預防與降低疫苗費用,所以又研制了細胞弱毒苗。國外Park 等[10]將PEDV經 Vero 細胞致弱后的毒株DR13,通過口服和肌肉注射兩種途徑免疫晚期妊娠母豬,觀察所產仔豬的發病率。結果口服免疫組的發病率(13%)遠低于肌肉注射免疫組(60%),且口服免疫組仔豬抗PEDV 的SIgA 含量明顯高于肌肉注射免疫組。研究表明,可應用PEDV 細胞弱毒苗經口免疫晚期妊娠母豬,從而有效預防PEDV 感染。Kweon 等[11]用分離到的野毒株(命名為KPEDV-9),使之適應Vero 細胞并連續傳代至93 代,進行主動免疫試驗、被動免疫試驗以及安全性試驗,結果都證實可作為弱毒苗使用。適應Vero 細胞并連續傳代至93 代的KPEDV-9,接種妊娠母豬,ELISA 檢測結果表明,母豬免疫應答水平大幅度提高,且新生仔豬可抵抗PEDV 野毒感染。國內佟有恩等[12]用CV777 株強毒株適應Vero細胞系,并在83 代后適應了仔豬腎原代細胞。以104~124 代細胞適應毒制備5 批疫苗,主動免疫試驗的總保護率為95.92%;以106~139 代細胞適應毒制備的8 批疫苗,主動免疫試驗的總保護率為96.2%。在與TGEV 弱毒組合制備的二聯弱毒苗的初步田間試驗中取得良好效果。
2.3 乳酸桿菌疫苗
乳酸桿菌作為微生態制劑中的主要益生菌,廣泛應用于食品、飼料加工業。構建乳酸桿菌質粒載體,表達在黏膜系統中增殖的病原微生物的保護性抗原基因,制備綠色環保、可食用的多功能黏膜免疫的微生態制劑疫苗應用前景廣闊。而黏膜免疫恰恰是防治TGE 和PED 的主要途徑。因此,研制刺激腸道黏膜免疫系統的TGE 和PED 基因工程乳酸桿菌疫苗有重要意義。目前,有的實驗室正在開展乳酸桿菌表達TGEV、PEDV 主要保護性抗原基因的研究。此研究擬從健康豬體內分離鑒定出乳酸桿菌,并進一步篩選出thyA 基因缺陷型乳酸桿菌,構建含有TGEV 或PEDV主要保護性抗原基因的以thyA 基因為選擇壓力的非抗性乳酸桿菌表達載體,轉化乳酸桿菌,制備基因工程乳酸桿菌疫苗。目前已篩選出2 株thyA 基因缺陷型乳酸桿菌,并已初步鑒定。TGEV、PEDV 的S 基因的克隆擴增工作亦已結束[13]。
2.4 轉基因植物疫苗
Yang 等[14](2003)將PEDV 的S基因轉入煙草中,提取轉基因植物蛋白給小鼠注射,進行血清蝕斑減數中和測定,證明其具有免疫原性。給小鼠飼喂這種轉基因植物可誘導小鼠產生全身免疫和黏膜免疫。Yang 等[15](2005)相繼應用農桿菌介導的蛋白轉入法將PEDV 的S 基因的主要抗原位點(命名為K-COE)和合成的PEDV 中和抗原表位在煙草中表達,前者重組體蛋白占轉基因煙草葉片總可溶性植物蛋白含量的0.1%,后者含量則為2.1%。這些研究為研制PEDV 口服轉基因植物疫苗提供了新的思路。目前,在以煙草花葉病毒為載體的無煙堿煙草植物中PEDV 的S 蛋白中和表位得到了成功表達,用表達蛋白免疫接種后,對仔豬具有良好的保護作用,為PEDV 轉基因植物疫苗的研究奠定了基礎。一些研究者將PEDV的E 基因和M 基因導入甲病毒載體中,在BHK-21 細胞中得到了成功表達,這為進一步探討E 蛋白和M 蛋白在抗病毒中的作用奠定了基礎。植物的多種優越性均可被用于研究轉基因疫苗,并且已經取得了很大的進展。但仍有一些障礙必須克服,如蛋白在植物中的表達水平低、表達產物在植物中的穩定性差、轉基因口服疫苗在產生免疫反應之前在胃腸道內有時被消化等,科學家就這些問題進行了研究并正在加以解決。
2.5 核酸疫苗
核酸疫苗又稱為基因疫苗、DNA疫苗,是20 世紀90 年代初從基因治療研究領域發展起來的一種全新疫苗,與傳統的弱毒或滅活疫苗相比,DNA 疫苗具有不散毒、不返強的優點。DNA疫苗還具有可以制成標記性疫苗,便于臨床診斷監測;疫苗性質穩定,便于儲存和運輸;應用范圍廣,不僅可用于傳染病和寄生蟲病的免疫預防,而且還能夠用于腫瘤、自身免疫、過敏反應等疾病的治療等優點。另外,與亞單位疫苗相比,具有能長期激發機體體液和細胞免疫反應、制備工藝簡單和費用低廉(不用純化蛋白)的優點。雖然核酸疫苗兼具亞單位疫苗的安全性及減毒活疫苗的有效性,但核酸疫苗也存在整合到宿主染色體、致突變、產生抗菌素DNA 抗體等危險性,其安全性還有待于進一步觀察。豬流行性腹瀉核酸疫苗的研究還處于起步階段,是今后研究的熱點之一。
2.6 多價聯合疫苗
TGEV 和PEDV 均屬冠狀病毒,致病機理相似,組織嗜性相同。因此,研制聯苗亦是可行的。尤其在我國豬病毒性腹瀉廣泛流行,研制多聯苗更是十分必要的。
2.6.1 TGEV 與PEDV 二聯疫苗
該系列產品包括豬傳染性胃腸炎(TGE)和豬流行性腹瀉(PED)二聯滅活苗、二聯活疫苗和弱毒二聯疫苗,二聯滅活苗和二聯活疫苗是由中國農業科學院哈爾濱獸醫研究所的馬思奇、佟有恩共同主持完成的。該二聯疫苗的特點是:毒價高,后海穴接種(是對常規免疫途徑的突破),增強了免疫保護力,一次接種即可,省時、省力。經國內外聯機檢索查新證明,該二聯苗是國際領先研制成功的,并在技術上有原始創新。兩種疫苗可用于主動免疫保護不同年齡的豬只,但主要用于妊娠母豬的被動免疫以保護仔豬。其中二聯滅活苗主動免疫保護率為96%,被動免疫保護率為85.1%;二聯活疫苗主動免疫保護率為97.7%,被動免疫保護率為98%。2種二聯疫苗的免疫期均為6 個月,仔豬被動免疫期是哺乳期至斷奶后1 周。二聯滅活疫苗在免疫后14 d 產生免疫力;二聯活疫苗免疫后7 d 產生堅強的保護。PED 和TGE 弱毒二聯疫苗是用豬流行性腹瀉弱毒疫苗株PEDV-G1P83 和豬傳染性胃腸炎弱毒疫苗株TGEV-AG1制成。用該弱毒二聯疫苗進行了保存期試驗、安全效力、免疫期試驗和區域試驗。結果表明,試驗疫苗在-20 ℃保存4 個月,經4 個月保存的疫苗免疫效力未見下降。4 ℃保存48 h 對疫苗病毒的毒價沒有明顯影響。用該弱毒二聯疫苗按程序免疫妊娠母豬,對妊娠母豬安全,其仔豬獲得了良好的被動免疫。其對PEDV 強毒、TGEV 強毒和2 種 強毒混合攻擊的免疫效力分別達90.48%、93.75%和87.5%。用二聯弱毒疫苗免疫8~10 日齡的哺乳仔豬證明安全,28 日齡時(25 日齡斷奶)分別用PEDV強毒、TGEV 強毒和2 種混合強毒攻擊,免疫效力分別為100%、99.9%和73.3%。結果表明,該弱毒二聯疫苗能夠安全地對妊娠母豬和哺乳仔豬進行免疫,免疫后能有效地保護初生仔豬、斷奶豬和肥育豬抵抗TGEV 和PEDV 強毒的攻擊。該弱毒二聯疫苗在區域試驗中能顯著降低豬病毒性腹瀉的發病率和死亡率。
2.6.2 PEDV、TGEV、RV 三 聯滅活苗
上海農科院畜牧獸醫研究所錢永清等[17]采用豬流行性腹瀉病毒(PEDV)、豬傳染性胃腸炎病毒(TGEV)和豬輪狀病毒(RV)細胞培養物制備了三聯滅活疫苗。實驗室免疫結果表明,妊娠母豬和育肥豬免疫后15 d 達到較高的免疫水平,免疫有效期超過6 個月,妊娠母豬所產仔豬可獲得高水平的被動免疫保護。試驗場應用結果表明,母豬保護率達98%,仔豬被動免疫保護率達93%。
綜上所述,PEDV 的基因組為不分節段的單股正鏈RNA。其中Pol 基因在病毒感染早期發揮重要作用,S 基因被認為是發展有效抵抗冠狀病毒的主要靶抗原ORF3 基因與病毒毒力有關,sM 基因在病毒的自我組裝和出芽過程中起至關重要的作用,M 基因編碼的M 蛋白可以作為PEDV 基因工程疫苗的候選抗原,又鑒于冠狀病毒N 蛋白保守性強,所以利用N 基因編碼的N蛋白來建立PEDV 分子生物學診斷技術具有很好的應用前景。但豬流行性腹瀉病毒全基因組結構還需要深入研究。疫苗研制的最佳構想應該包括安全、有效果、多價、成本低及保存和使用方便等,但要達到上述目標還需要一個漫長的過程。PED 疫苗的研究已經取得了一些可喜的進展,隨著人們對病毒致病原認識的不斷深入,研制的PED 疫苗也在不斷完善,相信不久的將來科學家們會研制出特別有效的疫苗來控制PED 疾病的發生。
[1] Brian D A,Baric R S.Corona virus genome structure and replication[J].Curr Top Microbiol Immunol,2005,287:1-30.
[2] Knipe D M,Howley P M,Griffin D E,et a l.Fields virology(5thed)[M].Phi-ladelphia: Lippincott Williams﹠Wilkins,2007:707-736.
[3] Kang T J,Seo J E,Kim D H,et a1.Cloning and sequence analysis of the Korean strain of spike gene of Porcine epidemic diarrhea virus and expression of its neutralizing epitope in plants[J].Protein Expr Purif,2005,41(2):378-383.
[4] H.F.Egberink,J. Ederveen,P.Callebaut,et a1.Characterization of the structural proteins of porcine epizootic diarrhea virus, strain CV777,Am.J. Vet.Res.49(1988):1320-1324.
[5] Fan J H,Li Y J.Cloning and sequence analysis of the M gene of Porcine epidemic diarrhea virus LJB/03[J].Virus Genes.2005,30(1):69-73.
[6] Lee H K,Yeo S G.Cloning and sequence analysis of the nu cleocapsid gene of Porcine epidemic diarrhea virus Chinju99[J].Virus Genes,2003,26(2):207-212.
[7] 余麗蕓,侯喜林.流行性腹瀉病毒M 基因與甲病毒載體重組RNA 的構建[J].動物醫學進展,2005,26(5):73-76.
[8] 王明,馬思奇,等.豬流行性腹瀉滅活疫苗的研究[J].中國畜禽傳染病,1993,(5):17-19.
[9] 馬思奇,王明,馮力,等.豬流行性腹瀉病毒適應vero 細胞培養及以傳代細胞毒制備氫氧化鋁滅活疫苗免疫效力試驗[J].中國畜禽傳染病,1994(2):15-18.
[10] Song DS,Park BK, et al.Oral efficacy of Vero Cell Attenuated Porcine Epidemic Diarrhea Virus DR13 Strain[J].Res Vet Sci,2007,82(1):134-140.
[11] Kweon C H,Kang Y B,Kwon B J,et al.Derivation of Attenuated Porcine Epidemic Diarrhea Virus(PEDV) as Vaccine Candidate[J].Vaccine,1999,17(20/21):2546-2553.
[12] 佟有恩,馮力,馬思奇,等.豬流行性腹瀉弱毒株的培育[J].中國畜禽傳染病,1998,209(6):329-332.
[13] 劉巖,柏亞鐸,魯娜,等.豬傳染性胃腸炎和豬流行性腹瀉疫苗研究進展[J].2007,41(2):44-45.
[14] Bae J L,Jang YS,Yang MS,et al.Induction of Antigen-specific Systemic and Mucosal Immune Responses by Feeding Animals Transgenic Plants Expressing the Antigen[J].Vaccine,2003,21(25/26):4052-4058.
[15] Kang T J,Jang Y S,Yang M S,et al.Expression of the Synthetic Neutralizing Epitope Gene of Porcine Epidemic Diarrhea Virus in Tobacco Plants without Nicotine[J].Vaccine,2005,23(17/18):2294-2297.
[16] 錢永清,鄒勇,唐永蘭,等.豬流行性腹瀉、豬傳染性胃腸炎和豬輪狀病毒三聯苗免疫試驗[J].江西農業大學學報,2005,27(10):107-109.

