生物丁醇制造技術現狀和展望
顧陽,蔣宇,,吳輝,劉旭東,李治林,李鍵,肖晗,沈兆兵,趙靜波,楊蘊劉,姜衛紅,,楊晟,
1 中國科學院上海生命科學研究院植物生理生態研究所,上海 200032 2 上海工業生物技術研發中心,上海 201201
生物丁醇制造技術現狀和展望
顧陽1,蔣宇1,2,吳輝1,劉旭東1,李治林1,李鍵1,肖晗1,沈兆兵2,趙靜波1,楊蘊劉1,姜衛紅1,2,楊晟1,2
1 中國科學院上海生命科學研究院植物生理生態研究所,上海 200032 2 上海工業生物技術研發中心,上海 201201
丁醇是大宗基礎化工原料,并有望成為新一代生物燃料。利用可再生原料通過微生物發酵生產丁醇受到人們的很大關注。然而,與石油原料制造丁醇相比,目前生物丁醇的制造成本偏高。生物丁醇制造技術按重要性排序:在廉價原料替代、低丁醇濃度及存在丙酮、乙醇低值副產物 3個方面有改進空間。上海生物丁醇協作組設定了由易到難的技術路線圖:通過代謝工程提高丁醇比例;在丁醇高耐受菌株中導入和優化丁醇合成途徑;去除葡萄糖阻遏效應使之可利用復雜原料。協作組相信,通過與國內外廣泛的產學研合作,應可在不遠的將來開發出有經濟競爭力并可持續發展的生物丁醇生產工藝。
生物丁醇,生物燃料,丙丁梭菌,代謝工程
Abstract:Butanol is not only an important chemical feedstock but also expected to become a new generation biofuel.Thus,biological butanol production using renewable feedstocks has attracted renewed attention due to the worries of global oil supply and its impact on social and economic development.However, compared with petrochemical-derived butanol, biological butanol production is still not economically competition, because of its major drawbacks: high cost of the feedstocks, low butanol concentration in the fermentation broth and the co-production of low-value byproducts acetone and ethanol.Recently, Shanghai cooperative bio-butanol group(SCBG)developed a simple-to-complex technical route to improve bio-butanol production with a focus on: increasing butanol ratio in the solvent through metabolic engineering ofClostridiaspp.; introducing and optimizing the butanol synthetic pathway in the species with high butanol tolerance; overcoming the glucose repression effect to utilize low-costnon-grain based feedstocks.SCBG believes that, through extensive domestic and international industry-university-research cooperation, a sustainable and economically viable process for biological butanol production can be established in the near future.
Keywords:biobutanol, biofuel,Clostridia, metabolic engineering
丁醇既是重要的大宗化工原料,又是繼乙醇后的一種極具發展前景的新一代液體燃料,通過產溶劑梭菌Clostridia的厭氧發酵,可將合適的碳水化合物轉化為丙酮(Acetone)、丁醇(Butanol)和乙醇(Ethanol)等溶劑,此類溶劑生產技術因而也被簡稱為ABE發酵。
1 生物丁醇制造的歷史和現狀
生物法制備丁醇可追溯到第一次世界大戰期間,以產溶劑梭菌厭氧發酵產生的丁醇為起始原料合成丁二烯橡膠是當時生產合成橡膠的最理想路線。因此,在合成橡膠大規模生產的同時,以玉米粉等碳水化合物為底物的溶劑發酵得到快速發展,一度發展為僅次于酒精發酵的世界第二大發酵工業。但是,從20世紀50年代開始,由于受到石油工業的沖擊,ABE發酵逐漸衰落,在歐洲、北美和日本等地逐步停止了生產。而中國,由于當時特殊的經濟和政治環境,是少數幾個仍然進行ABE發酵生產的國家之一。
1955年,中國第一家ABE發酵工廠——上海溶劑廠開始使用玉米發酵生產ABE。隨后的二、三十年間,在北京、江蘇、天津、云南、山西、浙江、河北、山東、吉林等省市,又陸續建立了約30家規模在年產3 000~10 000 t的ABE發酵工廠,使得國內ABE年生產能力達到17萬t[1-2]。然而,隨著石油合成化工的蓬勃興起,發酵法生產ABE在生產成本上越來越沒有競爭優勢,國內ABE發酵企業自上世紀90年代開始逐步關閉。
近年來,隨著國際石油價格的劇烈波動以及基于石油資源不可再生性的共識,發酵法生產ABE技術重新引起了廣泛關注[2-3]。近幾年,國內已有 11家ABE發酵企業建成或恢復生產,另有5家還在籌建中(表1),預計投產后,國內ABE發酵生產將達到年產100萬t的規模[2]。盡管2008年底的金融危機使得丁醇價格從每噸1.3萬元下跌到5 000元,丙酮從每噸 9 000元下跌到 4 000元(http://www.bioindustry.cn/info/view/13122),迫使這些工廠停產,但隨著近期丁醇市場價格的回升,目前吉安生化、江蘇聯化和江蘇聯海的丁醇裝置均已復產,河南天冠的丁醇裝置也將于年底建成投產。
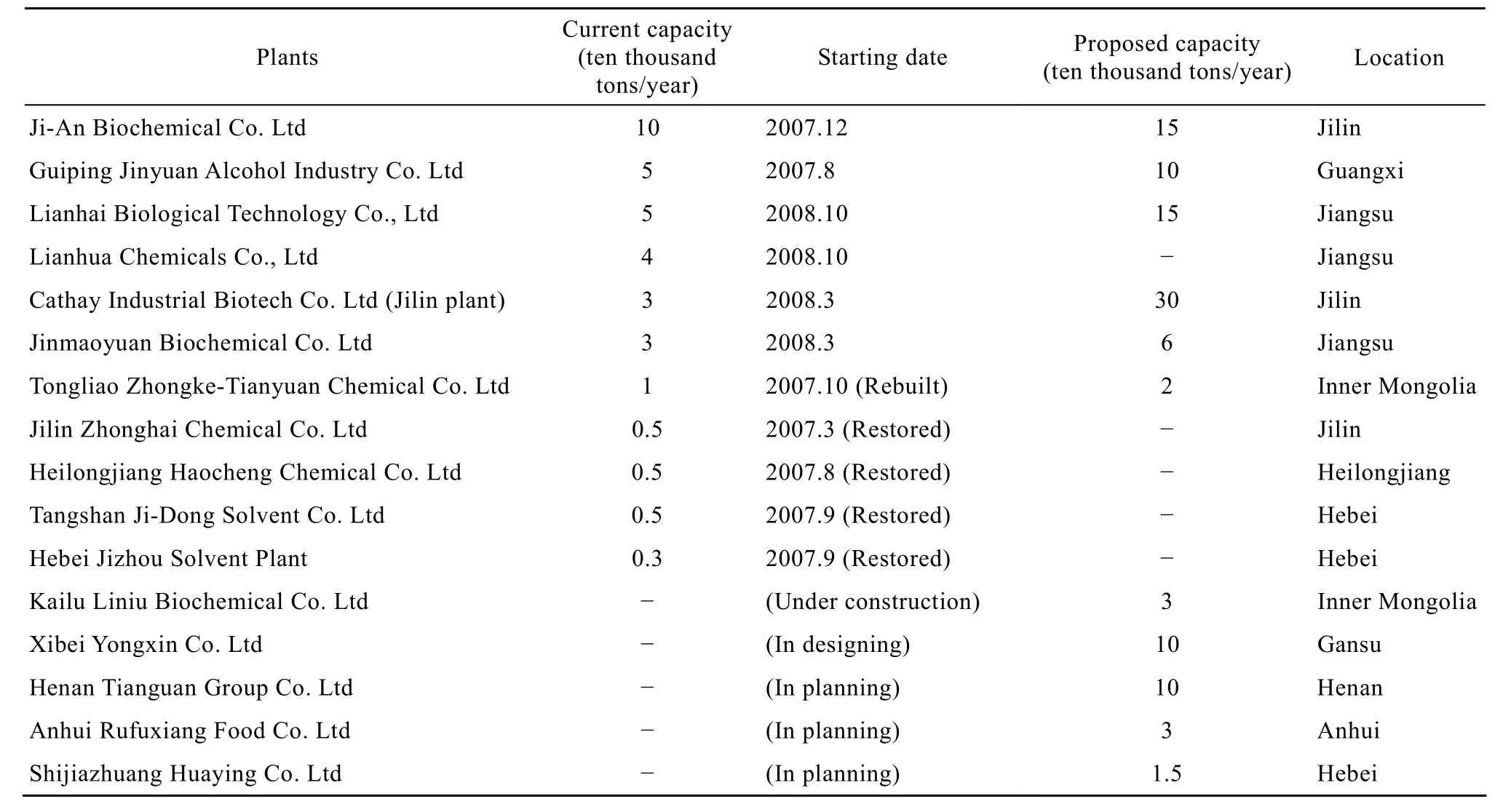
表1 中國ABE發酵企業[2](產能數據統計截止日期為2008年6月)Table 1 Summary of some ABE plants in China(capacity data updated to June, 2008)
梭狀芽胞桿菌Clostridia是產溶劑工業菌種的唯一來源,傳統的ABE發酵中使用的工業菌種名目繁多,有關產溶劑梭菌的分類學和系統發育相關性含糊不清,比較混亂。近年來,通過系統學[4-5]、基因組DNA/DNA雜交和DNA指紋圖譜[4]以及發酵性能[6]等方面的比較研究和分析認為,工業用的產溶劑梭菌歸為 4個“種”(Species),所有原來的淀粉發酵型菌株屬于單獨一個種,即丙酮丁醇梭菌Clostridium acetobutylicum。該類菌呈現較強的淀粉酶活力,適用于發酵玉米和谷類等淀粉質原料,同時具有獨特的系統發育特性,與其他3個緊密相關的種,即拜氏梭菌Clostridium beijerinckii、糖丁酸梭菌Clostridium Saccharobutylicum和糖乙酸多丁醇梭菌Clostridium saccharoperbutylacetonicum的親緣關系較遠。已被鑒定的糖-發酵菌株大多數屬于拜氏梭菌。除了南方少數企業外,針對我國以谷、薯類為主的農業生產狀況,溶劑發酵菌種多為丙酮丁醇梭菌,且由國內的研究所或工廠自行選育馴養而來,如中國科學院微生物研究所的AS 1.70,上海溶劑廠的具有抗噬菌體能力的新抗-2號。這些菌種所產溶劑中3種組分丁醇∶丙酮∶乙醇均為6∶3∶1。“七五”期間,中國科學院上海植物生理生態研究所的焦瑞身、楊蘊劉研究員等通過土樣分離和誘變篩選獲得到了高丁醇比例菌株EA 2018,其溶劑中3種組分丁醇:丙酮:乙醇為7∶2∶1,淀粉轉化率比傳統菌種高 5%[1]。此外,其他溶劑廠也結合自身特點,選育出適用于特定原料如糖蜜、水解液的菌種(表2)。
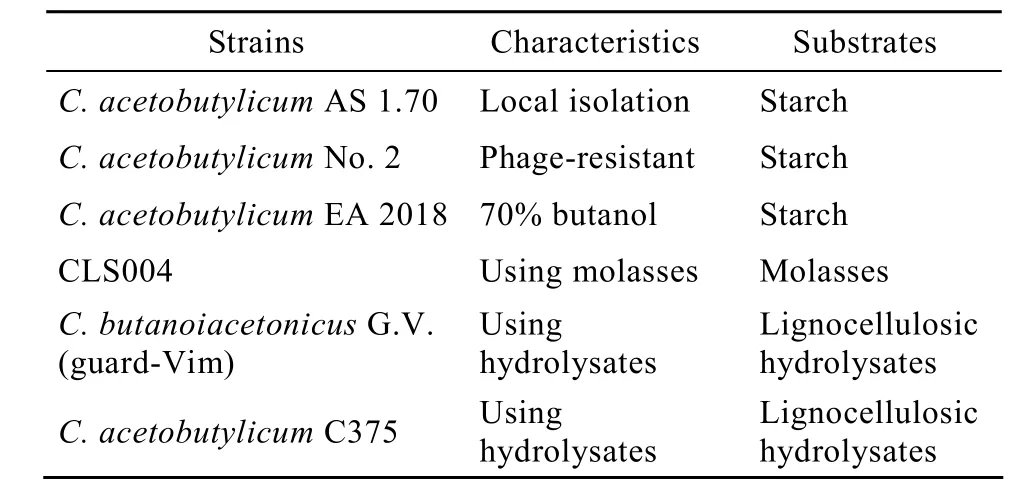
表2 中國ABE發酵所用菌種Table 2 Strains used in ABE fermentation in China
2 當前生物丁醇制造中面臨的問題
如上所述,由于石油化工的快速發展,面對石油基丁醇的激烈競爭,ABE發酵產品在經濟上處于不利地位。導致丁醇發酵缺乏經濟競爭力的主要原因是:1)用作發酵的碳源成本偏高;2)發酵液中的丁醇濃度低;3)發酵過程中的丁醇選擇性不高。現就這些問題分述如下:
2.1 糧食原料的高成本
傳統發酵法生產丁醇的工藝主要包括溶劑的連續發酵、產物及副產物的蒸餾法分離提取,生產過程中的環境保護措施等等。目前,國內厭氧發酵生產生物丁醇的主要原料為玉米、谷物、薯干等淀粉質糧食資源。根據2009年的文獻數據,ABE工業化發酵生產1 t溶劑需要消耗玉米約4.0~4.5 t,蒸汽約13~25 t,水約 20~30 t,電約 700~100 kw·h[2]。近年來由于國內以玉米等糧食作物為原料的生物煉制行業發展迅速,一定程度上促成了全國糧食價格的較快上升,致使生物丁醇生產成本大幅度增加。同時,國家出于維護糧價穩定和糧食安全戰略的考慮,開始限制大規模使用玉米等糧食作物發展生物能源。因此,如何通過提高丁醇的原料轉化率和利用廉價非糧類原料生產丁醇來降低其生產成本,成為該產業所必須直面的瓶頸問題。
2.2 丁醇毒性造成的低產物濃度
傳統ABE發酵中生成的是三聯產物(丙酮、丁醇和乙醇),提高溶劑三成分中主產物丁醇的濃度是降低發酵法制造丁醇成本的手段之一。據分析,如果丁醇發酵的產物濃度由12 g/L提高的19 g/L,產物分離的后續蒸餾成本將可降低一半[7]。然而,傳統的丙酮丁醇梭菌發酵生產中的丁醇終濃度維持在13~14 g/L左右,難于超過這一閾值的原因在于所生成的溶劑特別是丁醇對產溶劑梭菌細胞的毒害作用[8]。研究表明丁醇的親脂性使其比其他產物在破壞細胞膜的磷酯組分并增加膜流動性方面顯示更強的作用[9]。高濃度的丁醇嚴重破壞細胞質膜的結構,干擾細胞膜的正常生理功能。當丙酮丁醇梭菌的生長環境中添加 1%的丁醇時,細胞膜流動性相應提高20%~30%[10],由此破壞了細胞內外的pH梯度,降低了胞內ATP水平和影響葡萄糖的吸收,繼而抑制梭菌細胞的生長繁殖乃至殺死梭菌細胞[9]。雖然國外報道的拜氏梭菌C.beijerinckiiBA101在MP2培養基以及發酵調控條件下的丁醇產物濃度可達到20.9 g/L(總溶劑為32.6 g/L),是目前報道的產溶劑最高的菌株[11],但這是在特殊培養基和培養條件下得到的結果,還不具備工業應用的可能。為了提高產溶劑梭菌本身的丁醇耐受性,Tomas等在丙酮丁醇梭菌中過表達編碼熱激蛋白的groESL基因,使丁醇對菌體細胞的抑制作用降低了85%,并最終使產物濃度提高了 33%[12]。Borden等在丙酮丁醇梭菌中過表達來源于基因組 DNA文庫中篩選過程中確定的2個與丁醇耐受性相關的基因,即可使重組菌體細胞的丁醇耐受水平分別提高了13%和81%[13]。上海丁醇協作組的趙靜波與俄亥俄州立大學的楊尚天等合作,利用纖維床固定化生物反應器對丁醇生產菌株進行馴化,使固定在其中的菌體細胞不斷提高在產溶劑時期對丁醇、有機酸和自溶素等抑制物的抵抗能力,最終獲得了丁醇耐受性和丁醇產量均顯著提高的突變株。該菌株在P2培養基中發酵的丁醇終濃度可達 21 g/L。當該突變株與纖維床反應器固定化發酵技術相結合時,在P2培養基中的丁醇發酵終濃度可達24~29 g/L[14]。總體說來,通過基因工程和代謝工程的手段雖可一定程度上提高產溶劑梭菌的丁醇耐受性,但這種“提高”很大程度上也受到菌株自身條件的限制。就目前工業規模的溶劑發酵而言,發酵液中的總溶劑達20 g/L時,梭菌細胞的代謝即刻停止[15],按丁醇比為 60%或 70%計,最終丁醇濃度在12~14 g/L之間,這是現有工業菌種很難進一步超越的丁醇耐受性水平。因此,傳統ABE發酵中的低產物濃度已成為影響發酵經濟性的重要因素之一。
2.3 發酵產物中的丙酮和乙醇副產物
目前傳統丙酮丁醇梭菌 ABE發酵過程中,除了60%為丁醇外,同時還會有30%的丙酮和10%左右的乙醇[2]。ABE發酵的產物中丁醇的商業價值最高,現今價格維持在12 000元/t左右,副產物丙酮和乙醇屬于低值產物,價格分別在8 500元/t和5 000元/t左右。同時,所產生的乙酸和丁酸既無法回收,更是降低了原料的轉化效率增加了生產成本。因此,在無法進一步大幅提高發酵產物濃度的情況下,提高發酵過程中作為主發酵產物丁醇生物合成的選擇性,減少副產物量來提高丁醇比例,降低糧耗不失為提升生物丁醇發酵產業經濟性和競爭力的有效手段。但丁醇耐受性仍是一個不可避免而必須考慮的關鍵問題。中國科學院上海生命科學研究院的科研人員通過傳統誘變方法,盡管獲得了高丁醇比丙酮丁醇梭菌EA2018[16],產物丁醇∶丙酮∶乙醇為7∶2∶1,比傳統菌種的丁醇比例提高10%,但從其發酵總溶劑濃度看,丁醇的濃度尚處在14 g/L左右,如要突破所述丁醇耐受性的閾值,還需作出更大的努力。
3 研究進展與應用
中國科學院上海植物生理生態研究所的研究人員從上世紀50年代起研究丙酮丁醇連續發酵制備技術,國家“七五”攻關期間通過誘變篩選獲得了高丁醇比例的 EA2018菌株,曾在河北、山東等地成功投入工業化連續發酵生產應用,規模達到6 000 t/年。近年來,該所中國科學院合成生物學重點實驗室的楊蘊劉、姜衛紅、楊晟研究組協作攻關,開始進行產溶劑梭菌的遺傳改造研究,并形成上海生物丁醇協作組。該協作組的主要技術思路是針對當前生物丁醇制造中面臨的問題,通過產丁醇發酵菌株的遺傳改造以及發酵、產品回收工藝的優化實現以下3方面目標:1)提高產品中的丁醇比例;2)尋找廉價的替代原料;3)提高發酵產物的濃度。從而克服傳統發酵法制造丁醇過程中的限制性瓶頸,繼而提高生物丁醇的生產經濟性。
3.1 提高丁醇比例
提高丁醇比例可以通過對微生物丁醇途徑的重構和優化實現。經典的丁醇代謝途徑來源于產溶劑梭菌。產溶劑梭菌除生成 60%~70%的丁醇外,還有20%~30%的丙酮和10%的乙醇這2種低值副產物。通過對丁醇途徑的重構和優化有可能降低丙酮和乙醇的合成量,在保持菌株原有的較高轉化效率的基礎上進一步提高丁醇在總溶劑中所占的比例,增強丁醇生產的經濟競爭力。
為降低副產物丙酮的生物合成量,Janati-Idrissi等通過傳統化學誘變手段,獲得了不產丙酮的突變株C.acetobutylicum2-BrBu1,但是丁醇比例也同時降低[17]。美國Eleftherios Terry Papoutsakis實驗室于2003年報道了利用反義 RNA技術抑制丙酮丁醇梭菌中的乙酰乙酸脫羧酶基因adc的轉錄,但丙酮濃度并未減少;接著用相同的方法抑制該菌中輔酶 A轉移酶基因ctfAB的轉錄,雖然抑制了丙酮的產生,但該法同時抑制了和ctfAB同處一個操縱子的乙醇脫氫酶E基因adhE的轉錄,鑒于該酶是丁醇和乙醇合成途徑的關鍵酶,因此幾乎無乙醇和丁醇的產生[18];該項目組繼而在抑制ctfAB轉錄基礎上回補adhE,但只提高了乙醇的產量,丁醇產量沒有提高,丁醇比例反而下降[19];而在丟失大質粒 pSOL的不產溶劑的丙酮丁醇梭菌退化菌株M5或DG1中通過過表達adhE基因重構丁醇途徑可恢復丁醇產生,丁醇比例可達到90%以上,但是丁醇濃度為野生型的1/2[20-21]。
上海生物丁醇協作組蔣宇等通過敲除 EA2018菌株的丙酮合成途徑關鍵酶(乙酰乙酸脫羧酶)基因,基本阻斷了丙酮的產生,并經代謝流分析與發酵優化將丁醇的比例提高到85%以上[22]。盡管生物化學和分子生物學研究業已證明,丁醇/乙醇的生物合成共用醛-醇脫氫酶,但如何進一步降低乙醇比例,成功報道甚少。這是由于無法通過基因敲除的手段阻斷乙醇產生而不影響丁醇生產。Papoutsakis實驗室通過對在M5中過表達adhE基因的重組菌的發酵優化,使丁醇比例達到85%且濃度和野生型菌株相當,但進一步的代謝調控效果甚微[23-24]。上海生物丁醇協作組蔣宇等正在通過代謝調控和酶特異性改造,進一步提高丁醇/乙醇比例。
3.2 拓寬生物丁醇制備中的原料源
3.2.1 薯類、菊芋等非糧原料
薯類是淀粉含量很高的農作物,包括木薯、紅薯、馬鈴薯等,在世界各地以及我國均有大量種植。薯類原料的市場價格較玉米、小麥等糧食類原料低廉,因此已被大量用于生物乙醇的生產。一些生物丁醇生產企業也在玉米原料中混入薯類原料進行發酵,以減少玉米的用量。由于薯類原料中淀粉以外的營養成分,如蛋白質等含量要明顯低于玉米,因此完全以薯類原料進行發酵的丁醇產量較低,需要通過培養基和發酵條件的優化實現木薯等薯類原料對玉米的完全替代,真正實現生物丁醇的非糧發酵[25]。
菊芋是一種多年生草本植物,俗稱洋姜、鬼子姜。菊芋生物量極大,每公頃可產菊芋塊莖30~75 t。鮮菊芋塊莖中富含多聚果糖,是一種極具開發潛力的半野生資源,是微生物發酵生產生物基化學品的良好糖源。國外以菊芋為原料發酵制備丁醇的研究多有報道。Marchal等在調控pH的條件下,使得菊汁水解液發酵的總溶劑濃度達到23~24 g/L[26]。大連化學物理研究所杜昱光研究員課題組提供的菊芋原料,經上海生物丁醇協作組試驗證明,經菊粉酶處理后的水解液能被梭菌發酵產生丁醇,總溶劑濃度接近玉米原料水平。如果能夠實現原料的規模化供應并進一步控制原料處理成本,相關研究成果具備工業化生產的可能。
小麥B淀粉又稱尾淀粉、淤渣淀粉、刮漿淀粉或淀粉糊精,是小麥淀粉加工以及以小麥為原料發酵酒精的副產物,可用于發酵生產丁醇。國內的天冠集團受讓了上海生物丁醇協作組的C.acetobutylicumEA 2018菌株,并開發了B淀粉漿和玉米的混合發酵丁醇工藝,進而實現了單獨以B淀粉漿為原料進行生物丁醇的生產。
3.2.2 木質纖維原料
木質纖維素被普遍認為是一種最具應用潛力的發酵原料。近年來,國外圍繞木質纖維素發酵制備 ABE溶劑的研究多有報道。Qureshi等采用C.beijerinckiiP260菌株測試了麥草水解液的溶劑發酵情況,在分步糖化發酵和同步糖化發酵2種工藝條件下,ABE產物濃度分別達到13.12、11.93 g/L[27];采用分批-補料發酵工藝時,C.beijerinckiiP260菌株的丁醇生產強度為0.36 g/(L·h),高于批式發酵的0.31 g/(L·h)[28]。C.beijerinckiiBA101 菌株也被用于玉米皮水解液的發酵測試,ABE溶劑濃度可達9.3 g/L[29]。相比較國外而言,國內的相關研究較少,早期的如陳守文等利用丙酮丁醇梭菌C.acetobutylicumC375菌株發酵稻草酶法水解液,分別研究了氮源、生長因子、pH等因素對發酵的影響,最終的總溶劑濃度為12.8 g/L,溶劑生成率為 29.9%[30];近年來中國科學院過程研究所的李冬敏等利用汽爆秸稈膜循環酶解耦合技術進行了丙酮丁醇發酵的研究,實現了酶解與發酵的同步進行[31]。國內的吉安新能源集團有限公司受讓了上海生物丁醇協作組的C.acetobutylicumEA 2018菌株,并與中國科學院過程研究所的陳洪章課題組聯合開發了秸稈半纖維素發酵丁醇技術,完成了年產600 t燃料丁醇的工業示范生產線(http://www.ipe.cas.cn/xwdt/ttxw/200910/t20091022_2586814.html)。
綜合目前的研究進展來看,木質纖維素轉化制造丁醇的工藝路線可以概括為:原料預處理和水解為單糖;糖液發酵生成丁醇;產物蒸餾回收等。盡管上述工藝路線具備可行性,但仍有諸多技術瓶頸需要克服。僅就菌種而言,纖維水解液中五碳糖和六碳糖的同等利用是迫切需要解決的難點之一。
1)五碳糖代謝
木質纖維原料中的六碳糖主要是葡萄糖(纖維素的主要組分),五碳糖主要是木糖以及阿拉伯糖(半纖維素的主要組分)[32]。其中,葡萄糖是最主要成分,其次為木糖,阿拉伯糖的含量較少。產溶劑梭菌(C.acetobutylicum,C.beijerinckii)具備天然的木糖利用能力,但與葡萄糖相比,木糖代謝能力不足,具體表現為在以木糖為唯一碳源發酵時,溶劑得率和生成速率低[33]。鑒于木糖是木質纖維原料中含量僅次于葡萄糖的最主要五碳糖,因此,開展產溶劑梭菌的木糖代謝工程研究具有重要意義。
對于大多數細菌來說,木糖被轉運入細胞后首先通過木糖異構酶和木酮糖激酶兩步催化反應生成5-磷酸木酮糖,隨后進入磷酸戊糖途徑(Pentose phosphate pathway,PPP),過程中涉及4個關鍵酶:轉醛酶、轉酮酶、5-磷酸-核糖異構酶以及 5-磷酸-核酮糖差向異構酶,最后以產物6-磷酸果糖和3-磷酸甘油醛進入糖酵解途徑。Cynkin等研究者早先提出在梭菌中木糖也經由這條途徑代謝[34-35],但限于基因組信息以及遺傳操作手段的匱乏,在分子水平上對該途徑上關鍵酶基因的解析工作一直未見報道,因而也就無法給菌株的木糖代謝工程改造提供相關信息。隨著近年來丙酮丁醇梭菌模式菌株C.acetobutylicumATCC 824全基因組信息的公布[36],以及產溶劑梭菌遺傳操作技術上的突破[37-38],上述木糖途徑解析的研究工作也迎來了契機。上海生物丁醇協作組顧陽等通過比較基因組學以及分子生物學實驗鑒定了C.acetobutylicumATCC 824木糖代謝途徑中的木糖異構酶基因xylA和木酮糖激酶基因xylB[39],并通過在C.acetobutylicumATCC 824中過量表達E.coli來源的轉醛酶基因A(talA),提高了該菌株的木糖利用率,從而證明了在丙酮丁醇梭菌C.acetobutylicum中轉醛酶是PPP途徑的限速酶之一[40]。由此可見,采用代謝工程實驗方法增強產溶劑梭菌中木糖代謝通量是提高其木糖利用能力的有效手段。
2)葡萄糖阻遏效應(Carbon catabolite repression,CCR)的解除
微生物在利用復雜碳源過程中普遍存在CCR效應[41],即速效碳源的快速利用對非速效碳源的代謝產生抑制作用。這一現象在產溶劑梭菌發酵木質纖維素水解液過程中同樣存在[42]。換言之,水解液中同時存在的葡萄糖抑制了細胞對其他糖源(木糖、阿拉伯糖等五碳糖)的有效利用,降低了物料轉化效率和發酵的經濟性。因此,解除產溶劑梭菌中的CCR效應、實現其對五碳糖和六碳糖的同等利用是木質纖維素制備生物丁醇中的一個關鍵科學問題。
在革蘭氏陽性菌模式菌株枯草芽胞桿菌Bacillus subtilis中的已有研究表明,CCR效應的發生是由多效調控因子 CcpA介導的[43]。作為重要的工業菌種,有關產溶劑梭菌CCR效應的相關機理性研究極少,其中是否也存在與B.subtilis中相似的CcpA調控元件以及CCR效應的作用模式,這些問題都有待深入研究。2001年丙酮丁醇梭菌C.acetobutylicumATCC 824全基因組序列的公布為上述研究提供了信息平臺[36]。英國Heriot-Watt大學的Mitchell教授等2003年通過生物信息學分析預測了C.acetobutylicumATCC 824中存在參與CCR效應的調控元件 CcpA[44]。本協作組的任聰等對C.acetobutylicumATCC 824中的CcpA蛋白作了鑒定,并證明該蛋白確實與CCR效應相關[45]。同時,通過敲除 ATCC 824中的ccpA基因,菌株固有的CCR效應得以解除,實現了對葡萄糖-木糖混合碳源的同等利用[45]。上述研究結果為通過代謝工程手段構建適用于木質纖維水解液混糖發酵的工程菌株提供了新思路。上海生物丁醇協作組現在已經獲得一株能耐受玉米秸稈蒸汽爆破酶解糖液中的抑制物,并能同時利用其中葡萄糖和木糖高產丁醇的菌株(結果未發表)。
3.2.3 合成氣
合成氣主要是由CO、H2、CO2組成的混合氣體,來源廣泛,包括煤、油頁巖、焦油沙、重殘渣、劣質天然氣以及生物質。以合成氣為原料合成氨、含氧化合物和烴類等化工原料的生產技術已投入商業運行。近年來,以生物技術主導的合成氣綜合利用技術引起廣泛關注,尤其是通過厭氧發酵方法將合成氣轉化成各種有用的燃料和化學品已成為新的研究熱點[46]。
能夠利用合成氣的微生物都是厭氧菌,其可分為兩種類型,一種以C1化合物(CO或CO2)作為碳源,而以氫作為能源;另一種同時利用C1化合物作為碳源和能源。大多數能夠利用合成氣的微生物的主要產物為乙酸、乙醇和H2[46],其中,微生物利用合成氣厭氧發酵生產乙醇是迄今為止唯一成功實現產業化的技術。Clostridium ljungdahlii是目前合成氣發酵產乙醇最具潛力的菌株。Phillips等[47]通過發酵條件和培養基優化,使得該菌株乙醇發酵的產物濃度上升到23 g/L。此外,Clostridium carboxidivoransP7對合成氣的利用能力也受到廣泛關注,該菌株發酵合成氣產生的乙醇濃度可達10 g/L[48]。
目前已知的可利用合成氣發酵生產丁醇的微生物菌株僅有Clostridium carboxidivoransP7(DSM15243)和Butyribacterium methylotrophicum(DSM3468),丁醇產量分別為1.776 g/L和2.7 g/L[49]。實現微生物利用合成氣發酵生產丁醇的可行技術路線主要包括:1)在Clostridium ljungdahlii等乙醇生產菌株中引入乙醇到丁醇的代謝途徑;2)對天然的可利用合成氣發酵生產丁醇的微生物進行代謝工程改造,提高丁醇的生產強度;3)在傳統的利用糖源的丁醇生產菌株中導入合成氣代謝途徑。上海生物丁醇協作組肖晗等已初步建立了合成氣丁醇產生菌的遺傳操作系統,正在嘗試進行基因工程改造。
3.3 提高ABE發酵液中的丁醇濃度
3.3.1 低溫發酵和產物氣提回收技術
丁醇對菌體細胞具有較大毒性,通過菌株遺傳改造增強其丁醇耐受性僅為提高丁醇生物合成的選擇性和產物濃度創造了有利條件。為降低發酵產物丁醇對生產菌種的抑制作用,尚可通過發酵和下游工藝的改進來減輕發酵液中的丁醇毒性,進而提高發酵終點的丁醇濃度。Glassner等采用發酵溫度調控的方法來提高丁醇產物濃度,取得良好的效果[50],在產溶劑階段的發酵溫度由37℃下調至30℃甚至更低,產物丁醇濃度可以達到16.5 g/L以上。本協作組劉旭東等通過變溫發酵實現溶劑產量的大幅提高,丙酮丁醇梭菌 EA2018的玉米單批發酵總溶劑產量可達28.0 g/L,其中丁醇20.1 g/L、乙醇3.4 g/L、丙酮4.5 g/L(數據未發表)。不過,采用溫控技術實現丁醇高產過程中,由于溫度降低使得梭菌細胞代謝減緩,因此發酵周期會延長,細胞生產強度會降低;此外,降溫操作從工業應用角度來說要增加能耗,并增大設備的前期投資,因此,要綜合考慮丁醇產量提高和生產運行成本之間的經濟平衡。
采用發酵-產物氣提法回收(Gas-stripping)耦合技術也是降低溶劑毒性的有效方法[51-53]。該方法利用發酵產生的氣體(H2、CO2)或者外界通入惰性氣體來捕捉發酵產物,降低發酵液中的溶劑量,收集到的溶劑傳送至冷凝裝置回收,而氣體可以回流到發酵體系中繼續回收發酵產物。同一協作組的陳軍等通過C.acetobutylicumEA 2018批式玉米醪發酵-氣提耦合技術將 ABE發酵產物的濃度提高至30 g/L,其中丁醇20 g/L(數據未發表)。
3.3.2 在高耐丁醇菌株中構建異源丁醇途徑
傳統丁醇發酵中產物濃度的提高主要受制于菌株丁醇耐受性差。主要的產溶劑梭菌C.acetobutylicum的丁醇耐受極限低于2%(V/V)[54]。從菌體細胞對丁醇耐受性的研究結果來看,該表型是由多基因決定的,并且擁有十分復雜的調控網絡[55],這使得對目前菌株的丁醇耐受性改造存在一定的困難。
已有的研究發現,某些菌株如Lactobacillus brevis、Lactobacillus delbrueckii[56]具有明顯高于目前的產溶劑梭菌的丁醇耐受性,表明高丁醇耐受性的菌株在自然界中是存在的。協作組的李鍵等通過馴化及篩選等策略獲得 2株丁醇耐受菌株,經鑒定均屬于乳酸桿菌屬Lactobacillus。在此基礎上,通過對一個乳酸菌庫的丁醇耐受性檢測,發現其中大部分菌株具有明顯高于產溶劑梭菌的丁醇耐受性,暗示了乳酸桿菌屬作為一個整體,可能具有較高丁醇耐受性。同時,獲得的數株丁醇耐受極限高于 3%(V/V)的菌株,有潛力成為構建丁醇途徑的宿主菌。
丁醇合成途徑已被成功導入Escherichia coli[57-58]、Saccharomyces cerevisiae[59]、Pseudomonas putida[60]和Bacillus subtilis[60]、Lactobacillus brevis[61]中,并用于丁醇生物合成的研究,所有上述菌株發酵后都能夠獲得微量的丁醇,證明由非自然宿主生產丁醇是可行的。當然,異源丁醇合成也存在諸多困難,如:酶蛋白編碼基因的合理選擇,基因的有效表達,代謝中間產物的平衡以及完全敲除競爭性途徑等,未來仍然需要合成生物學、代謝工程、蛋白質工程等手段來提高丁醇的產物濃度。
4 展望
丁醇作為一種重要的化學品和新一代的生物燃料,其生物法制備方法已逐漸成為世界范圍內的研究熱點。當前迫切需要解決的是進一步降低生物丁醇的制造成本,以獲得相對于石化合成路線的市場競爭優勢。
根據我國農產品種植結構,傳統ABE發酵中最常用的底物主要是玉米、薯干、谷物等淀粉質原料,這些農產品一定程度上可作為日常口糧,也用作禽畜飼料和工業用糧。考慮到國家的糧食安全問題,生物丁醇產業發展的出路在于非糧類底物的高效利用以及木質纖維素用于溶劑發酵并達到工業化規模生產的水平。在纖維丁醇生產工藝處于尚難產業化,有待完善的條件下,以木薯、菊芋等非糧作物替代玉米進行溶劑發酵也是一條可供選擇的措施。但是隨著人們對木質纖維素水解研究的深入和纖維素酶成本的下降,此類可再生資源用于丁醇的發酵生產將成為必然的發展趨勢。
為增強丁醇發酵的經濟競爭力,除了采用廉價原料及其相適應的生產菌外,不論是提高發酵的丁醇濃度(Concentration)、底物轉化效率(Yield)還是生產強度(Productivity),培育和構建新型生產菌種至關重要,而基因工程和代謝工程等近代分子生物學技術為此目標的實現提供了可能性。
致謝:江南大學的孫志浩教授和倪曄副教授為本文提供了數據支持,在此表示感謝。
REFERENCES
[1]Chiao JS, Sun ZH.History of the acetone-butanol-ethanol fermentation industry in China: development of continuous production technology.J Mol Microbiol Biotechnol, 2007, 13(1/3): 12?14.
[2]Ni Y, Sun ZH. Recent progress on industrial fermentative production of acetone-butanol-ethanol byClostridium acetobutylicumin China.Appl Microbiol Biotechnol,2009, 83(3): 415?423.
[3]Lee SY, Park JH, Jang SH,et al. Fermentative butanol production byClostridia.Biotechnol Bioeng, 2008,101(2): 209?228.
[4]Keis S, Bennett CF, Ward VK,et al. Taxonomy and phylogeny of industrial solvent-producing clostridia.Int J Syst Bacteriol, 1995, 45(4): 693?705.
[5]Johnson JL, Toth J, Santiwatanakul S,et al. Cultures of“Clostridium acetobutylicum” from various collections compriseClostridiumacetobutylicum,Clostridium beijerinckii, and two other distinct types based on DNA-DNA reassociation.Int J Syst Bacteriol, 1997,47(2): 420?424.
[6]Shaheen R, Shirley M, Jones DT. Comparative fermentation studies of industrial strains belonging to four species of solvent-producing clostridia.J Mol Microbiol Biotechnol, 2000, 2(1): 115?124.
[7]Papoutsakis ET. Engineering solventogenic clostridia.Curr Opin Biotechnol, 2008, 19(5): 420?429.
[8]Vollherbst-Schneck K, Sands JA, Montenecourt BS. Effect of butanol on lipid composition and fluidity ofClostridium acetobutylicumATCC 824.Appl Environ Microbiol, 1984, 47(1): 193?194.
[9]Bowles LK, Ellefson WL. Effects of butanol onClostridium acetobutylicum.Appl Environ Microbiol,1985, 50(5): 1165?1170.
[10]Liu SQ, Qureshi N. How microbes tolerate ethanol and butanol.New Biotechnol, 2009, 26(3/4): 117?121.
[11]Chen CK, Blaschek HP. Acetate enhances solvent production and prevents degeneration inClostridium beijerinckiiBA101.Appl Microbiol Biotechnol, 1999,52(2): 170?173.
[12]Tomas CA, Welker NE, Papoutsakis ET. Overexpression ofgroESLinClostridium acetobutylicumresults in increased solvent production and tolerance, prolonged metabolism, and changes in the cell's transcriptional program.Appl Environ Microbiol, 2003, 69(8): 4951?4965.
[13]Borden JR, Papoutsakis ET. Dynamics of genomic-library enrichment and identification of solvent tolerance genes forClostridium acetobutylicum.Appl Environ Microbiol,2007, 73(9): 3061?3068.
[14]Zhao J, Yang S, Jiang W,et al. High titer butanol production using a mutantClostridium beijerinckiiachieved by adaptation in fibrous bed bioreactor.American Institute of Chemical Engineering(AIChE)National Meeting, 2009.
[15]Woods DR. The genetic engineering of microbial solvent production.Trends Biotechnol, 1995, 13(7): 259?264.
[16]Zhang YF, Chen J, Yang YL,et al. Breeding of high?ratio butanol strains ofClostridicum acetobutylicumand application to industrial production.Ind Microbiol, 1996,26(4): 1?6.張益 棻 , 陳軍, 楊蘊劉, 等.高丁醇比丙酮丁醇梭菌的選育與應用.工業微生物, 1996, 26(4): 1?6.
[17]Janati-Idrissi R, Junelles AM, el Kanouni A,et al.Selection of mutants ofClostridium acetobutylicumdefective in production of acetone.Ann Inst Pasteur Microbiol, 1987, 138(3): 313?323.
[18]Tummala SB, Welker NE, Papoutsakis ET. Design of antisense RNA constructs for downregulation of the acetone formation pathway ofClostridium acetobutylicum.J Bacteriol, 2003, 185(6): 1923?1934.
[19]Tummala SB, Junne SG, Papoutsakis ET. Antisense RNA downregulation of coenzyme A transferase combined with alcohol-aldehyde dehydrogenase overexpression leads to predominantly alcohologenicClostridium acetobutylicumfermentations.J Bacteriol, 2003, 185(12): 3644?3653.
[20]Nair RV, Papoutsakis ET. Expression of plasmid-encodedaadinClostridium acetobutylicumM5 restores vigorous butanol production.J Bacteriol, 1994, 176(18): 5843?5846.
[21]Cornillot E, Nair RV, Papoutsakis ET,et al. The genes for butanol and acetone formation inClostridium acetobutylicumATCC 824 reside on a large plasmid whose loss leads to degeneration of the strain.J Bacteriol, 1997,179(17): 5442?5447.
[22]Jiang Y, Xu C, Dong F,et al. Disruption of the acetoacetate decarboxylase gene in solvent-producingClostridium acetobutylicumincreases the butanol ratio.Metab Eng, 2009, 11(4/5): 284?291.
[23]Sillers R, Al-Hinai MA, Papoutsakis ET. Aldehydealcohol dehydrogenase and/or thiolase overexpression coupled with CoA transferase downregulation lead to higher alcohol titers and selectivity inClostridium acetobutylicumfermentations.Biotechnol Bioeng, 2009,102(1): 38?49.
[24]Sillers R, Chow A, Tracy B,et al. Metabolic engineering of the non-sporulating, non-solventogenicClostridium acetobutylicumstrain M5 to produce butanol without acetone demonstrate the robustness of the acid-formation pathways and the importance of the electron balance.Metab Eng, 2008, 10(6): 321?332.
[25]Gu Y, Hu S, Chen J,et al. Ammonium acetate enhances solvent production byClostridium acetobutylicumEA 2018 using cassava as a fermentation medium.J Ind Microbiol Biotechnol, 2009, 36(9): 1225?1232.
[26]Marchal R, Blanchet D, Vandecasteele JP. Industrial optimization of acetone-butanol fermentation - a study of the utilization of Jerusalem artichokes.Appl Microbiol Biotechnol, 1985, 23(2): 92?98.
[27]Qureshi N, Sahaa BC, Hector RE,et al. Butanol production from wheat straw by simultaneous saccharification and fermentation usingClostridium beijerinckii: Part I - Batch fermentation.Biomass Bioenerg, 2008, 32(2): 168?175.
[28]Qureshi N, Saha BC, Cotta MA. Butanol production from wheat straw by simultaneous saccharification and fermentation usingClostridium beijerinckii: Part II -Fed-batch fermentation.Biomass Bioenerg, 2008, 32(2):176?183.
[29]Qureshi N, Ezeji TC, Ebener J,et al. Butanol production byClostridium beijerinckii.Part I: use of acid and enzyme hydrolyzed corn fiber.Bioresour Technol, 2008, 99(13):5915?5922.
[30]Chen SW, Ma X, Wang LS,et al. Acetone-butanol fermentation of rice straw enzymatic hydrolysate.Ind Microbiol, 1998, 28(4): 30?34.陳守文, 馬昕, 汪履綏, 等.稻草酶法水解液的丙酮丁醇發酵.工業微生物, 1998, 28(4): 30?34.
[31]Li DM, Chen HZ. Fermentation of acetone and butanol coupled with enzymatic hydrolysis of steam exploded cornstalk stover in a membrane reactor.Chin J Process Eng, 2007, 7(6): 1212?1216.李冬敏, 陳洪章.汽爆秸稈膜循環酶解耦合丙酮丁醇發酵.過程工程學報, 2007, 7(6): 1212?1216.
[32]Ho NW, Chen Z, Brainard AP. Genetically engineeredSaccharomycesyeast capable of effective cofermentation of glucose and xylose.Appl Environ Microbiol, 1998,64(5): 1852?1859.
[33]Ounine K, Petitdemange H, Raval G,et al. Acetone-Butanol Production from Pentoses byClostridium acetobutylicum.Biotechnol Lett, 1983, 5(9): 605?610.
[34]Cynkin MA, Delwiche, EA. Metabolism of pentoses by clostridia.I.Enzymes of ribose dissimilation in extracts ofClostridium perfringens.J Bacteriol, 1958, 75(3): 331?334.
[35]Cynkin MA, Gibbs M. Metabolism of pentoses by clostridia.II.The fermentation of C14-labeled pentoses byClostridium perfringens,Clostridium beijerinckii, andClostridium butylicum.J Bacteriol, 1958, 75(3): 335?338.
[36]Nolling J, Breton G, Omelchenko MV,et al. Genome sequence and comparative analysis of the solventproducing bacteriumClostridium acetobutylicum.J Bacteriol, 2001, 183(16): 4823?4838.
[37]Heap JT, Pennington OJ, Cartman ST,et al. The ClosTron:a universal gene knock-out system for the genus Clostridium.J Microbiol Methods, 2007, 70(3): 452?464.
[38]Shao L, Hu S, Yang Y,et al. Targeted gene disruption by use of a group II intron(targetron)vector inClostridium acetobutylicum.Cell Res, 2007, 17(11): 963?965.
[39]Gu Y, Ding Y, Ren C,et al. Reconstruction of xylose utilization pathway and regulons in Firmicutes.BMC Genomics, 2010, 11(1): 255?268.
[40]Gu Y, Li J, Zhang L,et al. Improvement of xylose utilization inClostridium acetobutylicumvia expression of thetalAgene encoding transaldolase fromEscherichia coli.J Biotechnol, 2009, 143(4): 284?287.
[41]Gorke B, Stulke J. Carbon catabolite repression in bacteria: many ways to make the most out of nutrients.Nat Rev Microbiol, 2008, 6(8): 613?624.
[42]Mitchell WJ. Physiology of carbohydrate to solvent conversion by clostridia.Adv Microb Physiol, 1998, 39:31?130.
[43]Kim JH, Guvener ZT, Cho JY,et al. Specificity of DNA binding activity of theBacillus subtiliscatabolite control protein CcpA.J Bacteriol, 1995, 177(17): 5129?5134.
[44]Tangney M, Galinier A, Deutscher J,et al. Analysis of the elements of catabolite repression inClostridium acetobutylicumATCC 824.J Mol Microbiol Biotechnol,2003, 6(1): 6?11.
[45]Ren C, Gu Y, Hu S,et al. Identification and inactivation of pleiotropic regulator CcpA to eliminate glucose repression of xylose utilization inClostridium acetobutylicum.Metab Eng, 2010, doi:10.1016/j.ymben.2010.05.002.
[46]Henstra AM, Sipma J, Rinzema A,et al. Microbiology of synthesis gas fermentation for biofuel production.Curr Opin Biotechnol, 2007, 18(3): 200?206.
[47]Phillips JR, Klasson KT, Clausen EC,et al. Biological production of ethanol from coal synthesis gas-medium development studies.Appl Biochem Biotechnol, 1993, 39:559?571.
[48]Liou JSC, Balkwill DL, Drake GR,et al.Clostridium carboxidivoranssp.nov., a solvent-producing clostridium isolated from an agricultural settling lagoon, and reclassification of the acetogenClostridium scatologenesstrain SL1 asClostridium drakeisp.nov.Int J Syst Evol Microbiol, 2005, 55: 2085?2091.
[49]Grethlein AJ, Jain MK. Bioprocessing of coal-derived synthesis gases by anaerobic-bacteria.Trends Biotechnol,1992, 10(12): 418?423.
[50]Glassner DA, JM Datta R. Process for the fermentative production of acetone, butanol and ethanol: US, 5063156.1991-11-05.
[51]Zheng YN, Li LZ, Xian M,et al. Problems with the microbial production of butanol.J Ind Microbiol Biotechnol, 2009, 36(9): 1127?1138.
[52]Ezeji TC, Qureshi N, Blaschek HP. Acetone butanol ethanol(ABE)production from concentrated substrate:reduction in substrate inhibition by fed-batch technique and product inhibition by gas stripping.Appl Microbiol Biotechnol, 2004, 63(6): 653?658.
[53]Jones DT, Woods DR. Acetone-butanol fermentation revisited.Microbiol Rev, 1986, 50(4): 484?524.
[54]Tomas CA, Beamish J, Papoutsakis ET. Transcriptional analysis of butanol stress and tolerance inClostridium acetobutylicum.J Bacteriol, 2004, 186(7): 2006?2018.
[55]Knoshaug EP, Zhang M. Butanol tolerance in a selection of microorganisms.Appl Biochem Biotechnol, 2009,153(1/3): 13?20.
[56]Li J, Zhao JB, Zhao M,et al. Screening and characterization of butanol-tolerant micro-organisms.Lett Appl Microbiol, 2010, 50(4): 373?379.
[57]Atsumi S, Cann AF, Connor MR,et al. Metabolic engineering ofEscherichia colifor 1-butanol production.Metab Eng, 2008, 10(6): 305?311.
[58]Inui M, Suda M, Kimura S,et al. Expression ofClostridium acetobutylicumbutanol synthetic genes inEscherichia coli.Appl Microbiol Biotechnol, 2008, 77(6):1305?1316.
[59]Steen EJ, Chan R, Prasad N,et al. Metabolic engineering ofSaccharomyces cerevisiaefor the production of n-butanol.Microb Cell Fact, 2008, 7: 36?43.
[60]Nielsen DR, Leonard E, Yoon SH,et al. Engineering alternative butanol production platforms in heterologous bacteria.Metab Eng, 2009, 11(4/5): 262?273.
[61]Berezina OV, Zakharova NV, Brandt A,et al. Reconstructing the clostridial n-butanol metabolic pathway inLactobacillus brevis.Appl Microbiol Biotechnol, 2010,87(2): 635?646.
Current status and prospects of biobutanol manufacturing technology
Yang Gu1, Yu Jiang1,2, Hui Wu1, Xudong Liu1, Zhilin Li1, Jian Li1, Han Xiao1, Zhaobing Shen2,Jingbo Zhao1, Yunliu Yang1, Weihong Jiang1,2, and Sheng Yang1,2
1 Institute of Plant Physiology and Ecology, Shanghai Institutes for Biological Sciences, Chinese Academy of Sciences, Shanghai 200032, China 2 Shanghai Research and Development Center of Industrial Biotechnology, Shanghai 201201, China
Received:May 14, 2010;Accepted:June 23, 2010
Supported by:National Basic Research Program of China(973 Program)(No.2007CB707803), National High Technology Research and Development Program of China(863 Program)(No.2007AA05Z407), Knowledge Innovation Program of the Chinese Academy of Sciences(No.KSCX2-YW-G-075),Planned Scientific Program of Science and Technology Commission of Shanghai Municipality(No.08dz1207100).
Corresponding author:Weihong Jiang.Tel: +86-21-54924172; Fax: +86-21-54924015; E-mail: whjiang@sibs.ac.cn Sheng Yang.Tel: +86-21-54924173; Fax: +86-21-54924015; E-mail: syang@sibs.ac.cn國家重點基礎研究發展計劃(973計劃)(No.2007CB707803),國家高技術研究發展計劃(863計劃)(No.2007AA05Z407),中科院知識創新工程重要方向項目(No.KSCX2-YW-G-075),上海市科委科研計劃項目(No.08dz1207100)資助。

