茄子ISSR-PCR反應體系優化及驗證
梁任繁 王益奎 李文嘉 黎 炎 吳永官
(1廣西農業科學院蔬菜研究所,廣西南寧 530007;2廣西大學農學院,廣西南寧 530004)
茄子ISSR-PCR反應體系優化及驗證
梁任繁1,2王益奎1李文嘉1黎 炎1吳永官1
(1廣西農業科學院蔬菜研究所,廣西南寧 530007;2廣西大學農學院,廣西南寧 530004)
以茄子為試驗材料,采用改良 CTAB法提取茄子嫩葉總 DNA,結合單因素設計和正交設計L9(34)的優點,探討Mg2+、dNTP、引物及Taq DNA聚合酶等因素對茄子ISSR-PCR反應體系的影響,利用16份廣西茄子主要栽培品種對最優處理組合進行驗證。結果表明,在25 μL反應體系中,含2.5 μL10×buffer、2.0~3.0 mmol·L-1Mg2+、0.32~0.36 mmol·L-1dNTP、0.4 μmol·L-1引物、50 ng 模板 DNA、0.6 U Taq DNA聚合酶等成分,可以獲得比較穩定、清晰和豐富的條帶。
茄子;優化;ISSR;驗證
茄子(Solanum melongena L.)是我國栽培較廣的茄果類蔬菜之一,目前在生產上推廣種植的品種很多,但品種間形態差異較小,同物異名、同名異物現象非常嚴重,亟須進行科學鑒定研究。簡單序列重復間擴增多態性(Inter-Simple Sequence Repeats,ISSR)是Zietkiewicz等于1994年在SSR基礎上建立起來的新型分子標記技術(陳大霞 等,2006),近幾年在苦瓜(王緒 等,2007)、辣椒(楊若林 等,2005)等作物上得到了廣泛應用。
ISSR作為基于PCR的一種分子標記,易受Mg2+、dNTP、引物、Taq DNA聚合酶、模板DNA等因素的干擾,其最佳擴增條件在不同物種可能有所不同(Yu et al.,2006)。目前,在眾多的ISSR優化實驗中,研究者多采用單因素試驗,雖然優化的結果比較明確簡潔,但容易忽視各個因素之間的交互作用;相反正交設計可彌補上述的不足,它具有均衡分散和整齊可比的特點,能通過有限的試驗找出最佳組合條件;而且有關茄子ISSR反應體系優化的研究目前報道不多。
本試驗結合單因素試驗和正交試驗兩個方案的優點,對茄子 ISSR反應體系進行全面優化和實際驗證,旨在建立一個可靠性和重復性都比較高的反應體系,為我國茄子種質的分子鑒定、遺傳多樣性等研究提供理論參考。
1 材料與方法
1.1 供試材料
供試茄子材料共16份,收集自廣西各地主要栽培品種(表1)。茄子種子經催芽育苗后,2010年2月16日定植于廣西農業科學院蔬菜研究所試驗基地。在5~6葉期,分批次采剪植株新鮮幼嫩葉片,在低溫條件下帶回實驗室,用70 %乙醇清洗表面,用無菌去離子水沖洗干凈,再用潔凈濾紙吸干后提取總DNA。
1.2 試驗方法
1.2.1 DNA提取與純化 采用改良的CTAB法提取基因組總DNA(杜黎明 等,2007),用1 %瓊脂糖凝膠電泳檢測DNA質量(圖1),DNA的純度和濃度用Eppendorf Biophotometer濃度電度測定儀測定OD值,并將其濃度統一稀釋為50 ng·μL-1,保存在-20 ℃冰箱中備用。
1.2.2 單因素優化方案 采用單因素試驗,對影響擴增的dNTP、Mg2+設置了10個不同梯度處理(表2),其他參數見基本反應體系。
1.2.3 互作效應的優化設計及驗證 采用L9(34)正交試驗設計,對dNTP濃度、引物濃度、Mg2+濃度、TaqDNA聚合酶濃度等進行4個因素3個水平篩選優化試驗,共9個處理(表3)。再以廣西栽培的16份茄子為材料,對最佳處理進行實際驗證。
1.2.4 基本擴增體系及反應程序 PCR反應在 Bio-RAD(Icycler-PCR)上進行。初步確定PCR反應體系為25 μL,ISSR基本反應體系:Taq酶(5 U·μL-1)0.4 μL、10×buffer2.5 μL(無 Mg2+)、25 mmol·L-1Mg2+2.5 μL、10 mmol·L-1dNTP1.0 μL、10 mmol·L-1引物1.0 μL、DNA模板50 ng,具體成分按不同設計方案進行,最后用無菌超純水補足至25 μL。反應基本程序:95 ℃預變性5 min,共40個循環,每個循環95 ℃變性45 s,50 ℃退火45 s,72 ℃延伸1 min,循環結束后72 ℃延伸7 min,10 ℃保存。
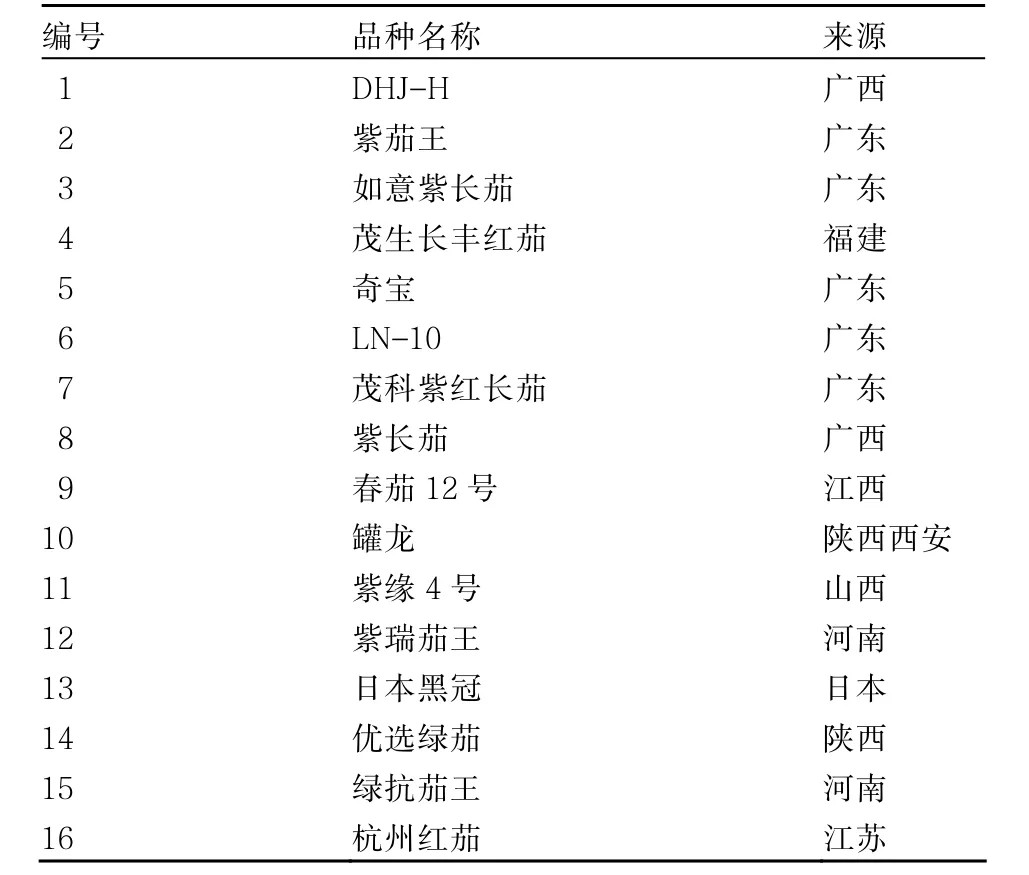
表1 試驗材料及來源地
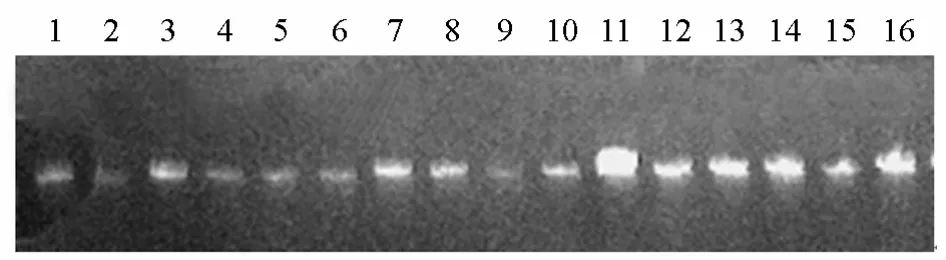
圖1 DNA質量檢測
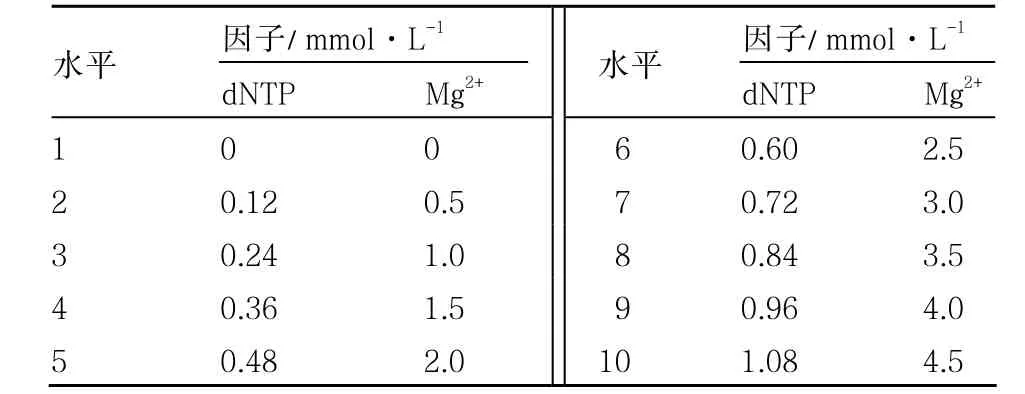
表2 影響擴增的主要因子
1.2.5 引物及數據處理 各試驗方案均以ISSR827(5’-ACACACACACAC ACACG-3’)為引物,引物根據加拿大哥倫比亞大學(UBC)公布的序列設計,由上海恒因生物技術有限公司合成。其PCR擴增產物用1.5 %瓊脂糖凝膠電泳檢測,在5 mg·L-1EB染色10~15 min。電泳緩沖液為1.0×TAE,用DL5000 bp DNA梯度作為標準分子量參照物,在電場強度5 V·cm-1電泳15~20 min,電泳結果于Fujifilm pharmcia Biotech凝膠成像分析系統拍照保存。
采用0和1系統記錄譜帶位置,在相同遷移位置強重復出現的帶記為“1”,不重復出現弱帶或無帶記為“0”,利用SPSS10.0統計軟件對驗證凝膠圖像進行系統聚類分析。
2 結果與分析
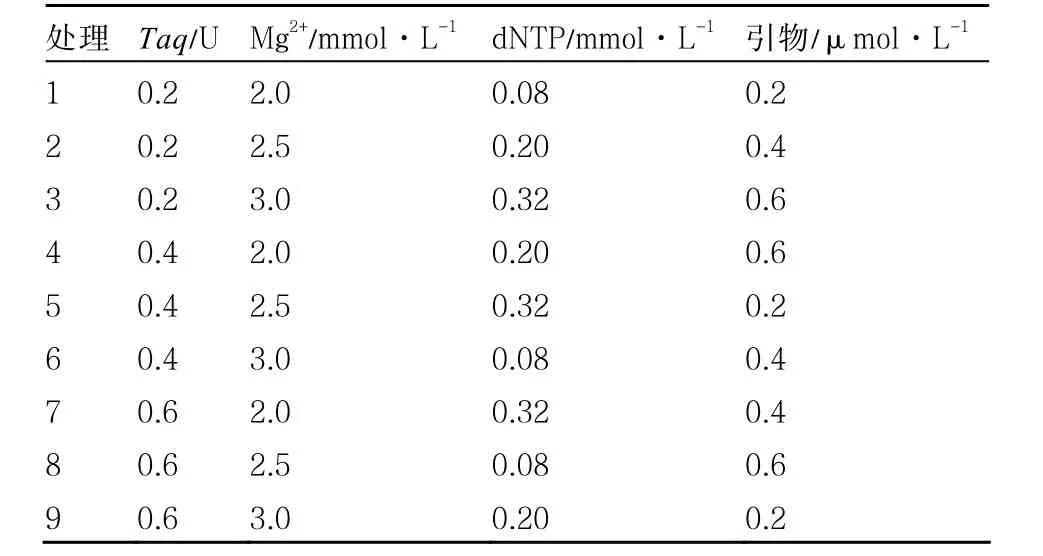
表3 PCR正交試驗設計表
2.1 單因素優化
由圖2可知,Mg2+對擴增的影響很大。在0~0.5 mmol·L-1間,一片模糊,基本沒有條帶;當濃度大于1.0 mmol·L-1時,開始出現條帶,但條帶很弱,可隨著Mg2+濃度增加,不斷地擴增出較多條帶,彌散、條帶缺失等現象也逐漸消失,當濃度達到3.0 mmol·L-1時,其條帶質量達到最清晰、最穩定,亮度最適宜,大于3.0 mmol·L-1時又逐漸出現條帶彌散、缺失等現象。因此,Mg2+濃度為3.0 mmol·L-1時,反應體系PCR擴增效果最好。
由圖3可知,dNTP對擴增的影響也很大。在0 mmol·L-1時,不能擴增出條帶;隨著dNTP濃度增加,條帶質量逐漸變好,直到dNTP濃度為0.36 mmol·L-1時,其條帶效果最好,大于0.36 mmol·L-1時條帶質量又逐漸變差,直至不能擴增出條帶。因此,本試驗 dNTP最佳濃度為0.36 mmol·L-1)。
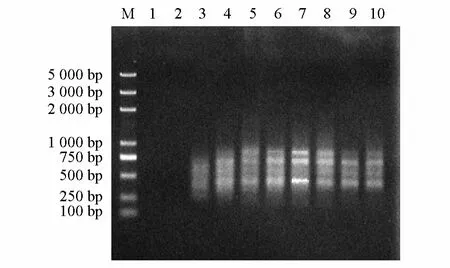
圖2 Mg2+對ISSR-PCR的影響
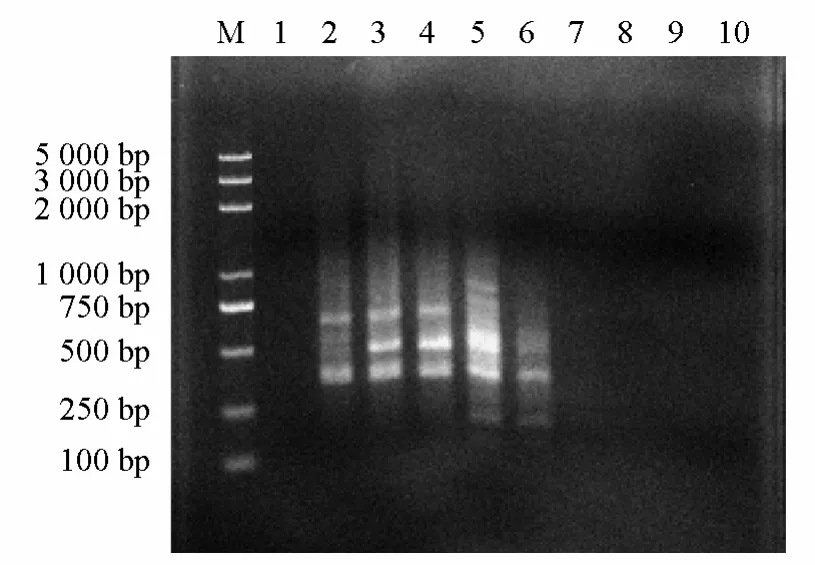
圖3 dNTP對ISSR-PCR的影響
2.2 互作效應優化
圖4所示,L9(34)正交試驗設計的每個處理均能擴增出條帶,但是它們在條帶數目、清晰度和彌散程度等方面有所不同。例如,第2個處理僅擴增出1條比較弱的帶,且分子量偏低;第1、3、4處理均擴增出3條帶,但都是弱帶;第5個處理擴增出5條帶,但處于小分子量的帶都為偏弱帶,部分有彌散;第6個處理也擴增出5條帶,但處于小分子量和大分子量之間的帶都為偏弱帶,部分有彌散;第7、8個處理均擴增出6條帶,也是出現條帶比較多的處理,其中第7處理在小分子量或大分子量處均有清晰高亮的帶;第9個處理擴增出的條帶最多,但只有在大分子量處有2條亮帶,其他均為弱帶且有彌散現象。綜上所述,第7個處理為最佳處理,其組合為:Taq(0.6 U)、Mg2+(2.0 mmol·L-1)、dNTP(0.32 mmol·L-1)、引物(0.4 μmol·L-1)。
2.3 最佳組合的驗證
圖5為最佳處理16份茄子材料實際驗證的電泳凝膠圖像。從圖5可知,最佳處理能夠對茄子擴增出比較豐富、清晰和穩定的條帶,且分子量一般都低于2000 bp。
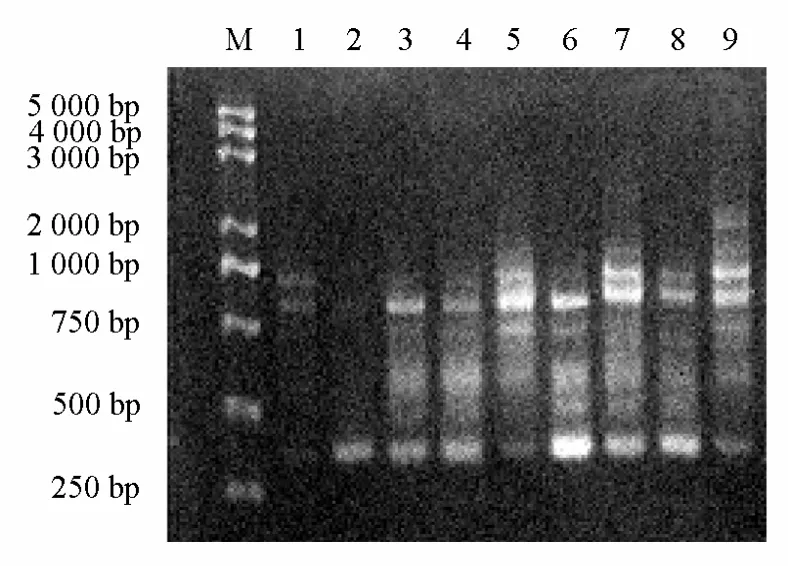
圖4 L9(34)不同處理對ISSR-PCR的影響
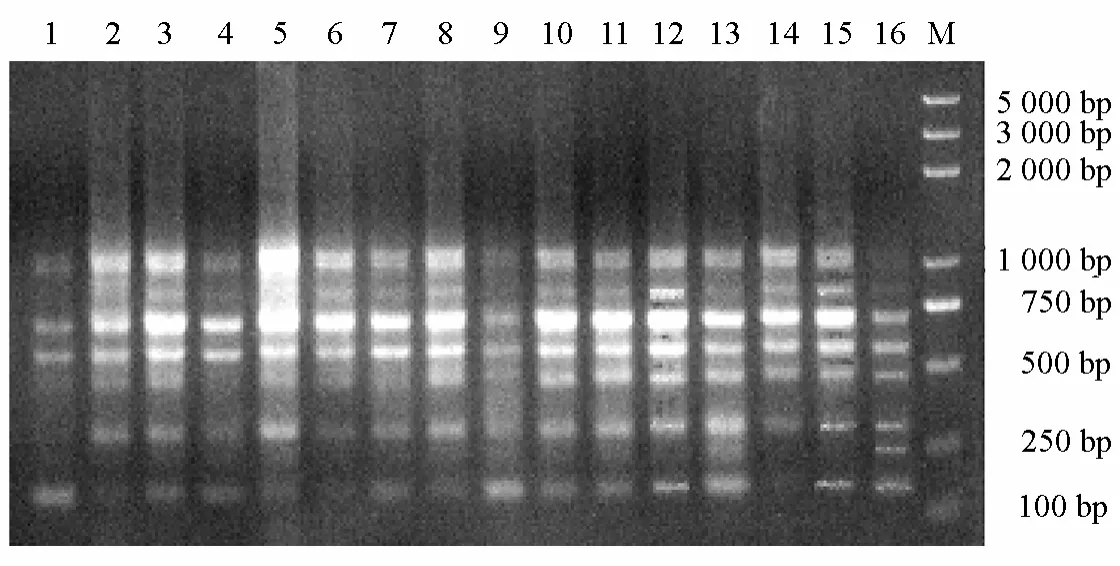
? 圖5 最優處理的驗證
對驗證凝膠圖像進行多態性和系統聚類分析。結果表明,ISSR827引物可檢測到8個等位變異點,多態性的條帶數為5,引物等位位點多態性為62.5 %,符合一般高等植物種間的多態性小于70 %的規律(周延清 等,2008);從16份材料聚類結果可知(圖6),在歐氏距離7~10之間可分為4大類茄子,第1 類包括12、15、3、10、11、5、8、9、4、7、2、14、6,其余13、1、16分別為第2、3、4類。同一類群包括不同地方的品種,而同一地方的不同品種并沒有首先聚在一起,而且參試品種間的遺傳距離多數表現在5以下,說明廣西茄子栽培種來源地盡管很多,但它們多為相近品種,其遺傳基礎相對較狹窄,也反映了我國各地區之間茄子種質資源交流頻繁。
3 結論與討論
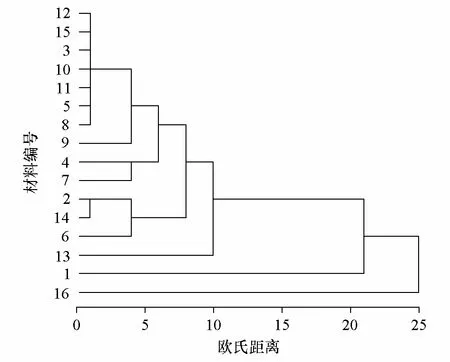
圖6 ISSR分子標記聚類圖
綜合上述單因素和正交試驗,在茄子ISSR反應體系中,Mg2+、dNTP兩者的濃度以2.0~3.0 mmol·L-1和0.32~0.36 mmol·L-1為宜,過低或過高都不利于ISSR擴增,這與桂騰琴等(2009)、張文標等(2006)研究結果一致。主要原因為Mg2+是TaqDNA聚合酶的激活劑,其濃度不僅影響酶的活性及合成的可靠性,而且還影響引物與模板的結合效率,Mg2+濃度過低會使Taq酶的作用效率低,擴增效率下降,甚至不能擴增出譜帶;Mg2+濃度過高,容易生成非特異性擴增產物,使背景加強。同理,dNTP濃度過低,分子中的磷酸基團能定量地與Mg2+結合,使實際反應中Mg2+濃度下降而影響聚合酶的活力,從而降低PCR產物的產量;dNTP濃度過高則加快反應速度,增加堿基的錯誤摻入率,從而會出現非特異性擴增,且dNTP也能與Mg2+結合,濃度過高對Mg2+產生抑制作用,使游離的Mg2+濃度降低(林萍 等,2005;佟漢文 等,2005;王瑜和袁慶華,2007;李嶸和王喆之,2008;黃宇 等,2009)。
Taq DNA聚合酶、引物濃度對PCR擴增影響也很大。袁德義等(2008)、劉婷等(2009)認為TaqDNA聚合酶、引物適宜濃度一般為0.5~5.0 U和0.1~0.5 μmol·L-1,本試驗正交設計所得最佳處理的濃度也處于該范圍內,且分別與毛偉海等(2006)、張濤等(2009)研究我國茄子種質資源的ISSR標記分析所選濃度基本一致。相反,濃度過低或過高有可能產生擴增失敗。因為酶濃度過高,不僅增加實驗成本,而且易引起非特異性擴增,導致背景彌散;酶濃度過低,則無擴增產物或產物不穩定(李嶸和王喆之,2008);引物濃度過低時,不能進行有效的擴增,從而造成擴增產物少;而引物濃度過高時,易引起堿基錯配和產生非特異性擴增,還易形成引物二聚體,產生彌散背景(佟漢文 等,2005;李嶸和王喆之,2008;劉婷 等,2009)。
同時,本試驗獲得優化 ISSR反應體系方案,經驗證基本達到條帶穩定可靠、清晰豐富的要求,其為茄子品種鑒定、親緣關系分析和優良新品種選育等研究提供科學依據。
陳大霞,錢敏,李隆云,瞿顯友.2006.正交試驗優化黃連ISSR反應體系的研究.重慶中草藥研究,(2):4-7.
杜黎明,毛偉海,包崇來,胡天華,朱琴妹,胡海嬌.2007.茄子基因組DNA提取及ISSR-PCR反應體系優化.農業生物技術學報,15(4):723-724.
桂騰琴,孫敏,喬愛民,王心燕.2009.正交設計優化果梅ISSR反應體系.果樹學報,26(1):108-112.
黃宇,陳禮光,夏海濤,榮俊冬,孔玲,廖鵬輝,鄭郁善.2009.福建含笑ISSR-PCR反應體系的建立與優化.福建林學院學報,29(2):97-102.
林萍,張含國,謝運海.2005.正交設計優化落葉松ISSR-PCR反應體系.生物技術,15(5):34-37.
李嶸,王喆之.2008.丹參ISSR-PCR反應體系的建立與正交優化.廣西植物,28(5):599-603.
劉婷,湯青林,王志敏,宋明,張敏.2009.正交設計優化芥菜ISSR反應體系研究.西南師范大學學報:自然科學版,34(1):115-118.
毛偉海,杜黎明,包崇來,胡天華,朱琴妹,胡海嬌.2006.我國南方長茄種質資源的 ISSR標記分析.園藝學報,33(5):1109-1112.
佟漢文,孫群,吳波,丁自勉,孫寶啟,王建華.2005.烏拉爾甘草ISSR-PCR反應體系優化研究.中國農學通報,21(4):70-74.
王緒,鄧儉英,方鋒學,張曼,張玲玲,孫德利.2007.苦瓜ISSR-PCR反應體系的建立.種子,26(1):15-18.
王瑜,袁慶華.2007.紫花苜蓿ISSR-PCR反應體系的建立與優化.草地學報,15(3):212-215.
楊若林,孔俊,吳鑫,鄧志瑞,陳沁,劉文軒.2005.ISSR標記在辣椒資源遺傳多態性分析中的初步應用.上海大學學報:自然科學版,11(4):423-426.
袁德義,何小勇,莫文娟,練發良,張琳.2008.朱砂根ISSR反應體系的建立與優化.浙江林業科技,28(4):60-62.
張濤,陳兆貴,何秀云,曾秀文.2009.茄子ISSR分子標記技術初步研究.廣東農業科學,(1):42-44.
張文標,金則新,李鈞敏,潘冠瓊.2006.甜櫧ISSR-PCR反應體系的正交優化.浙江林學院學報,23(5):516-520.
周延清,楊清香,張改娜.2008.生物遺傳標記與應用.北京:化學工業出版社:260.
Yu Z D,Liu X Y,Cao Z M.2006.ISSR marker and ITS sequence study of Melampsora larici-populina.Agricultural Sciences in China,5(11):847-854.
Optimization and Verification of ISSR Reaction System of Eggplant
LIANG Ren-fan1,2, WANG Yi-kui1, LI Wen-jia1, LI Yan1, WU Yong-guan1
(1Institute of Vegetable, Guangxi Academy of Agricultural Sciences, Nanning530007, Guangxi, China; 2College of Agronomy,Guangxi University, Nanning530004 , Guangxi, China)
In this study, eggplant(Solanum melongena L.)was the test material. The total DNA was extracted from its fresh young leaves by modified CTAB method. The advantage of orthogonal design and single factor design were applied to optimize ISSR-PCR amplification system of eggplant in4 factors,such as Mg2+, dNTP, primer and Taq DNA polymerase at3 levels, and the optimal treatment was verified by16 cultivate eggplants fromguangxi. The results indicated that an optimal reaction system(25 μL)was established. It was consisted of2.5 μL10×buffer,2.0-3.0 mmol·L-1Mg2+,0.32-0.36 mmol·L-1dNTPs,0.4 μmol·L-1primer,50 ng template DNA,0.6 U Taq DNA polymerase. The sore band of the optimized treatment showed stabilization, distinct and abundant.
Eggplant; Optimization; ISSR; Verification
S641.5
A
1000-6346(2010)24-0048-05
2010-07-01;接受日期:2010-09-25
桂科能(0815011-6-1-16),院科技發展基金(2007009)
梁任繁,男,博士研究生,專業方向:作物栽培與分子生物學,E-mail:gxnkylrf@163.com

