人工老化芥菜種子基因組DNA的ISSR標(biāo)記
宋 明 王鶴冰 孫梓健 王志敏 湯青林 張 生
(1西南大學(xué)園藝園林學(xué)院,南方山地園藝學(xué)教育部重點(diǎn)實(shí)驗(yàn)室,重慶市蔬菜學(xué)重點(diǎn)實(shí)驗(yàn)室,重慶 400715;2重慶市農(nóng)業(yè)科學(xué)院生物工程中心,重慶 400055)
人工老化芥菜種子基因組DNA的ISSR標(biāo)記
宋 明1王鶴冰1孫梓健1王志敏1湯青林1張 生2
(1西南大學(xué)園藝園林學(xué)院,南方山地園藝學(xué)教育部重點(diǎn)實(shí)驗(yàn)室,重慶市蔬菜學(xué)重點(diǎn)實(shí)驗(yàn)室,重慶 400715;2重慶市農(nóng)業(yè)科學(xué)院生物工程中心,重慶 400055)
應(yīng)用ISSR分子標(biāo)記對人工老化的芥菜種子進(jìn)行DNA損傷程度的分析,從18條ISSR引物中選出6條適用于老化芥菜種子的研究分析,并發(fā)現(xiàn)人工老化處理的芥菜種子隨著老化時間的延長,ISSR擴(kuò)增出的條帶減少、顏色變淺甚至消失,表明在種子貯藏中,隨著老化程度的加劇,DNA破損是影響種質(zhì)資源保存的因素之一。
芥菜;人工老化;DNA;ISSR
芥菜(Brassica junceaCoss.)是十字花科蕓薹屬的重要作物,我國栽培歷史悠久,品種資源豐富,在世界芥菜資源中占有重要地位。基于此,研究芥菜種子老化對保持我國芥菜種質(zhì)資源多樣性具有重要意義(劉佩瑛,1996)。我國已對多種蔬菜種子如大白菜(唐祖君和宋明,1999)、芥藍(lán)(陸美蓮 等,2004)等進(jìn)行了種子老化方面的相關(guān)研究,但對芥菜種子的研究卻較少,僅董新紅(2003)對其進(jìn)行過老化機(jī)理的基礎(chǔ)探討。
本試驗(yàn)采用多個常規(guī)芥菜品種為試驗(yàn)材料,用人工加速老化的方法模擬種子自然老化過程,從不同老化程度的芥菜干種子中提取DNA,用ISSR分子標(biāo)記對老化種子的DNA損傷程度進(jìn)行分析,總結(jié)出芥菜干種子不同老化程度的ISSR譜帶的差異性,以期為芥菜種子在貯藏和保存中老化程度的鑒定提供分子生物學(xué)方面的參考依據(jù)。
1 材料與方法
1.1 試驗(yàn)材料
以6個芥菜栽培品種(重慶市種子公司蔬菜分公司提供)為試驗(yàn)材料,所有種子均為當(dāng)年采收,通過前期預(yù)備試驗(yàn)檢測,種子發(fā)芽率均在85 %以上。所用材料包括根芥、莖芥、葉芥,代表了芥菜的不同類型。試驗(yàn)于2008~2009年在西南大學(xué)重慶市蔬菜學(xué)重點(diǎn)實(shí)驗(yàn)室進(jìn)行。6種供試材料及植物學(xué)分類見表1。
1.2 試驗(yàn)方法
1.2.1 種子人工老化 參照鄭曉鷹和任祝三(1982)的種子人工老化方法,將芥菜種子置于40℃、濕度100 %的條件下分別進(jìn)行0、2、4、6、8 d的老化處理,獲得不同老化程度的種子,即處理1、處理2、處理3、處理4、處理5。取出后在陰涼條件下室溫干燥到原始含水量后備用。為防止種子在老化處理過程中發(fā)生霉變,影響老化結(jié)果,試驗(yàn)前所用器皿和種子都進(jìn)行了周密的消毒處理(器皿用酒精清洗,擦拭消毒;種子用10 %的NaClO浸泡10 min消毒)。
1.2.2 不同老化程度種子基因組DNA的提取方法比較 損傷的DNA在種子吸脹后會得到不同程度的修復(fù),只有在干種子狀態(tài)下才能最大限度地保存 DNA的受損狀態(tài)。因此,要研究種子劣變過程中DNA的損傷程度就必須從干種子中提取基因組DNA(喬愛民和傅家瑞,1999),并且進(jìn)行ISSR分子標(biāo)記研究,模板DNA的質(zhì)量與檢測結(jié)果的準(zhǔn)確性直接相關(guān)。由于芥菜干種子中含有大量多糖、脂肪等次生代謝物質(zhì),給干種子DNA的提取帶來一定難度。
本試驗(yàn)用4種DNA提取方法對芥菜干種子DNA提取進(jìn)行比較,并對較好的改良CTAB法作進(jìn)一步改進(jìn)。DNA提取后用1 %瓊脂糖凝膠電泳檢測,并在紫外分光光度計(jì)下檢測其濃度后稀釋至40 ng·μL-1,置于-20 ℃冰箱備用。
① CTAB法。參照奧斯伯等(1998)的CTAB提取法。
② 改良CTAB法。參照Rogers和Bendich(1985)的改良CTAB法提取芥菜干種子DNA。③ SDS法。參照楊少輝等(2003)的方法。
④ 改良CTAB法的改進(jìn)。對改良CTAB法進(jìn)行了以下改動:抽提液氯仿︰異戊醇=24V︰1V改為酚︰氯仿︰異戊醇=25V︰24V︰1V,在抽提過程中將抽提1次改為3次,核酸沉降用預(yù)冷的2/3體積的異丙醇和1/10體積的乙酸鈉(pH為5.2)進(jìn)行,并在DNA溶解時加入1 μL RNA水解酶消除RNA的干擾,得到改良CTAB-Ⅰ法。1.2.3 ISSR-PCR反應(yīng)體系的確立 所用引物參照加拿大哥倫比亞大學(xué)(UBC)公布的第9套ISSR標(biāo)準(zhǔn)引物序列(周延清,2005),并參考劉婷等(2009)的研究,由上海生工生物工程技術(shù)服務(wù)有限公司合成。PCR擴(kuò)增反應(yīng)在Eppendorf型Mastercycler Gradient PCR儀上進(jìn)行。

表1 供試材料基本信息
參照劉婷等(2009)建立的芥菜 ISSR反應(yīng)體系,根據(jù)所用藥品的不同,確立反應(yīng)體系中各成分的量。反應(yīng)總體積20 μL:dNTPs0.15 mmol·L-1,引物10 pmol·μL-1,DNA模板40 ng,EasyTaqDNA聚合酶1 U,加Mg2+的10×PCR buffer2 μL,其他體積用無菌雙蒸水補(bǔ)充。
PCR擴(kuò)增程序:94 ℃預(yù)變性5 min,94 ℃變性1 min,53 ℃復(fù)性45 s,72 ℃延伸1.5 min,循環(huán)35次;72 ℃延伸10 min,4 ℃保存。
PCR擴(kuò)增產(chǎn)物在2.0 %瓊脂糖凝膠上5.5 V·cm-1電壓下電泳30 min進(jìn)行檢測,凝膠成像系統(tǒng)照相并記錄。
2 結(jié)果與分析
2.1 芥菜種子人工老化后種子活力的變化
種子隨著老化處理時間的延長,發(fā)芽率和活力指數(shù)均發(fā)生很大的變化。從表2看出,人工老化處理后芥菜種子的發(fā)芽率及活力指數(shù)均隨老化處理時間的延長呈下降趨勢。品種間下降速度存在差異。
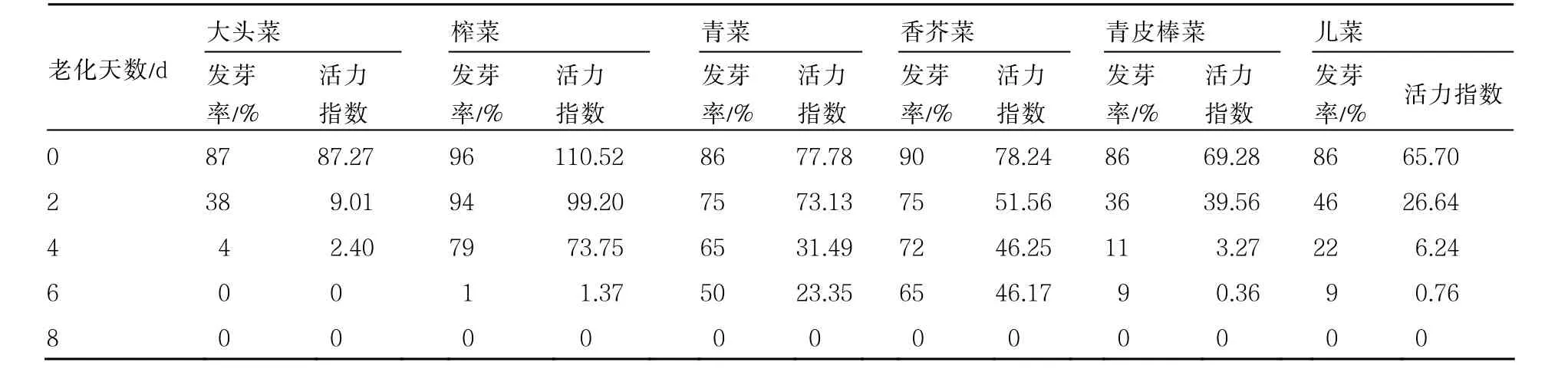
表2 老化處理后芥菜種子發(fā)芽率和活力指數(shù)的變化
2.2 芥菜干種子不同DNA提取方法的比較
幾種方法提取干種子DNA后進(jìn)行DNA質(zhì)量檢測比較,得出改良CTBA-Ⅰ法最適宜芥菜干種子DNA的提取,提取的DNA質(zhì)量高,雜質(zhì)少,各老化處理的芥菜干種子樣品得到的DNA濃度均勻(圖1)。但隨著種子老化程度的加劇,提取的 DNA樣品也有一定的降解,并且分子量的大小和總濃度有所降低,這與Shatters等(1995)和Kalpana等(1997)的研究結(jié)果基本一致。
2.3 不同引物的篩選
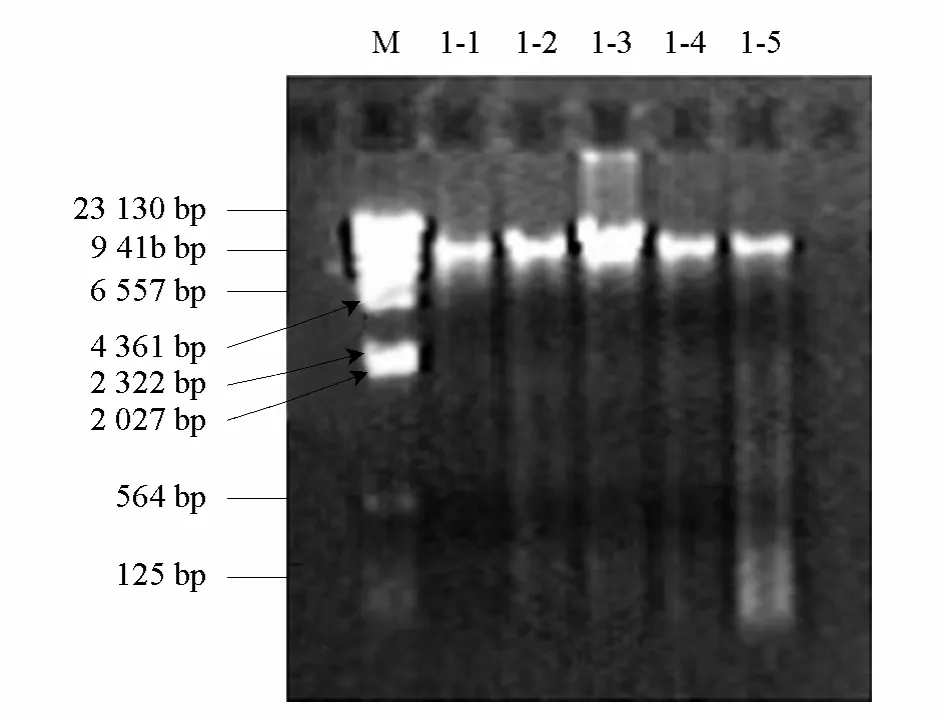
圖1 改良CTAB-Ⅰ法提取DNA電泳圖
運(yùn)用 ISSR標(biāo)記技術(shù)時,每個引物并不會適合于所有物種,并且不同引物所要求的反應(yīng)條件也不同,因此對引物的篩選和反應(yīng)條件的優(yōu)化是非常必要的。篩選出多態(tài)性強(qiáng)、可重復(fù)性好的引物是整個試驗(yàn)成功的關(guān)鍵(余艷 等,2003)。本試驗(yàn)對宋明等(2009)在芥菜遺傳多樣性ISSR分析中篩選出的18條引物作進(jìn)一步分析,應(yīng)用1號品種(大頭菜)進(jìn)行引物特異性篩選,以譜帶的清晰度、豐富度為依據(jù),選出6條適宜芥菜種子老化鑒別的引物,分別為 U809、U810、U817、U859、U880、U891(表3)。
2.4 ISSR標(biāo)記對種子老化程度的分析
對經(jīng)高溫高濕人工老化處理所得的不同老化程度芥菜干種子DNA進(jìn)行ISSR-PCR擴(kuò)增,部分引物擴(kuò)增結(jié)果如圖2、3、4所示。
從圖2、3、4中可以看出:同一條引物不能反映出所有品種的老化程度,而能反映種子老化程度的引物表現(xiàn)出隨著種子老化程度的加深,擴(kuò)增產(chǎn)物的條帶逐漸減少或顏色變淺,有些品種的條帶甚至完全消失,并且不同引物所反映的同一品種老化程度不同,條帶有很大差異。引物U810可以對1、3、5號3個芥菜品種種子的老化程度加以區(qū)別,引物 U859可以對1、3、4號3個芥菜品種種子的老化程度加以區(qū)別,引物 U891可以對2、3、4、5號4個芥菜品種種子的老化程度加以區(qū)別。
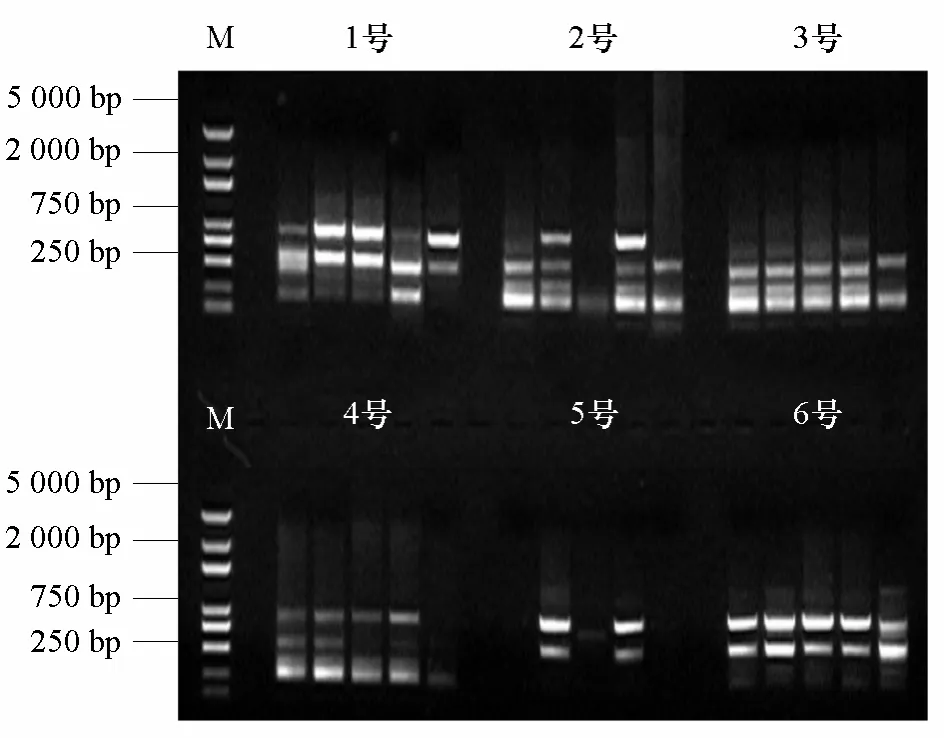
圖3 引物U859在人工老化種子上的ISSR指紋圖譜M,Trans2k Plus DNA marker。

表3 ISSR篩選引物序列表

圖2 引物U810在人工老化種子上的ISSR指紋圖譜
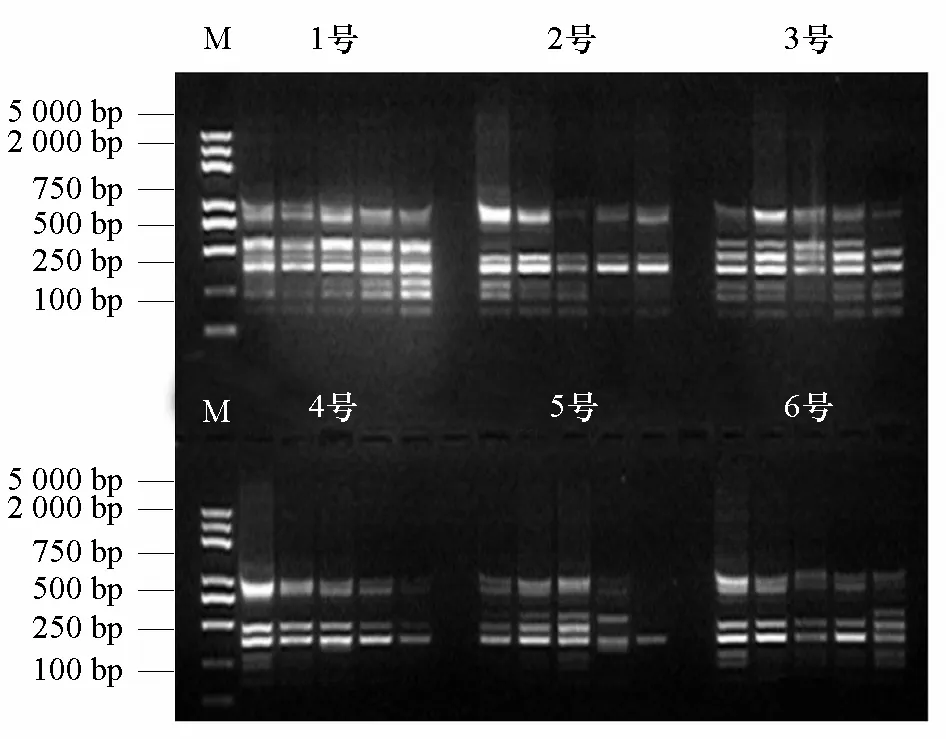
圖4 引物U891在人工老化種子上的ISSR指紋圖譜 M:Trans2k Plus DNA marker。
對ISSR標(biāo)記的引物擴(kuò)增圖譜中的條帶數(shù)進(jìn)行統(tǒng)計(jì),得到表4。從表4中可以明顯看出:不同引物擴(kuò)增出的條帶數(shù)差異很大,2~9條不等;并且同一引物不同品種間的條帶數(shù)也不同。
U810、U859、U891引物的擴(kuò)增條帶數(shù)變化都可以說明3號芥菜品種的人工老化種子變化情況,因而以此為例進(jìn)行分析。從表2的種子活力可知3號(青菜)的種子活力前期降低較慢,而條帶數(shù)的變化也反映出這樣的規(guī)律,U810引物擴(kuò)增的條帶數(shù)前期并無變化,老化6 d才開始減少,引物U859和U891擴(kuò)增的條帶數(shù)也是隨種子老化的加劇后期逐漸減少。
從條帶數(shù)的變化可以明顯看出,同一條引物并不能反映所有品種的老化程度。如引物U810可以表明1、3、5號品種的老化程度,條帶數(shù)隨老化時間加長逐漸減少,但對于2、6號品種卻表現(xiàn)出擴(kuò)增條帶數(shù)隨種子老化的加劇先減少后增加的現(xiàn)象,并且在4號品種中種子老化4 d后條帶數(shù)全部變?yōu)?,無法再區(qū)分老化程度。
綜合圖2、3、4和表4得出,供試材料種子經(jīng)過人工老化處理之后,DNA分別受到了不同程度的損傷,表現(xiàn)為條帶減少或亮度降低,嚴(yán)重的出現(xiàn)條帶全部消失的情況,而且受損DNA一般集中在100~250 bp和750~2000 bp兩個區(qū)域中,在中間區(qū)域條帶相對集中和穩(wěn)定。說明隨著老化程度的加重,隨機(jī)引物在基因組DNA上的特定結(jié)合位點(diǎn)被破壞,表現(xiàn)為ISSR擴(kuò)增出的條帶減少甚至消失,這與那潼(2007)研究的錦雞兒老化種子基因組DNA的損傷集中在高分子量區(qū)的結(jié)論相似。
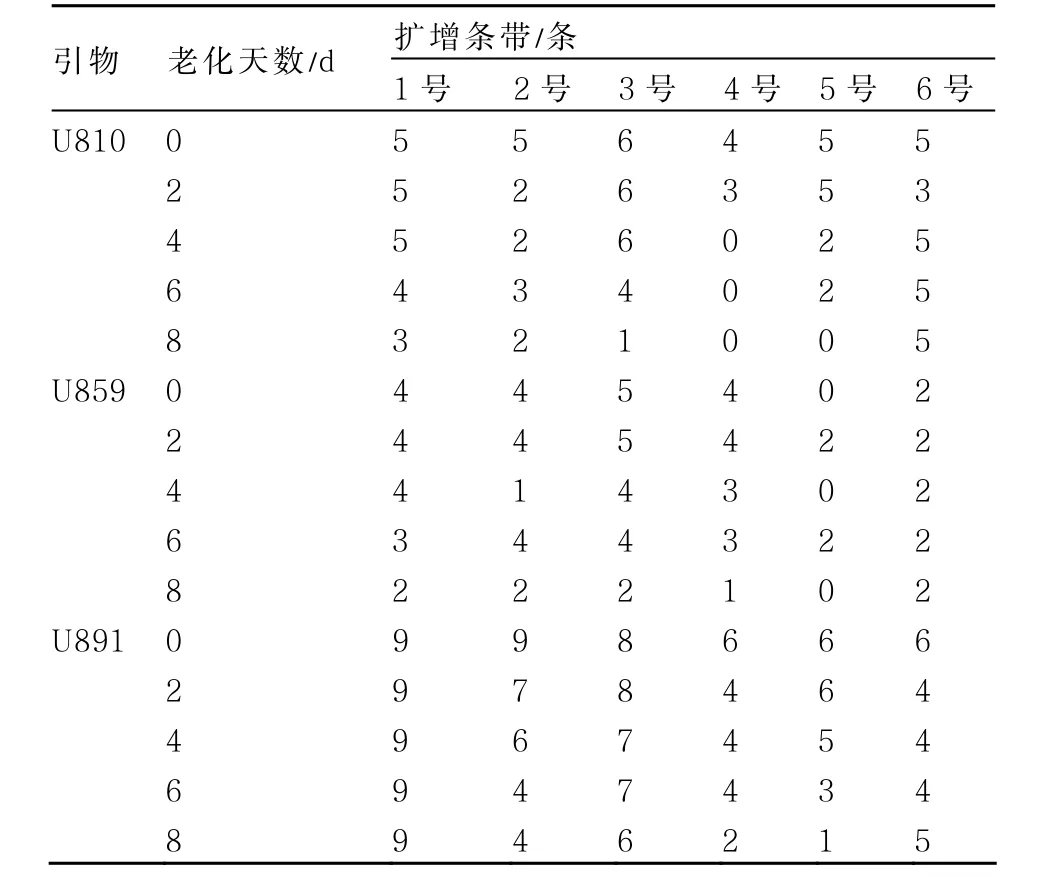
表4 不同引物擴(kuò)增條帶數(shù)統(tǒng)計(jì)結(jié)果
3 結(jié)論與討論
種子老化的研究在分子方面較少,多數(shù)集中在生理生化方面。進(jìn)行分子研究時,種子 DNA的提取常常是在發(fā)芽后進(jìn)行,這樣對老化種子的損傷會有一個修復(fù)過程,不能準(zhǔn)確地反映出老化種子DNA的損傷情況。本試驗(yàn)直接從干種子中提取基因組DNA,最大程度地保存了DNA的真實(shí)狀況,為反映老化種子的DNA損傷情況提供了可靠的依據(jù)。
在已報道的種子老化處理試驗(yàn)中,有在短時間高溫處理后,種子活力升高的現(xiàn)象(韭菜種子),這可能是由于熱刺激的結(jié)果。但在芥菜種子老化試驗(yàn)中,沒有出現(xiàn)種子活力升高現(xiàn)象,因而分子水平檢測中,部分引物的擴(kuò)增條帶數(shù)隨老化加劇而減少后又增加的具體原因有待進(jìn)一步的試驗(yàn)研究。
已有的研究顯示:種子老化到一定程度時,將變成無活力種子(董新紅和宋明,2001)。Shatters等(1995)成功檢測到種子老化過程中DNA變化水平,發(fā)現(xiàn)老化種子DNA碎片增加。通過本試驗(yàn)進(jìn)一步發(fā)現(xiàn),種子老化后的DNA損傷主要分布在100~250 bp和750~2000 bp的兩個區(qū)域。
隨著分子標(biāo)記方法的發(fā)展,已有人開始從老化種子中提取 DNA用于 RAPD分析。伍春蓮(2003)利用 RAPD技術(shù)分析人工老化黃瓜種子的基因組 DNA損傷情況,發(fā)現(xiàn)隨著老化加深,RAPD譜帶減少、亮度減弱,甚至譜帶消失。本試驗(yàn)對芥菜種子人工老化后基因組DNA損傷的ISSR進(jìn)行研究,發(fā)現(xiàn)種子老化后DNA條帶的變化與前人有相似的趨勢,并且找到了區(qū)分不同品種DNA老化程度的ISSR特異引物。試驗(yàn)所得的ISSR條帶表明DNA受損部位可能在與引物結(jié)合的特定位點(diǎn)附近,從而使隨機(jī)引物擴(kuò)增無法正常進(jìn)行,因此導(dǎo)致DNA條帶減少或消失,但具體位點(diǎn)還有待進(jìn)一步研究。
奧斯伯 F,金斯頓 R E,塞德曼 J G,斯特拉爾 K,布倫特 R,穆爾 D D,史密斯 J A.1998.精編分子生物學(xué)實(shí)驗(yàn)指南.顏?zhàn)臃f,王海林,譯.北京:科學(xué)出版社.
董新紅,宋明.2001.種子壽命研究進(jìn)展.生物學(xué)雜志,18(6):7-9.
董新紅.2003.貯藏條件對芥菜種子壽命的影響及其機(jī)理研究〔碩士論文〕.重慶:西南農(nóng)業(yè)大學(xué).
劉佩瑛.1996.中國芥菜.北京:中國農(nóng)業(yè)出版社.
劉婷,湯青林,王志敏,宋明,張敏.2009.正交設(shè)計(jì)優(yōu)化芥菜ISSR反應(yīng)體系研究.西南師范大學(xué)學(xué)報:自然科學(xué)版,34(1):115-118.
劉月輝,王登花,黃海龍,于秀敏,孫愛清.2003.辣椒種子老化過程中的生理生化分析.種子,22(2):51-52.
陸美蓮,張偉峰,喬愛民,官漢陽,胡小燕.2004.芥藍(lán)種子加速老化研究.西南農(nóng)業(yè)大學(xué)學(xué)報:自然科學(xué)版,26(2):187-190.
那潼.2007.兩種錦雞兒種子人工老化中生理生化變化及基因組DNA損傷的ISSR研究〔碩士論文〕.揚(yáng)州:揚(yáng)州大學(xué).
喬愛民,傅家瑞.1999.直接從人工老化的菜心干種子中提取基因組DNA用于RAPD分析.植物學(xué)通報,16(6):701-704.
宋明,劉婷,湯青林,王志敏,楊洋,張敏.2009.芥菜種質(zhì)資源的RAPD和ISSR分析.園藝學(xué)報,36(6):835-842.
唐祖君,宋明.1999.大白菜種子人工老化及劣變的生理生化分析.園藝學(xué)報,26(5):319-322.
伍春蓮.2003.黃瓜(Cucumis sativus L.)老化種子基因組DNA的損傷及其修復(fù)的RAPD研究〔碩士論文〕.重慶:西南師范大學(xué).
楊少輝,張麗娟,段會軍,張彩英.2003.大豆種子DNA的提取方法.大豆科學(xué),22(2):151-153.
余艷,陳海山,葛學(xué)軍.2003.簡單重復(fù)序列區(qū)間(ISSR)引物反應(yīng)條件優(yōu)化與篩選.熱帶亞熱帶植物學(xué)報,11(1):15-19.
鄭曉鷹,任祝三.1982.測定種子活力方法之探討.種子,(4):31-34.
周延清.2005.DNA分子標(biāo)記技術(shù)在植物研究中的應(yīng)用.北京:化學(xué)工業(yè)出版社.
Kalpana R,Madhava,Rao K V.1997.Nucleic acid metabolism of seeds of pigeon pea〔Cajanus cajan(L.)Mills P.〕cultivars during accelerated ageing.Seed Science and Technology,157(3):377-394.
Rogers S O,Bendich A J.1985.Extraction of DNA from milligram amounts of fresh herbarium and mummified plant tissues.Plant Molecular Biology,5:69-76.
Shatters R G J,Schweder M E,West S H A,Smith R L.1995.Environmentally induced detected by RAPD analysis of soybean seed DNA.Seed Science Research,(5):106-116.
Vijay D,Dadlani M,Kumar P A,Panguluri S K.2009.Molecular marker analysis of differentially aged seeds of soybean and safflower.Plant Molecular Biology Reporter,27(3):282-291.
Studies on ISSR Marker of Artificial Aging Mustard Seed Genomic DNA
SONG Ming1, WANG He-bing1, SUN Zi-jian1, WANG Zhi-min1, TANG Qing-lin1, ZHANG Sheng2
(1College of Horticulture and Landscape Architecture, Southwest University, Key Laboratory of Horticulture Science for Southern Mountainous Regions, Ministry of Education, Key Lab in Olericulture of Chongqing, Chongqing400715,China; 2Bioengineering Centers, Chongqing Academy of Agricultural Sciences, Chongqing400055, China)
ISSR molecular marker was applied to analyze the DNA damaging degree of artificial aging muster seed. Six primers suitable for studying aging mustard(Brassica juncea Coss.)seeds were selected from18 primers. We found that along with the prolongation of aging time of muster seed with artificial aging treatment, the numbers of ISSR amplified bands were decreased and their color became light and even faded away. This indicated that during the seed storage, along with the intensification of aging, DNA damages was one of the factors influencing conservation of germplasm resources.
Brassica juncea Coss.; Artificial aging; DNA; ISSR
宋明,男,教授,碩士生導(dǎo)師,專業(yè)方向:蔬菜育種與生物技術(shù),E-mail:swausongm@yahoo.com.cn(2009)應(yīng)用RAPD、AFLP等分子標(biāo)記技術(shù)對大豆、紅花的老化種子進(jìn)行了DNA損傷的研究。
S637
A
1000-6346(2010)24-0025-06
植物種質(zhì)資源是物種進(jìn)化、遺傳學(xué)研究及植物育種的物質(zhì)基礎(chǔ),也是人類生存與持續(xù)發(fā)展的基本依存條件,因而加強(qiáng)種質(zhì)資源的保存是目前種子科學(xué)研究的重要課題。種子老化是種子貯藏過程中普遍存在的一種現(xiàn)象(劉月輝 等,2003),嚴(yán)重影響著種質(zhì)資源的保存,因而了解種子老化過程中種子劣變的機(jī)制對提高種子耐貯性研究具有重要指導(dǎo)意義。長期以來,國內(nèi)外有不少關(guān)于種子壽命與貯藏方面的研究報道,但主要集中在生理生化方面,分子方面的研究則主要集中在蛋白質(zhì)和RNA上,而DNA作為遺傳信息的載體,相關(guān)研究是近些年才發(fā)展起來的,如Vijay等
2010-07-15;接受日期:2010-09-20
國家自然科學(xué)基金(31000908),中央高校基本科研業(yè)務(wù)費(fèi)專項(xiàng)資金(XDJK2009C124),重慶市自然科學(xué)基金(2009BB1307),西南大學(xué)博士基金(SWU110009)

