鴨疫里默氏桿菌的分離、鑒定及培養條件優化
馬志偉,劉世超,許家榮,許俊才
(南京農業大學 動物醫學院,江蘇 南京 210000)
鴨疫里默氏桿菌病,又稱為鴨疫綜合征、鴨敗血癥、鴨傳染性漿膜炎和鴨疫巴氏桿菌感染,是由鴨疫里默氏桿菌 (Riemerella anatipestifer,RA)引起的鴨、鵝、火雞等多種禽類的一種急性或慢性敗血性傳染病[1],是目前對世界各國養鴨業造成危害最為嚴重的傳染病之一,給養鴨業帶來嚴重的經濟損失。該病最早由Riemer于1904年報道發生在鵝群中;1932年,美國學者 Hendrikson和 Hibert報道在紐約長島的鴨場中發現;在我國,1975年鄺榮祿等首次報道該病在廣州存在。1982年郭玉璞等從北京郊區鴨場首次分離到RA以來,河南、福建、四川等地均相繼報道了RA感染,近年來該病依然普遍流行[2]。
RA主要感染1~8周齡鴨,尤其是2~3周齡雛鴨,此外也感染鵝和雞等禽類,其流行無明顯的季節性。一年四季均可發生,冬季和春季發病相對較多,夏季相對較少。本病的發生和飼養管理條件等因素有關,主要通過污染的飼料、飲水、飛沫、塵土等經呼吸道和損傷的皮膚,尤其是腳蹼受傷等途徑以水平方式傳播,低溫陰雨、潮濕、寒冷的環境易誘發本病的發生,如飼養密度過大、通風不良、衛生條件差、轉舍時受寒冷或雨淋的刺激等均可引起該病暴發流行,加劇該病的發生和病鴨死亡[3]。該病的發病率可達90%以上,死亡率一般在5%~75%之間。迄今為止,國際上共報道RA有 21 個血清型 (1 ~21 型)[4-7]。
2009年4月江蘇省南京市郊區某種鴨場15日齡的櫻桃谷小鴨爆發疑似鴨疫里默氏桿菌病的疫情,全場90%小鴨發病,死亡率達45%,損失嚴重。我們對該病進行了較為系統的研究。
1 材料與方法
1.1 材料
1.1.1 病料來源
從發病鴨中選擇具有典型臨床癥狀、剖檢具有典型心包炎、肝周炎等鴨疫里默氏桿菌病典型癥狀的病鴨。
1.1.2 培養基
普通營養瓊脂平板、麥康凱平板、血瓊脂平板、胰酶大豆瓊脂平板 (TSA)、胰酶大豆培養基(TSB)。
1.1.3 試劑
革蘭氏染液、瑞氏染液;微量生化發酵管;初生牛血清;鴨疫里默氏桿菌1、2型陽性血清 (浙江省農業科學院韋強研究員惠贈)。
1.1.4 試驗動物
從養鴨場選購未免疫健康雛鴨,品種:櫻桃谷鴨。
1.2 方法
1.2.1 細菌分離培養
無菌采取患病雛鴨的心血、肝臟、氣囊、腦等組織及滲出物,分別劃線接種于普通營養瓊脂平板、TSA平板、麥康凱平板、血瓊脂平板上,置37℃ 5%CO2培養箱中培養36 h。再將典型疑似菌落進一步劃線接種于TSA平板上,進一步做純化培養。
1.2.2 菌落形態觀察
將分離到的細菌挑取單個菌落劃線接種于血瓊脂平板和TSA平板上,觀察菌落形態。
1.2.3 染色鏡檢
按常規方法對典型疑似菌落進行革蘭氏染色和瑞士染色,鏡檢。
1.2.4 生理生化試驗
無菌鉤取分離細菌純培養物少許,接種于微量生化發酵管中,分別做麥芽糖、果糖、棉子糖、木糖、側金盞花醇、山梨醇、甘露醇發酵利用試驗、吲哚試驗、枸櫞酸鹽利用試驗、產硫化氫試驗、脲酶試驗、硝酸鹽還原試驗、苯丙氨酸脫氨酶試驗、氨基酸脫羧酶試驗、MR試驗、VP試驗、明膠液化試驗。
1.2.5 血清學鑒定
挑取平板上的單個菌落接種于TSA培養平板,置37℃培養36 h,按常規方法做玻片凝集試驗。用兔抗鴨疫里默氏桿菌1、2型陽性血清進行鑒定,有凝集現象的為陽性,以無菌生理鹽水作對照。
1.2.6 PCR鑒定
引物設計與合成。根據GenBank中已發表的所有16S rRNA的基因序列,找到RA 16S rRNA的高度保守區,設計一對特異性引物:上游引物為5′-GAGACACGGACCAGACTCCTACG-3′,下 游 引 物為 5′-ACCTCACGGCACGAGCTGACGACA-3′; 由 上海英駿生物公司合成,擴增長度為749 bp。
PCR反應體系及程序。以細菌的純培養物為模板,利用設計好的引物進行PCR擴增。
PCR反應體系 (25 μL):菌液 1 μL,上下游引物 (10 μmol)各 1 μL,2 × Mix 12.5 μL,H2O 9.5 μL。
PCR程序:94℃ 4 min;進入循環94℃ 45 s,50℃ 45 s,72℃ 1 min,循環30次;72℃ 7 min;4℃保存。
PCR產物鑒定。電泳鑒定:將 PCR產物以1%瓊脂糖凝膠電泳 (含GoldView),并用凝膠成像系統觀察是否出現目的條帶,并拍照記錄。
測序鑒定:將PCR產物回收純化后送上海英駿生物公司測序鑒定。
1.2.7 培養條件和培養時間優化
將鑒定為陽性的細菌劃線接種于血瓊脂平板,37℃培養36 h,挑取單菌落接種于TSB培養基中,振蕩 (100 r·min-1,下同)培養24 h,分別吸取5 mL菌液接種于4個裝有250 mL TSB培養基的1 L三角瓶中,在A、B、C、D 4種條件下培養:A為培養基中加2%初生牛血清,37℃振蕩培養,B為培養基中加2%初生牛血清,37℃靜置培養,C為37℃振蕩培養,D為37℃靜置培養。
培養每隔一段時間后,無菌條件下分別取少許菌液測D600值。記錄數據結果,并以時間為橫坐標,D600為縱坐標,制作D600-T曲線。
1.2.8 動物回歸試驗
將鑒定為陽性并經分離純化的細菌,接種于TSB培養基,37℃振蕩培養24 h。用生理鹽水洗滌菌體,并稀釋至D600約為0.5。
將購自養殖場的10日齡健康雛鴨飼養2日使其適應環境,然后隨機分組:對照組2只和試驗組4只,分別稱重。試驗組頸部皮下注射接種0.5 mL菌液,對照組以同樣方法注射0.5 mL無菌生理鹽水。試驗組與對照組分開飼養,連續飼養、觀察1周,記錄鴨子的食用飼料重量、臨床表現等情況;對病死鴨進行病理剖檢觀察,記錄數據。
2 結果與分析
2.1 細菌分離培養
共分離到2株細菌:A和B,在麥康凱平板和普通營養瓊脂平板上不生長,在血瓊脂平板和TSA平板上可見露珠樣小菌落。
2.2 菌落形態觀察
血瓊脂平板和TSA平板上菌落大小及形態無明顯差異,2株細菌的菌落均呈露珠狀,圓形隆起,表面光滑,邊緣整齊,直徑為1~2 mm,顏色為灰白色,較透明;與RA菌落的形狀相似,疑似為RA。
2.3 染色鏡檢
革蘭氏染色后,鏡檢可見革蘭氏陰 (-)性小桿菌,少數呈橢圓形;瑞士染色后,鏡檢可見小桿狀細菌菌體呈兩極濃染,多為單個分散排列,少數成雙或短鏈排列。
2.4 生理生化試驗
生理生化試驗結果見表1。
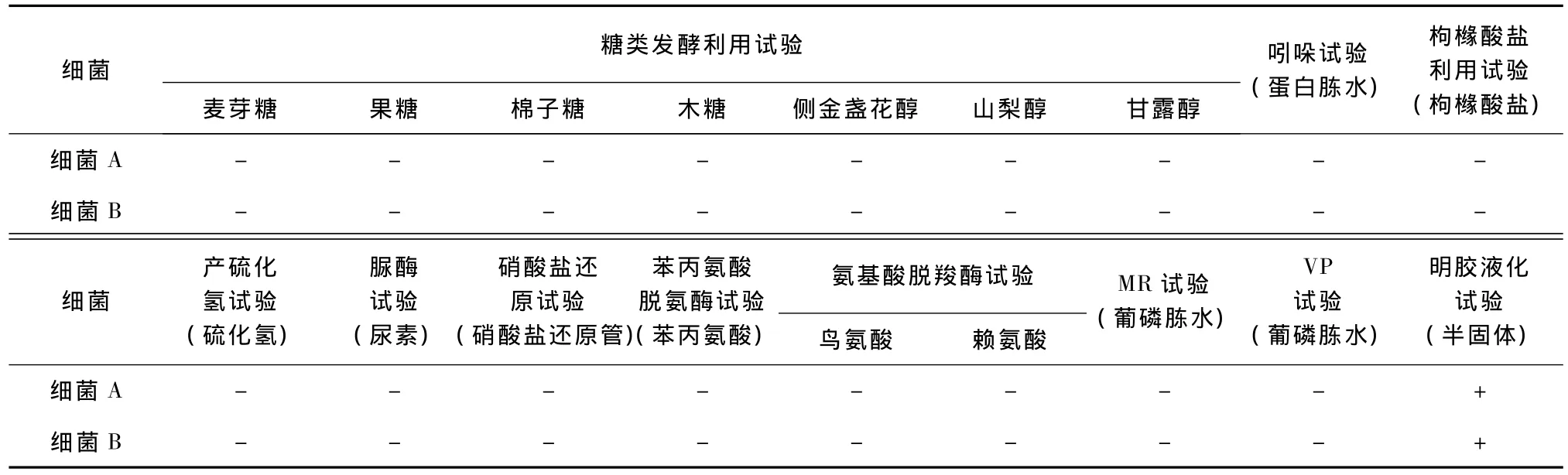
表1 生理生化試驗結果
生理生化試驗結果與RA相符合,因此,初步認定2株細菌均為鴨疫里默氏桿菌,但仍有待進一步確認。
2.5 血清學鑒定
玻片凝集試驗結果見表2。

表2 玻片凝集試驗結果
由凝集試驗結果可以確定,A、B 2株細菌均為鴨疫里默氏桿菌,且血清型相同,均為1型。
2.6 PCR鑒定
2.6.1 電泳鑒定
PCR產物電泳結果見圖1。
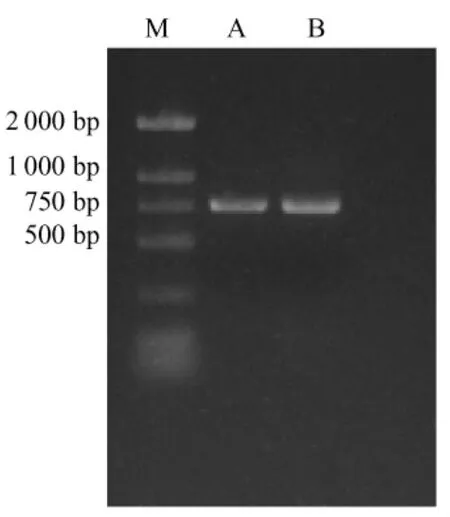
圖1 PCR產物電泳鑒定結果
由圖1可見,1、2型鴨疫里默氏桿菌均能擴增出目標片段,大小與預期一致。
2.6.2 測序鑒定
2株細菌的序列完全相同,且與所選基因片段序列一致性為100%。因此,可確認這2株細菌為鴨疫里默氏桿菌。
2.6.3 構建系統發生樹
通過 NCBI網站的 BLAST程序搜索與該16S rRNA基因序列相似度較高的其它菌株的序列,通過ClustalX和Mega程序,將PCR產物序列與其它7株細菌 (RA strain RAf103、Riemerellasp.IPDH 359/90、Uncultured bacterium clone nbw546c05c1、Flavobacteriumsp. 130704W2、 UnculturedCryomorphaceaebacterium clone XZXXH203、Anaerophaga thermohalophilastrain Fru22、Pasteuria goettingianae)的相似序列進行比對,構建系統發生樹,如圖2。
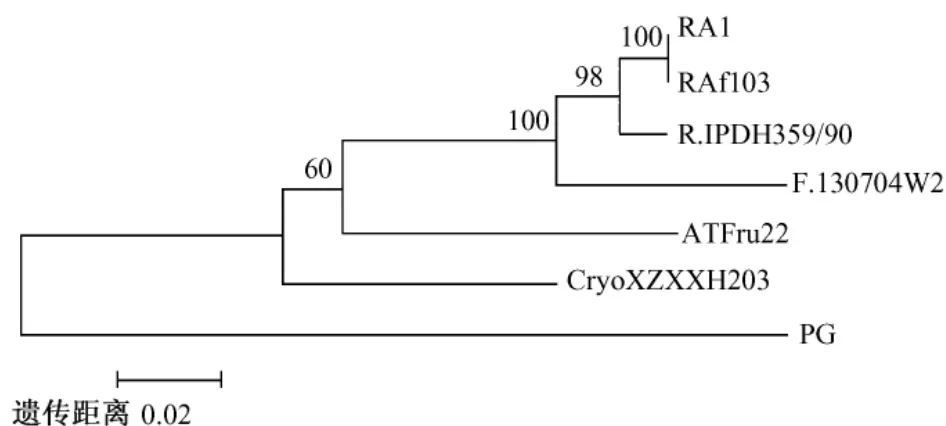
圖2 1型RA與其它7株細菌構建的系統發生樹
由圖2可以推斷,試驗室所分離到的細菌與RA strain RAf103相同,與 Riemerella sp.IPDH 359/90同屬,與Flavobacterium sp.130704W2同為黃桿菌科,因此可以判定該株細菌為RA。綜上所述,該株細菌為1型鴨疫里默氏桿菌。
2.7 培養條件和培養時間優化
RA為兼性厭氧菌,其對培養條件的要求較為苛刻,生長速度較慢,不易被分離到,因此需選擇合適的培養條件和時間[9]。為了更加了解RA的生長特性,獲得較佳的培養條件和時間,本試驗對RA的培養條件和培養時間進行了研究和分析,結果見圖3。
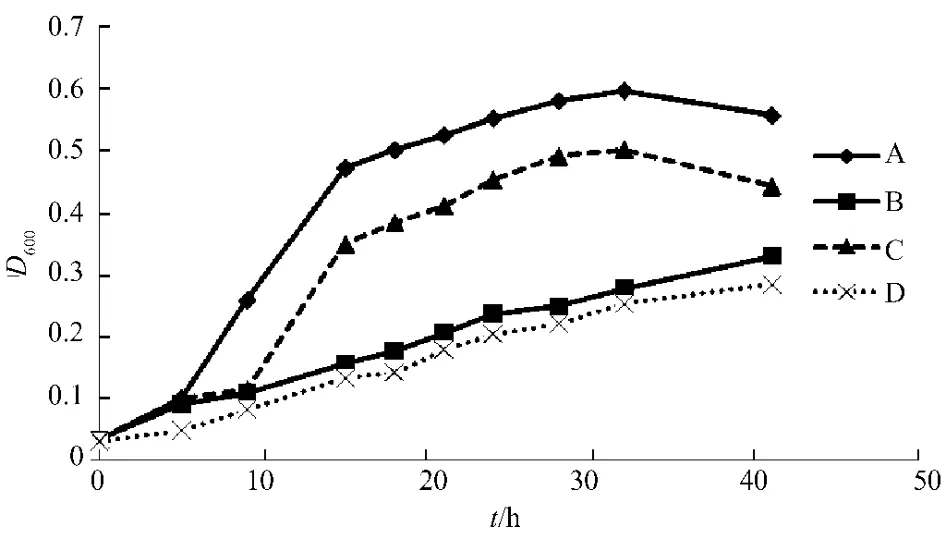
圖3 RA菌在4種培養條件下的生長情況
由圖3中數據可見,A(37℃振蕩,加2%初生牛血清)、B(37℃靜置,加2%初生牛血清)、C(37℃振蕩)、D(37℃靜置)4種培養條件下,RA的生長情況為A條件下速度最快,C條件下其次,B和D條件下的速度較慢;且振蕩培養比向培養基中加入2%初生牛血清對RA生長的促進作用更加明顯,因此,在培養RA時,應盡可能振蕩培養。
從圖3可以看出,在A和C(均37℃振蕩培養)2種培養條件下,RA的生長在28~32 h從對數期進入穩定期;而在B和D(均37℃靜置培養)培養條件下,RA的生長沒有出現明顯地從對數期向穩定期的轉變。因此,RA在振蕩條件下培養28 h,即可完成培養,節省培養時間,若培養時間過長,RA進入穩定期,則會影響RA的生長。
2.8 動物回歸試驗
動物回歸試驗結果見表3。
在飼養過程中,對照組鴨長勢良好,育肥迅速,平均每日增重50 g,肉料較高,相對節約了飼料消耗,增加了養鴨場的經濟效益,2只鴨均無患病臨床癥狀;剖解后未見任何病變,心臟、肝臟等器官均正常,且未分離到RA。
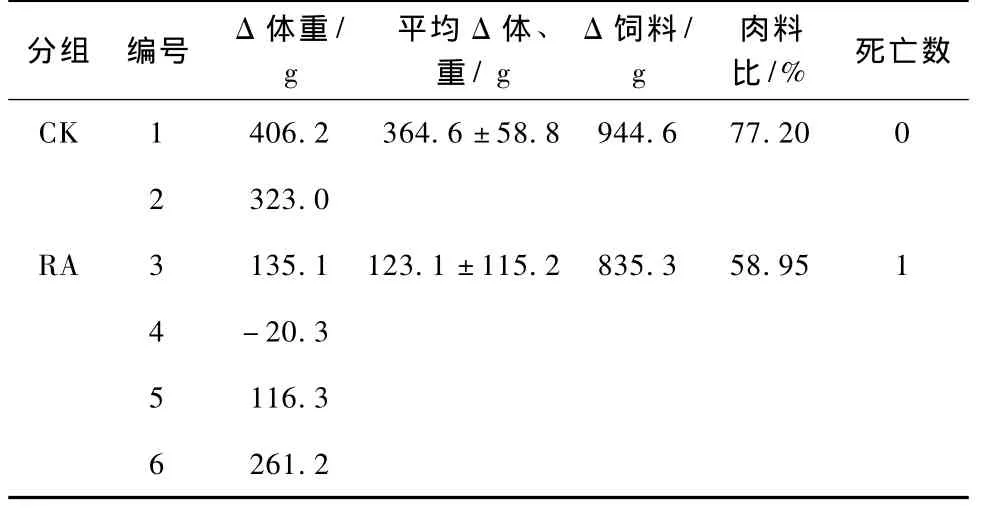
注:CK為注射生理鹽水;RA為注射1型RA;Δ體重為1周內雛鴨體重變化;Δ飼料為1組雛鴨1周內消耗飼料重量;肉料比為1周內雛鴨體重變化與所消耗飼料的比值;死亡數為1周內死亡鴨的數量。
試驗組鴨生長速度則大大降低,平均每日增重不到20 g,且肉料較低,使飼養的經濟效益降低;試驗組鴨均出現嚴重程度不同的鴨疫里默氏桿菌病的典型臨床癥狀:精神沉郁、萎頓,頭顫動,羽毛粗亂無光澤,食欲下降,肢體無力,行動困難,伏臥不起,排綠色稀糞等。剖解病死鴨發現各內臟器官出現不同程度的病變,心臟明顯較小,心包膜增厚,腸系膜增多,將內臟器官包住,肝臟較小,并見心包膜、腸系膜、肝臟外膜周圍出現灰白色纖維素性滲出物。從病死鴨心血、肝均分離到RA,經玻片凝集和染色試驗,證明其血清型與攻毒菌相同。
3 小結
鴨疫里默氏桿菌可以使鴨、鵝、火雞等多種禽類患病,導致家禽育肥減慢或死亡,嚴重影響了養鴨業等的經濟效益,給農業造成巨大的經濟損失。
本次研究從養鴨場分離到2株細菌,通過傳統生理生化和分子生物學2種方法對其進行了鑒定,構建了系統發生樹,充分證明了這2株細菌為1型鴨疫里默氏桿菌。相對傳統方法,分子生物學方法具有快速、高效、準確的優點,本文建立的針對RA的16S rRNA基因PCR技術可用于快速檢測、鑒定鴨疫里默氏桿菌。
鴨疫里默氏桿菌對培養基的營養要求較高,在普通營養瓊脂平板上不生長,為了更好地了解RA的生長特性,本次試驗對RA的生長條件和生長時間進行了研究。試驗結果表明,RA在37℃振蕩培養能夠較好地生長,提高培養基的營養則能夠進一步促進RA的生長,但效果沒有振蕩培養的明顯,因此在分離和培養 RA時,應盡可能振蕩培養。
我們還進行了動物回歸試驗。RA的感染使雛鴨生長速度減慢1/2以上,發育不良,并使1只試驗組鴨病死,嚴重影響了養鴨業的經濟效益。與這2株RA的來源養鴨場相比,試驗室動物回歸試驗的雛鴨病死率相對較低,分析原因可能是飼養環境的問題:在大多數情況下,動物患病并不是由僅僅一種病原的侵染,可能是由于多種病原同時侵染或者病原侵染時動物的飼養環境較差,如低溫陰雨、潮濕、寒冷等惡劣環境的刺激,使得動物發病嚴重,造成病死率很高;而試驗室的飼養條件相對較好,從而導致動物回歸試驗的病死率并不高。所以,加強飼養管理,減少不良環境因素造成的應激反應,乃是動物生產的基本策略。
[1]呂敏娜,黃承鋒,張毓金.鴨疫里默氏桿菌大腸桿菌二聯蜂膠苗的研制[J].中國獸醫雜志,2005,41(1):48-50.
[2]鄭藝杰,吳志遠,王藝娟.鴨疫里默氏菌的研究進展[J].福建畜牧獸醫,2009,31(5):19-21.
[3]胡清海,張知良,苗晉鋒,等.江蘇安徽兩省鴨疫里默氏桿菌病的流行病學調查研究[J].中國獸醫科技,2001,31(8):12-13.
[4]Loh H,Teo T P,Tan H C.Serotypes of Pasteurellla anatipestifer isolates from ducks in Singapore[J].Avian Pathol,1992,21:453-459.
[5]Pathanasophan P,Tanticharoenyos T,Sawada T.Physiological characteristics,antimicrobialsusceptibility and serotypes of Pasteurella anatipestifer isolated from ducks in Thailand[J].Vet Microbiol,1994,39:179 -185.
[6]Pathanasophon P,Sawada T,Tanticharoenyos T.New serotypes of Riemerella anatipestifer isolated from ducks in Thailand[J].Avian Pathol,1995,24:195-199.
[7]Pathanasophon P,Phuektes P,Tanticharoenyos T,et al.A potential new serotype of Rimerella anatipestifer isolated from ducks in Thailand[J].Avian Pathol,2002,31(3):267-270.
[8]李艷奇,高晴霄,顧春陽,等.鴨疫里默氏桿菌多價滅活苗的研制及應用[J].水禽世界,2008(2):41-42.
[9]單艷菊,龔建森,施祖灝,等.Ⅰ型鴨疫里默氏桿菌的分離與鑒定[J].吉林畜牧獸醫,2009,30(2):5-6.

