枯草芽孢桿菌誘變株發酵羽毛工藝條件的研究
吉林工商學院 張 昕
禽類羽毛中含75%~85%的硬質角蛋白,羽毛角蛋白中的氨基酸大部分為疏水性氨基酸,其中胱氨酸二硫鍵很難被蛋白質水解酶打開,使羽毛角蛋白性質極其穩定,在稀酸、稀堿溶液中不易水解,如果僅靠動物自身消化道中的消化酶基本上無法將其消化吸收。因此,要利用家禽羽毛作飼料,必須經過一定的處理。目前國內外現有的羽毛加工方法有:酸(堿)水解法、高溫高壓水解法、膨化法、酶法。現有的物理、化學加工方法效果不理想,直接加入酶制劑的方法成本太高。生物發酵技術現在處于研究階段,在生產實際中的應用鮮見報道(蔡成崗和鄭曉冬,2006;吳小倫等,2001)。因此,筆者通過多年研究,對枯草芽孢桿菌進行紫外線和亞硝酸鈉復合誘變,篩選出產角蛋白酶活力強的誘變菌株FUN 30.2,本試驗優化了發酵培養基和發酵工藝條件,為工業發酵生產生物降解羽毛粉提供科學依據。
1 材料
1.1 菌種 枯草芽孢桿菌紫外線和亞硝酸鈉復合誘變菌株FUN 30.2(實驗室保留的誘變種)。
1.2 培養基 優化羽毛粉培養基成分:羽毛粉5.5%,青貯玉米秸稈粉0.8%,K+濃度0.018 mol/L,Mg2+濃度 0.065 mol/L,Ca2+濃度 0.072 mol/L,Fe2+濃度 0.010 mol/L,Na+濃度 0.088 mol/L。 pH:7.0 ~8.0。
2 試驗方法
2.1 菌種培養及酶活力測定方法
2.1.1 菌種培養方法 培養18 h的斜面菌種轉接到50 mL牛肉膏-蛋白胨液體培養基中,(36±1)℃培養 18 h。
2.1.2 酶活力測定方法 發酵液過濾離心后,取其上清液 1 mL,加 2 mL Tris-HCl buffer(50 mmol/L Tris-HCI,pH 8.0),然后加入 10 mg 羽毛粉,置于40℃水浴保溫振蕩反應6 h,然后加入2 mL 10%TCA終止反應。30 min后,4℃離心15 min,離心機轉速為8000 r/min,上清液于280 nm處測定OD值。對照試驗先加TCA終止液,其他試驗過程同上(張寒俊等,2004)。
酶活力定義為:以試驗組與對照組在280 nm處測定的吸光度OD值的差值表示,吸光度值每增加1所需的酶量為1 U。
羽毛角蛋白降解率=(加入羽毛粉干重-發酵后濾渣干重)/加入羽毛粉干重×100%。
2.2 培養基優化試驗設計 選擇對微生物生長繁殖及產酶有影響的7因素16水平,以菌體產生的角蛋白酶 活力為響應值,Fe2+、Na+、K+、Mg2+、Ca2+、青貯玉米秸稈粉和羽毛粉加入量為因變量,對培養基成分進行優化,采用U*16(1610)使用表設計和安排試驗。
三角瓶中裝液量150 mL/500 mL,接種量5%, 搖床轉數 150 r/min,(36±1)℃恒溫搖床培養48 h,取上清液過濾離心,離心機轉速為8000 r/min,4℃離心15 min取上清液測定酶活力。
2.3 菌株發酵及產酶條件的優化試驗 通過測定不同發酵條件下枯草芽孢桿菌誘變種產酶的酶活力來優化發酵條件,為工業化生產生物降解羽毛粉提供工藝參數。
2.3.1 發酵溫度的優化 配制均勻設計的優化羽毛粉培養基,分別在設定溫度的搖床里進行發酵,其他發酵條件為,培養基裝液量150 mL/500 mL、搖床轉速150 r/min發酵48 h,接種量為5%(V/V),發酵結束后分別測定酶活力。
2.3.2 接種量的優化 分別以設定的接種量,在優化的溫度下發酵48 h后測定酶活力。
2.3.3 搖床轉速的優化 設定不同的搖床轉速,在上面試驗中確定的溫度和接種量條件下進行發酵,發酵48 h結束后分別測定酶活力。
2.3.4 發酵液裝液量的優化 分別設定發酵液的裝液量,在前面試驗確定的條件下發酵48 h,發酵結束后測定酶活力。
2.3.5 發酵液初始pH值的優化 初始pH值對菌體生長的影響:配制完全培養基,把培養基的pH 值分別調到 5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0。其他發酵條件為優化后的條件,24 h發酵結束后,培養液用無菌生理鹽水稀釋10倍,于660 nm測定吸光度值。
初始pH值對菌體產酶的影響:配制均勻設計優化羽毛粉培養基,把培養基的pH值分別調到 5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0。 其他發酵條件為優化后的條件,48 h發酵結束后分別測定酶活力。
2.3.6 培養時間的優化 培養時間對菌體細胞生長的影響:配制優化羽毛粉培養基,設定不同培養時間,每隔6 h測定一瓶發酵液中活細胞數。
培養時間對菌體產酶的影響:配制優化羽毛粉培養基,設定不同培養時間,每隔6 h測定一瓶發酵液的酶活力及羽毛降解率。
3 結果與分析
3.1 顯微鏡觀察結果 見圖1和圖2。
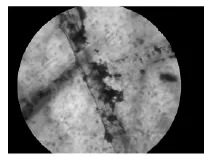
圖1 顯微鏡下觀察未降解羽毛粉
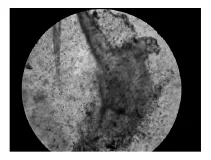
圖2 顯微鏡下觀察已降解羽毛粉
3.2 培養基優化試驗結果 見表1。
由表1可見,條件(6)菌體產生的角蛋白酶活力高達1.117 U/mL,所以選擇優化羽毛粉培養基成分配比為:羽毛粉5.5%,青貯玉米秸稈粉0.8%,K+濃度 0.018 mol/L,Mg2+濃度 0.065 mol/L,Ca2+濃度 0.072 mol/L,Fe2+濃度 0.010 mol/L,Na+濃度0.088 mol/L。在優化培養基之前,測定菌體角蛋白酶活力為0.889 U/mL;培養基優化后,菌體產酶活力提高了25.65%。
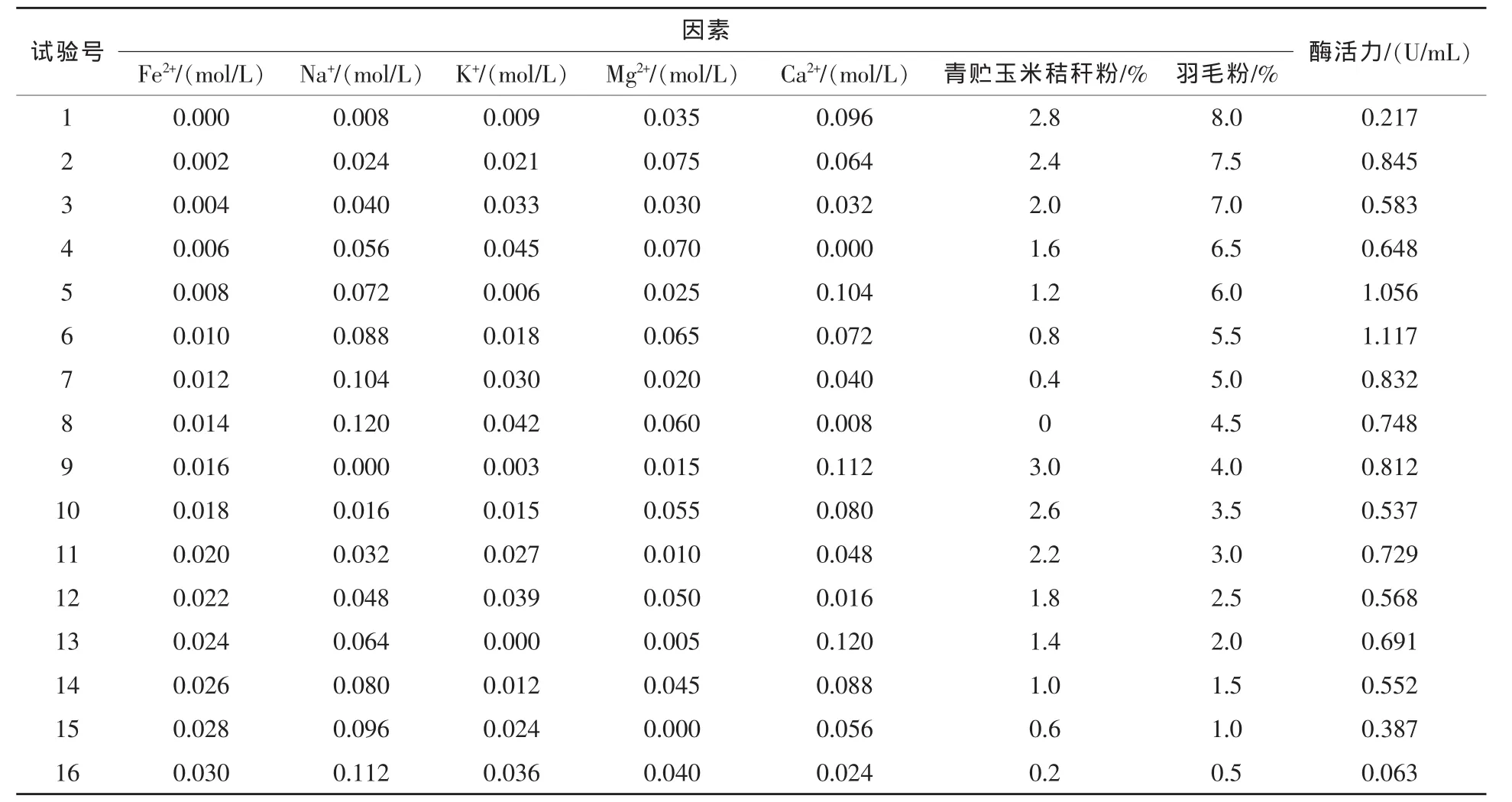
表1 各因素水平的角蛋白酶活力測定結果
3.3 菌株發酵及產酶條件的優化試驗結果
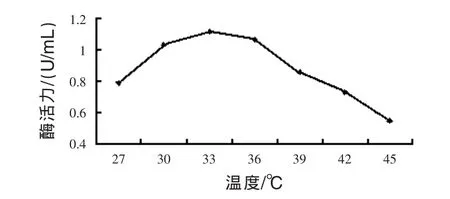
圖3 發酵溫度對菌體產酶活力的影響
3.3.1 發酵溫度的優化 見圖3。由圖3可見,溫度為27~33℃時,隨著溫度的升高,酶活力明顯提高,超過33℃以后,隨著溫度的升高酶活力下降。FUN 30.2菌株在33℃發酵,酶活最高達到了1.121 U/mL。因此選擇最佳發酵溫度為33℃。比誘變前菌體生長的適宜溫度略低。
3.3.2 接種量的優化 見圖4。
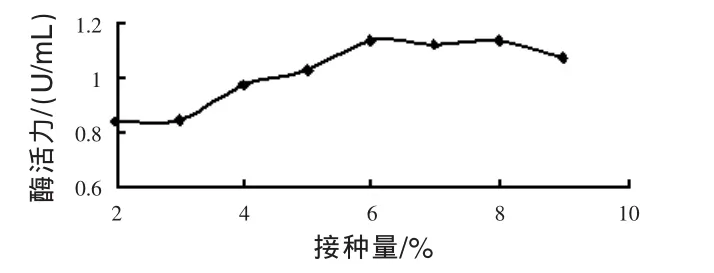
圖4 接種量對發酵過程中酶活力的影響
由圖4可見,接種量對菌體降解角蛋白的能力影響不大,適當增加接菌量,可以縮短發酵的適應期,減少雜菌污染的幾率。接種量從2%增加到6%,酶活力呈上升趨勢,接種量從6%增加到9%,酶活力變化不明顯,因此確定接種量為6%。
3.3.3 搖床轉速的優化 見圖5。
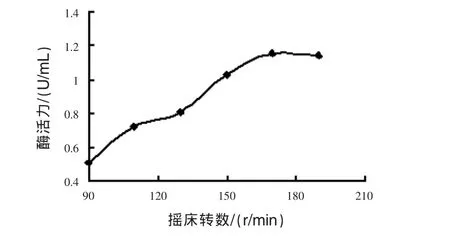
圖5 搖床轉速對菌體產酶活力的影響
由圖5可見,搖床轉速直接影響發酵液中的溶氧,搖床轉速從90 r/min升到170 r/min,酶活力隨著搖床轉速的升高而明顯增加,超過170 r/min后,酶活力變化不大。確定搖床轉速170 r/min。
3.3.4 發酵液裝液量的優化 見圖6。
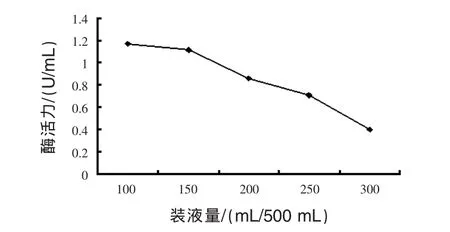
圖6 裝液量對發酵過程中酶活力的影響
由圖6可見,裝液量加大,發酵液的酶活力明顯降低。裝液較多影響了發酵液中的溶氧,從而影響菌體的正常生長。裝液量在100 mL時,發酵液酶活力最大。最大值為1.163 U/mL,確定最適合的裝液量為100 mL/500 mL。
3.3.5 發酵液初始pH值的優化
3.3.5.1 初始pH值對菌體生長的影響:見圖7。
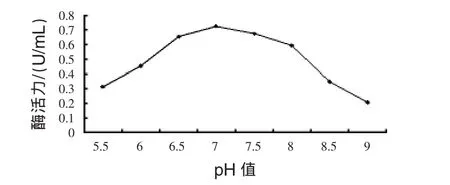
圖7 發酵液初始pH值對菌體生長的影響
由圖7可見,菌體生長適宜的培養基初始pH值范圍是6.5~7.5,最適pH值為7.0。
3.3.5.2 初始pH值對菌體產酶的影響:見圖8。
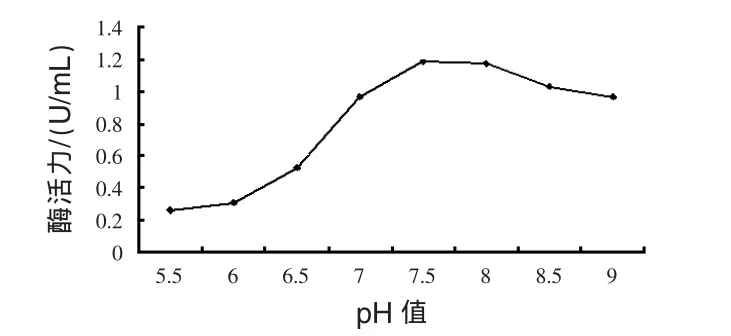
圖8 發酵液初始pH值對菌體產酶活力的影響
由圖8可見,pH值為5.5~7.5時,酶活力迅速增大,pH值為7.5時酶活力達到高峰,pH值大于8.0時,酶活力逐漸下降,選擇菌體產酶的發酵液最適宜pH值為7.5~8.0。
3.3.6 培養時間的優化 見圖9。

圖9 發酵液中的活細胞生長曲線
由圖9可見,培養時間對菌體細胞生長的影響:培養時間0~18 h,菌體處于適應期,培養時間18~36 h,菌體處于對數期,培養時間36~54 h,菌體處于穩定期,培養時間54 h后,菌體處于衰亡期。從菌體的生長曲線分析,在以羽毛和玉米秸稈為碳、氮源的培養基中,菌體的適應期較長,可能是細胞進行代謝的調整,包括誘導酶的產生,據資料報道,角蛋白酶是誘導酶,這可能與菌體的適應期較長有關。
培養時間對菌體細胞產酶活力的影響:由圖10可見,每隔6 h測定一瓶優化羽毛粉發酵液的酶活力及羽毛降解率。發酵時間從0~60 h,菌體的酶活力不斷上升,其中24~60 h菌體酶活力的提高較快,60 h菌體酶活力最高達1.267 U/mL;60 h以后酶活力迅速下降,90 h以后酶活力略有回升趨勢,可能與菌體生長及發酵液的pH值變化有關。同時,羽毛降解率在持續上升,36~72 h階段羽毛降解率上升較快,72 h降解率已經達到了69.61%,72 h以后降解率變化不明顯。綜合分析發酵過程中酶活力和羽毛降解率的變化規律,選擇最佳發酵時間為72 h。
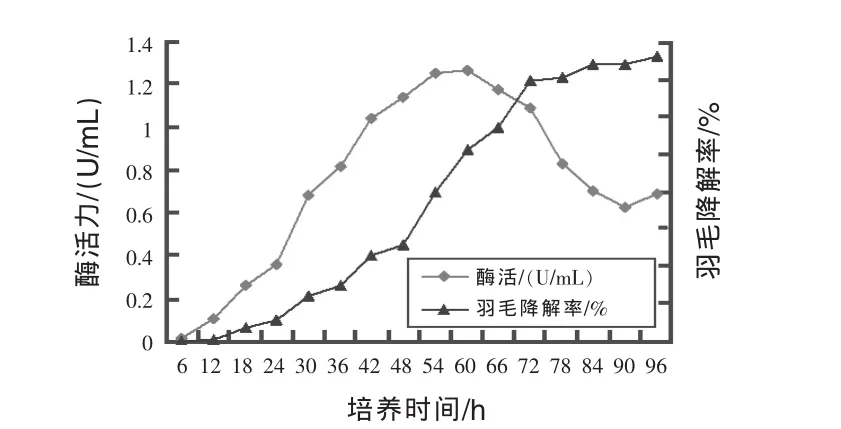
圖10 發酵時間對酶活力和羽毛降解率的影響
3.4 發酵液氨基酸含量測定 由吉林大學測試中心測定,結果見表2。
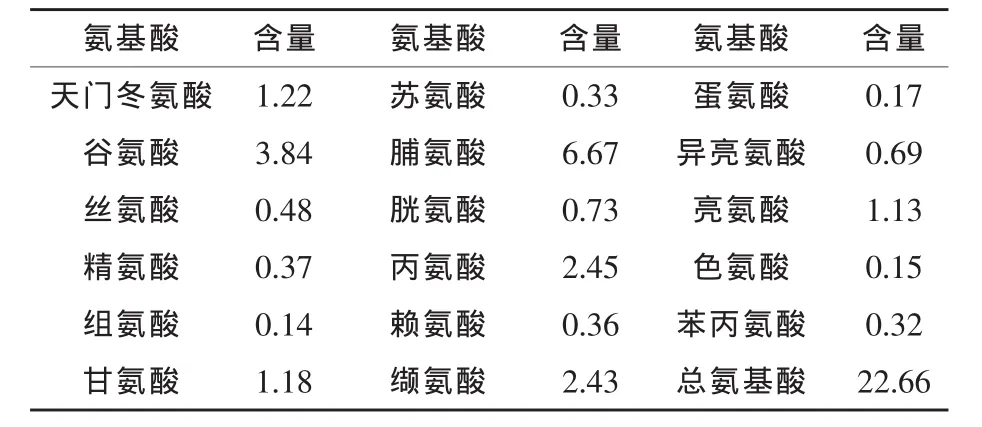
表2 羽毛粉發酵液的氨基酸含量測定結果mg/mL
4 結論
4.1 羽毛發酵培養基優化試驗結果表明,該菌株最佳羽毛培養基成分配比為:羽毛粉5.5%,青貯玉米秸稈粉 0.8%,K+濃度 0.018 mol/L,Mg2+濃度0.065 mol/L,Ca2+濃 度 0.072 mol/L,Fe2+濃 度0.010 mol/L,Na+濃度 0.088 mol/L。培養基優化后,菌體產酶活力提高了25.65%。
4.2 應用單因子試驗設計法對影響菌株發酵過程的發酵條件進行了優化,得到最優的發酵條件為:培養溫度33℃,培養時間72 h,搖床轉速170 r/min,接種量 6%,裝液量 100 mL/500 mL,菌體生長適宜的培養基初始pH值范圍是7.0左右,菌體產酶的發酵液最適宜pH值為7.5~8.0。在培養時間因素試驗中,發酵液中活細胞數在48 h達到高峰,為3.9×109CFU/mL;60 h菌體產酶活力最高達1.267 U/mL;在發酵時間達到72 h時,羽毛降解率達到了69.61%。
3.5.3 經該菌株發酵,羽毛角蛋白大量轉化為氨基酸、短肽和菌體蛋白,發酵液的氨基酸含量高達22.66 mg/mL。
[1]蔡成崗,鄭曉冬.角蛋白酶的來源、理化性質與生物工程研究進展[J].食品與發酵工業,2006,32(4):111 ~ 113.
[2]吳小倫,閔航,馬曉航.羽毛角蛋白的生物降解 [J].環境污染與防治2001,23(1):66 ~ 68.
[3]張寒俊,劉大川,楊國燕.紫外光譜法定量測定不同種蛋白酶活力的研究[J].糧食與飼料工業,2004,9:44 ~ 45.

