Fahr病的臨床和影像學特點并文獻復習
高 明,劉慶余,陳建宇,楊澤宏,崔麗萍,蔣新華
(中山大學附屬第二醫院,廣東 廣州 510120)
Fahr病又稱特發性基底節鈣化。近年來,隨著CT和MRI的廣泛應用,Fahr病被越來越多地發現。本研究通過回顧性分析經臨床證實的4例Fahr病患者資料,分析和總結其臨床及影像學特點,并結合文獻進行復習以提高對Fahr病的認識和診斷水平。
1 資料與方法
1.1 一般資料
4例 Fahr病患者均為男性,年齡37~67歲,平均47歲,病史約1~3年。全部患者均無甲狀腺切除史,且均排除甲狀旁腺功能低下和其他與基底節鈣化相關的疾病。
1.2 檢查方法
3例患者行Siemens Somatom Sensation 64層螺旋CT掃描。掃描參數:電壓120kV,電流100mA,準直器寬度0.6mm,螺距 0.2,重組層厚 6.0mm,間距 6.0mm;4例患者行MRI檢查,掃描設備采用Philips Intera 1.5T超導MRI成像系統,行橫斷面、矢狀面和冠狀面掃描;T1WI(SE序列):TR 540ms,TE 45ms,2 次激勵。 T2WI (TSE 序列):TR 4400ms,TE 110ms,2 次激勵。 層厚 5.0mm,層間距 1mm,矩陣 328×207。
1.3 診斷標準
采用Moskowitz等[1]擬定的Fahr病的診斷標準:①影像上有對稱性雙側基底節鈣化;②無假性甲狀旁腺功能減退表現;③血清鈣、磷正常;④腎小管對甲狀旁腺素反應功能正常;⑤無感染、中毒代謝等原因。
2 結果
2.1 臨床特點
4例Fahr病患者均為散發,無家族遺傳病史,且病史約1~3年;有震顫麻痹和小腦共濟失調者各2例,其中同時合并有反復癲癇發作和精神障礙者各1例。
2.2 實驗室檢查
4例患者血清鈣和血清磷均在正常值范圍內,且甲狀腺功能和甲狀旁腺素正常。其中1例患者行腦電圖檢查后示輕至中度不正常腦電圖。
2.3 影像學表現
2.3.1 CT表現
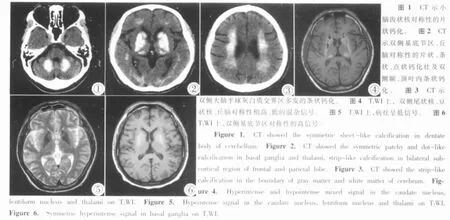
3例患者行CT檢查,主要表現為雙側基底節區 (蒼白球、殼核、尾狀核和豆狀核)、丘腦、小腦齒狀核及大腦灰白質交界區對稱性分布的鈣化,且病灶周圍均未見水腫帶;其中蒼白球鈣化主要呈長條形及片狀,殼核鈣化為點、片狀或不規則形,尾狀核鈣化呈倒“八”字形,丘腦鈣化呈點片狀;小腦齒狀核鈣化呈對稱片狀;大腦灰白質交界區鈣化主要為額、頂、枕葉灰白質交界區多發的條狀鈣化(圖1~3)。
2.3.2 MRI表現
4例患者行MRI檢查,主要表現為雙側基底節區(蒼白球、殼核、尾狀核和豆狀核)、丘腦、小腦齒狀核及大腦灰白質交界區對稱性分布的鈣化;其中雙側基底節區及丘腦病灶在T1WI上主要呈高、低及混雜信號,在T2WI上均為低信號;小腦齒狀核病灶在T1WI和T2WI上均呈低信號;雙側額頂葉、側腦室周圍病灶在T1WI上呈等、稍低信號,T2WI呈低信號(圖4~6)。
3 討論
Fahr病又稱特發性基底節鈣化、錐體外系鐵鈣沉著癥或特發性家族性腦血管亞鐵鈣沉著癥,由Fahr于1930年首次報道,國內由蔣雨平等[1]首次報道。Fahr病屬于常染色體顯性或隱性遺傳疾病,少數為性染色體遺傳的疾病,有些患者出現16號或18號環形染色體[2]。該病男女發病無顯著差異,且多為散發,但家族性的Fahr病亦有報道[3-4]。本組4例患者均為男性,散發病例,無家族遺傳病史。Fahr病的病因復雜,發病機制目前尚不清楚,除有不明機制的家族遺傳性因素之外,其他可能的發病機制有血管因素等。
Fahr病主要的病理改變為病變區廣泛終末小動脈和小靜脈周圍的鈣質沉著,主要的病理過程為酸性黏多糖組成的嗜堿性物質在血管周圍沉積,亞鐵磷、鋁、鉀等鹽類沉著。
Fahr病的臨床癥狀多種多樣,一般呈進行性發展,主要為運動障礙和認知精神障礙,表現為進行性精神障礙、癡呆、癲癇發作、頭痛等[5];其它的表現有智力低下、手足抽搐、發育障礙、共濟失調或只表現為行為異常和神經心理異常而無運動失調等其他癥狀[6];其臨床癥狀的產生可能與鈣鹽沉著嚴重時,小血管阻塞使基底神經節缺血,長時間后造成梗塞而產生相應的神經癥狀有關[7]。實驗室檢查血鈣和血磷生化值均在正常范圍內,且甲狀腺功能和甲狀旁腺素正常。
影像學方面,Fahr病主要以基底節區、丘腦、小腦齒狀核和大腦半球白質鈣化為特征[6,8],常為雙側對稱性,也可為單側。常見鈣化部位的發生順序是蒼白球、尾狀核、殼核、丘腦、額頂葉腦回底部、齒狀核、小腦皮層、腦干中央部及側腦室周圍[9-10]。Fahr病在不同的部位、病程的不同時期,鈣化的形態和大小也有差別。基底節區是鈣化最好發的部位,其中尾狀核頭部的鈣化呈倒“八”字形排列;豆狀核為條片狀鈣化,呈正“八”字形排列;丘腦的鈣化呈“三角”形,部分病例的鈣化呈條片狀。小腦齒狀核的鈣化多呈多層弧線形;而額、頂、顳、枕葉灰白質交界區多為對稱的點狀、片狀或條狀鈣化。在CT上鈣化為均勻高密度。在MR上多數病灶鈣化區在T1WI、T2WI上均為低信號,少數可在T1WI呈稍高信號,且T2WI高信號與病變活動有關,或與鈣化區內的膠質增生或者結合水的含量有關[11]。本組4例T2WI均為低或稍低信號,T1WI 1例為高信號,1例為混合信號,2例為低信號。
本病應與其它基底節鈣化性疾病鑒別:①甲狀旁腺功能減退,影像上可表現為基底節區、丘腦、小腦齒狀核和大腦皮髓質交界區鈣化,但臨床上常有低鈣性手足抽搐,血生化檢查為低血鈣和高血磷;②結節性硬化,影像上亦可表現為大腦和小腦斑塊狀鈣化,但其特征性的CT和MRI表現是室管膜下多發的膠質結節或結節鈣化,鈣化斑的特征為沿側腦室外測分布,多突向側腦室內,且直徑在10mm以下,類圓柱形病灶,有的可以因膠質纖維化的牽拉使側腦室擴大,而且臨床上多有面部的皮脂腺瘤;③生理性鈣化,CT和MRI上可表現為基底節區對稱性的鈣化,絕大多數出現在40歲以上,但患者無神經系統異常表現,且鈣化灶較小。此外還應與堿性磷酸酶活性紊亂的疾病及外傷后血腫后遺癥等鑒別。
總之,Fahr病的主要特點為:①癥狀多種多樣,一般呈進行性發展,主要為運動障礙和認知精神障礙;②CT和MRI表現為基底節區、丘腦、小腦齒狀核對稱性鈣化和大腦灰白質交界區多發鈣化;③實驗室檢查血清鈣和血清磷均在正常范圍內,且甲狀腺功能和甲狀旁腺素正常。當影像學上發現顱內鈣化時,結合患者的臨床表現和實驗室檢查可以對Fahr病做出明確的診斷。
[1]蔣雨平,楊柳.特發性兩側對稱性大腦基底節鈣化癥[J].臨床神經病學,1994,1:105-106.
[2]鐘心,朱廷敏,潘桂芬,等.Fahr病的CT診斷(附11例報告)[J].中華放射學雜志,1998,32(2):122-123.
[3]余桂軍,倪冬艷.家族性Fahr病[J].中國臨床神經科學,2001,9(2):190-192.
[4]羅杰峰,秦超,李偉雄.家族性Fahr病[J].廣西醫科大學學報,2006,23(6):949-950.
[5]Benke T,Karner E,Seppi K,et al.Subacute dementia and imaging correlates in a case of Fahr’s disease[J].J Neurol Neurosurg Psychiatry,2004,75(8):1163-1165.
[6]Narita K,Murata T,Ito T,et al.A case of diffuse neurofibrillary tangles with calcification[J].Psychiatry Clin Neurosci,2002,56(1):117-120.
[7]李小元,陳先文.Fahr病的臨床與病因學[J].腦與神經疾病雜志,2008,16(3):239-241.
[8]Bottcher J,Sauner D,Jentsch A,et al.Visualization of symmetric striopallidodentate calcinosis by using high-resolution susceptibility-weighted MR imaging[J].Nervenarzt,2004,75(4):355-361.
[9]Mahy N,Prats A,Riveros A,et al.Basal ganglia calcification induced by excitotoxicity:an experimental model characterised by electron microscopy and X-ray microanalysis[J].Acta Neuropathol,1999,98(3):217.
[10]Rossi M,Morena M,Zanardi M.Calcification of the basal ganglia and Fahr disease.Report of two clinical cases and review of the literature[J].Recenti Prog Med,1993,84(3):192.
[11]黃福元,耿道穎,沈天真.Fahr病的CT和MRI診斷[J].醫學影像學雜志,2001,11(5):288-289.

