強骨膠囊治療骨質疏松性股骨轉子間骨折的臨床觀察
劉國輝 陳 東 楊述華 朱建福 肖 飛 張 鵬
華中科技大學同濟醫學院附屬協和醫院骨科,武漢 430022
隨著社會老齡化的不斷發展,原發性骨質疏松癥患者逐年增多,由此而引發的骨折也在上升,嚴重危害老年人的健康。骨質疏松性骨折是一種隨年齡增加而骨量減少、骨顯微結構異常、骨脆性增加、僅因輕度暴力或非創傷因素導致的骨折,好發于脊柱、股骨轉子間及尺橈骨遠端[1]。骨質疏松性骨折屬重度骨質疏松癥,外科治療的同時應注意原發病——骨質疏松的治療,提高骨質量,防止骨折不愈合及再骨折的發生。尋找有效的藥以預防骨量的進一步減少,緩和或制止骨質疏松的發展是目前研究的熱點。2005年6月~2007年8月筆者應用強骨膠囊對原發骨質疏松性股骨轉子間骨折患者進行臨床觀察,探討其治療骨質疏松及促進骨折愈合的影響。
1 資料與方法
1.1 診斷標準
參考《中國人原發性骨質疏松癥診斷標準(試行)》之診斷標準[2],骨密度(BMD)<M-2SD(M為同種族、同性別、同部位骨峰值骨量均值,SD為標準差),伴一處或多處骨折為嚴重骨質疏松癥。
1.2 排除標準
繼發性骨質疏松癥,如慢性腹瀉、甲狀腺功能亢進、甲狀旁腺機能亢進、糖尿病、類風濕性關節炎、骨腫瘤等疾病引起的骨質疏松,以及原發性骨質疏松癥合并有嚴重心血管、肝腎和血液系統等疾病及精神病患者。
1.3 一般資料
59例均符合原發性骨質疏松癥診斷標準,BMD<M-2SD。其中男9例,女50例,年齡51~75歲,平均64歲。按性別相同、年齡相近、骨折部位和類型相同、身高和體重相近、骨折復位固定方法相同的原則,將患者隨機分成治療組及對照組。治療組30例,其中男5例,女25例,平均年齡(63.6±5.8)歲;BMD為(0.631±0.095)g/cm2。對照組29例,其中男3例,女26例,平均年齡(63.2±5.4)歲;BMD為(0.625±0.092)g/cm2。經檢驗,兩組年齡、性別、治療前BMD值均無明顯差異(P>0.05),具有可比性。
1.4 治療方法
兩組患者骨折行開放復位內固定術后,抬高患肢,適當活動下肢各關節,促進腫脹消退。治療組口服強骨膠囊(為中藥骨碎補的提取物,主要成分骨碎補總黃酮,每粒含骨碎補總黃酮180 mg,北京歧黃制藥有限公司生產),1次1粒,1日3次。對照組服用鈣爾奇D片((相當于鈣600mg,維生素D 125 IU,惠氏-百宮制藥有限公司生產),1次2片,1日1次。兩組均連續服用3個月,治療期間均不用其他補腎、止痛、補鈣或其他治療骨質疏松癥的藥。
1.5 觀察項目及檢測方法
1.5.1 X線檢查 骨折復位、固定后每月行X線攝片,了解骨折對位及愈合情況。根據骨痂形成情況及患者骨折局部檢查情況判定骨折愈合時間,并決定下床行走時間(骨折愈合標準:局部無壓痛及縱向叩擊痛,無反常活動;X線攝片示骨折線模糊伴連續骨痂形成;下肢不扶拐能在平地連續行走3min,并不少于30步)。
1.5.2 BMD測定 用藥前及用藥結束時檢測患者股骨頸BMD作為評價骨質狀態的指標。所有BMD檢查均為同一人員操作,同一臺測定儀檢測。
1.5.3 不良反應 觀察兩組治療期間出現的對藥的不良反應,并記錄其癥狀、程度、發生和持續時間、處理及轉歸。
1.6 統計學處理
2 結果
2.1 兩組骨折愈合時間及X線攝片
兩組服藥1個月時行X線檢查,兩組比較差異不明顯,骨折線均較為清晰,有少量骨痂形成。2個月時,治療組骨皮質較前增厚,骨痂形成較對照組增多,骨折線模糊變淡;而對照組骨皮質無明顯變化,骨折線仍較為清晰。骨折愈合時間,治療組為(9.3±2.6)周,對照組為(12.4±2.8)周,兩組比較差異有統計學意義(P<0.05)。
2.2 兩組治療前后BMD測定
治療組治療后BMD明顯升高,與治療前比較差異有統計學意義(P<0.05);對照組治療后BMD也有所升高,但治療前后比較差異無統計學意義;兩組間治療后BMD比較,差異有統計學意義(P<0.05)。見表1。
表1 兩組治療前后BMD值比較(±s)
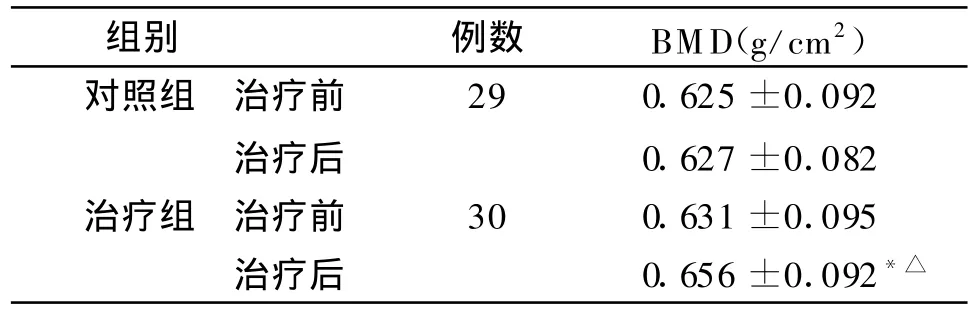
表1 兩組治療前后BMD值比較(±s)
與治療前比較*P<0.05;與對照組比較△P<0.05
組別 例數BMD(g/cm2)對照組 治療前29 0.625±0.092治療后0.627±0.082治療組 治療前30 0.631±0.095治療后0.656±0.092*△
2.3 不良反應
兩組治療期間均未出現明顯對藥的不良反應,僅治療組有5例患者治療初期出現輕度惡心、腹脹、便秘,經飲食調節后癥狀緩解。
3 討論
中醫學認為骨質疏松性骨折是由于腎虛精虧,后天脾胃失養,外邪侵襲所致。現代醫學認為增齡所導致的骨量減少、骨脆性增高是骨質疏松性骨折發生的主要原因[1]。骨強度取決于骨礦密度,低骨密度與骨質疏松性骨折的發生率有密切關系。前瞻性研究表明,BMD每下降1SD,骨折的危險性就增加1.5~2.5倍[3]。在本研究中,所有患者BMD檢測均<M-2SD,發生的骨折都是在行走或騎自行車時不慎摔倒導致,都非高能量暴力損傷。肢體骨折后需行肢體固定制動,但肢體制動后可誘發局部及鄰近部位骨質疏松的發生,對已發生骨質疏松性骨折的患者更為不利。因此,選擇合適的藥治療,促進骨折愈合及提高BMD是非常重要的。目前防治骨質疏松癥的藥主要有雙膦酸鹽類、降鈣素類、雌激素類、鈣和維生素D 3等,雖然療效較好,但副作用也較為明顯。中藥治療通過對機體全身性的調節作用,標本同治,達到糾正機體激素失衡和負鈣平衡作用的功效,既抑制骨吸收,又促進骨形成。
骨碎補自古以來就作為一種骨傷科的良藥,強骨膠囊的主要成分為骨碎補總黃酮,為中藥骨碎補提取的有效成分,具有補腎、壯骨、強筋、活血的功能。動物實驗證實,在骨愈合過程中,骨碎補對TGF-β1m RNA、BMP-2 m RNA基因表達具有益的調節作用,能夠促進間充質細胞向成骨細胞系及成軟骨細胞系分化,并能促進其合成活性[4],促進成骨細胞分化和增殖[5],增加骨痂厚度,增加TGF-β1在骨痂組織中的表達,提高骨折的愈合質量[6],增加骨組織承載力,提高骨骼抵抗外力沖擊的能力,改善骨結構力學特性[7]。在本臨床研究中,治療組服用強骨膠囊后,僅有5例患者出現惡心和腹脹,但程度輕微,飲食調節后可緩解。中國中醫研究院西苑醫院、中日友好醫院、中國中醫研究院廣安門醫院聯合研究,對68例原發性骨質疏松癥患者隨機分為強骨膠囊組和中藥對照組(淫羊藿、續斷、赤芍、川芎等,為中藥三類新藥),治療6個月,強骨膠囊組患者的雌二醇、睪丸酮、卵泡刺激素、黃體生成激素水平均有明顯提高。治療3個月,強骨膠囊組患者的甲狀旁腺激素(PTH)水平明顯下降;治療6個月,強骨膠囊組患者的降鈣素(CT)水平顯著升高。試驗結果證實,強骨膠囊治療原發性骨質疏松癥,可以通過抑制骨吸收,提高性激素及促性腺激素水平而達到提高BMD、改善臨床癥狀的目的[8]。強骨膠囊服用后患者體內代謝發生變化,可調節血鈣、PTH、CT、骨和血中的堿性磷酸酶、骨鈣素水平,抑制骨的吸收,促進骨的形成,從而改善骨的結構,促進骨折的愈合,縮短骨折的愈合時間。
此外,強骨膠囊還具有鎮痛作用。王和鳴等[9]采用隨機分組、雙盲雙模擬對照的試驗方法,對61例骨量減少及162例骨質疏松患者進行臨床觀察,結果證實強骨膠囊(骨碎補總黃酮)對骨量減少和骨質疏松患者骨痛有治療作用。本研究中治療組早期下床活動,又避免了局部骨質疏松的加重和減少并發癥的出現。因此,強骨膠囊為臨床治療骨質疏松癥提供了新的選擇。
[1] GUZEL-CIESLAK D.Current view s on the causes,diagnosis,and treatment of osteoporosis[J].O rtop Traumatol Rehabil,2003,5(1):107-112.
[2] 劉忠厚,楊定焯,朱漢民,等.中國人原發性骨質疏松癥診斷標準(試行)[J].中國骨質疏松雜志,1999,5(1):1-3.
[3] 何耀華,邱貴興.骨質疏松診斷與骨密度測量[J].中國骨質疏松雜志,1998,4(2):66-70.
[4] 王林,汪建平.骨質疏松癥的預防和治療進展[J].西北藥學雜志,2003,18(5):231-234.
[5] 王和鳴,田金洲,彭淑蓮,等.強骨膠囊治療骨質疏松早期骨量減少的臨床觀察[J].中國骨傷,2003,16(11):692-694.
[6] 謝雁鳴,趙晉寧,丁會,等.強骨膠囊抗維甲酸所致大鼠骨質疏松癥的實驗研究[J].中國中醫藥科技,2000,7(3):151-152.
[7] 謝雁鳴,鞠大宏,趙晉寧.骨碎補總黃酮對去卵巢大鼠骨密度和骨組織形態計量學影響[J].中國中藥雜志,2004,29(4):343-346.
[8] 謝雁鳴,崔天紅,高蕊,等.強骨膠囊治療原發性骨質疏松癥(腎陽虛證)的臨床[J].中藥新藥與臨床藥理,2000,11(4):197-201.
[9] 王和鳴,葛繼榮,田金洲,等.強骨膠囊(骨碎補總黃酮)治療骨質疏松癥骨痛的療效觀察[J].中國中醫骨傷科雜志,2005,13(6):38-42.

