沙丁胺醇直接競爭ELISA法快速測定
王保玲,袁利鵬,雷紅濤,*,徐振林,楊金易,孫遠明,丁 武,龐 杰
(1.西北農林科技大學食品科學與工程學院,陜西 楊凌 712100;2.廣東省食品質量安全重點實驗室,華南農業大學食品學院,廣東 廣州 510642;3.福建農林大學食品科技學院,福建 福州 350002)
沙丁胺醇直接競爭ELISA法快速測定
王保玲1,2,袁利鵬2,雷紅濤2,*,徐振林2,楊金易2,孫遠明2,丁 武1,龐 杰3
(1.西北農林科技大學食品科學與工程學院,陜西 楊凌 712100;2.廣東省食品質量安全重點實驗室,華南農業大學食品學院,廣東 廣州 510642;3.福建農林大學食品科技學院,福建 福州 350002)
建立沙丁胺醇的直接競爭ELISA(dcELISA)快速檢測方法,采用高碘酸鈉法制備辣根過氧化物酶標記沙丁胺醇單克隆抗體,棋盤滴定法確定包被抗原質量濃度和抗體稀釋倍數,通過單因素試驗,考察反應體系中表面活性劑、離子濃度、甲醇體積分數、pH值因素對dcELISA性能的影響,確定最優檢測條件,同時考察方法的特異性。結果表明:酶標抗體克分子比為2.1時偶合物的滴度最高,最佳反應條件為包被抗原質量濃度1μg/mL,酶標抗體稀釋2560倍,0.01mol/L、pH7.4的磷酸鹽抗體稀釋液(PBS)中含體積分數0.05%的Tween-20、0.5mol/L NaCl溶液和體積分數5%的甲醇時dcELISA具有最高的靈敏度和最好的穩定性,所建立方法的IC50為10.3ng/mL,檢測限為0.049ng/mL,線性范圍0.3~76.30ng/mL,批內變異系數13.8%,批間變異系數為22.38%,與克倫特羅交叉反應率為321.18%,與溴布特羅交差反應率為29.09%,與其他結構類似物沒有明顯交叉反應。本研究所建立的dcELISA可用于沙丁胺醇和克倫特羅的多殘留檢測。
沙丁胺醇;酶標抗體;直接競爭ELISA
近年來,“瘦肉精”克倫特羅常被發現非法添加在動物飼料中以增加飼料報酬率,導致嚴重的瘦肉精中毒事件時有發生[1-3],政府監管力度也因此不斷加強,為逃避監管,不法者不斷尋找新的“瘦肉精”替代品。沙丁胺醇(salbutamol,SAL)是一種類似克倫特羅的β-腎上腺素興奮劑,在臨床上常用于防治哮喘和支氣管痙攣,但攝入過量則會導致心悸、頭疼、目眩、惡心甚至損害肝腎[4],其殘留嚴重危害著人們的身體健康和生命安全。作為一種潛在的“瘦肉精”替代品,很有必要加強沙丁胺醇的監控。
目前國內外對沙丁胺醇殘留的檢測主要采用儀器分析方法[5-8]。儀器設備檢測雖然準確、靈敏,但設備昂貴,樣品前處理復雜,需要專業人員才可操作,不適于大量樣品的篩選檢測。免疫分析方法操作簡便、快捷、高通量、靈敏度高,目前已經成為食品安全快速篩選檢測的主要方法之一。Pou等[9]和Collins等[10]分別建立沙丁胺醇放射免疫分析,其檢測限可以達到0.01ng/mL和0.04ng/g,但由于放射免疫分析的特殊性,使這一技術無法得到普遍的應用。盡管已有沙丁胺醇ELISA的研究報道[11-13],但都為間接競爭法,至今國內外尚未見采用酶標抗體模式的沙丁胺醇的直接競爭ELISA(dcELISA)報道。本實驗通過研究酶標抗體克分子比,優化dcELISA檢測條件,建立一種酶標抗體直接競爭的沙丁胺醇ELISA檢測方法。
1 材料與方法
1.1 試劑與儀器
硫酸沙丁胺醇(純度99.5%) 華南農業大學獸藥廠;克倫特羅(純度99.5%)、萊克多巴胺(純度99.5%) 美國Sigma公司;異丙腎上腺素(純度99%)、溴布特羅(純度99%)、去甲腎上腺素(純度99%) 廣州偉伯化工有限公司;沙丁胺醇單克隆抗體 本實驗室制備;辣根過氧化物酶(HRP) 武漢博士德生物工程有限公司;高碘酸鈉(分析純)、硼氫化鈉、乙二醇 廣州化學試劑廠;硫酸銨 廣州臺山粵橋化工廠;Tween-20(進口分裝) 廣州市醫藥公司;四甲基聯苯胺(TMB) 國藥集團化學試劑公司;其他均為國產分析純。
96孔可拆酶標板 廈門運鵬科技有限公司;Multiskan MK3酶標儀、Wellwash MK2洗板機 美國Thermo公司。
1.2 方法
1.2.1 酶標記抗體
采用高碘酸鈉法[14],用HRP辣根過氧化物酶標記沙丁胺醇單克隆抗體。
1.2.2 dcELISA操作步驟
包被液(CBS)、稀釋液(PBS)、洗滌液(PBST)、封閉液、TMB底物溶液、終止液均按文獻[14]方法配制。
用包被液稀釋SAL-OVA到質量濃度為1μg/mL,加到酶標板孔中,100μL/孔,4℃冰箱過夜;甩干孔中液體,用蒸餾水洗滌4次,甩干。每孔加入3g/100mL脫脂奶粉(用包被液溶解)200μL,37℃溫箱中孵育3h,甩干孔中液體用蒸餾水洗滌1次,置37℃烘箱中2h備用;稱量皿稱取SAL 2mg,用1mL抗體稀釋液溶解,連續10倍稀釋成2×106、2×105、2×104、2×103、2×102、2×101、2、2×10-1、2×10-2ng/mL;抗體稀釋液稀釋2560倍;每孔加入SAL標準液和HRPMcAb各50μL,輕搖混合,37℃溫箱中孵育1h,蒸餾水洗滌4次,甩干,加顯色液,3 7℃溫箱中顯色15min,加入終止液,測A450nm值。
1.2.3 數據分析
采用Origin 7.5軟件的四參數對數函數進行曲線擬合,見式(1)。

式中:y為450nm波長處的吸光度;x為沙丁胺醇的質量濃度;A為曲線漸進線最大值,沙丁胺醇濃度等于0時的吸光度,即Amax;B為曲線回折點處的斜率,即50%的Amax在曲線上對應點的斜率;C為曲線回折點對應的x值,等于50%的Amax所對應的沙丁胺醇質量濃度,即I C50;D為曲線漸進線最小值,等于背景值。繪制出競爭性ELISA檢測曲線后,通過比較Amax和IC50以及Amax/IC50評價曲線性能[15-16]。
1.2.4 理化因素影響
采用棋盤滴定法確定出不同包被抗原質量濃度下的酶標抗體工作質量濃度,然后比較不同包被抗原質量濃度下的dcELISA曲線參數,篩選出最適工作質量濃度。通過單因素試驗,考察稀釋液中不同含量的Tween-20、NaCl溶液、有機溶劑甲醇溶液以及pH值對dcELISA檢測性能的影響。
1.2.5 沙丁胺醇dcELISA特異性分析
以交叉反應率(CR)評價方法的特異性。

2 結果與分析
2.1 酶標抗體篩選
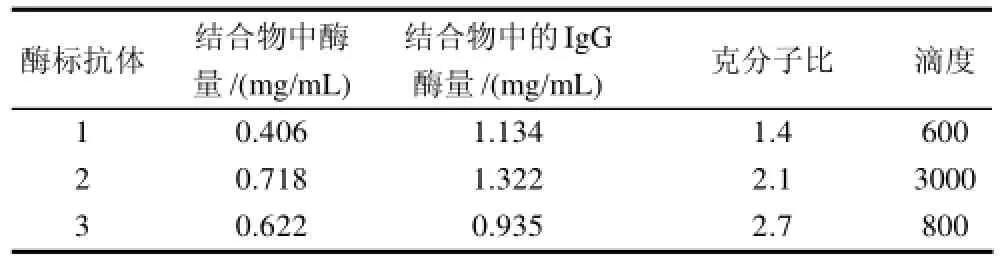
表1 酶標抗體克分子比對滴度的影響Table1 Effect of molar ratio of enzyme-labeled antibody on its titer
一般酶標抗體克分子比在1.5~2.0活性最好,過低過高都有可能影響酶活或抗體結合親和力[17]。本實驗制備3種不同結合比的酶標抗體,分別與包被抗原反應,活性鑒定(表1)發現,克分子比為2.1的偶聯物的滴度最高,可達3000,明顯高于克分子比1.4和2.7的酶標抗體,因此,最終采用抗體克分子比為2.1的酶標記抗體進行隨后實驗。文獻[17]報道克分子比在1.5~2.0時效果最好,本研究結果與其報道基本一致。
2.2 包被抗原質量濃度的篩選
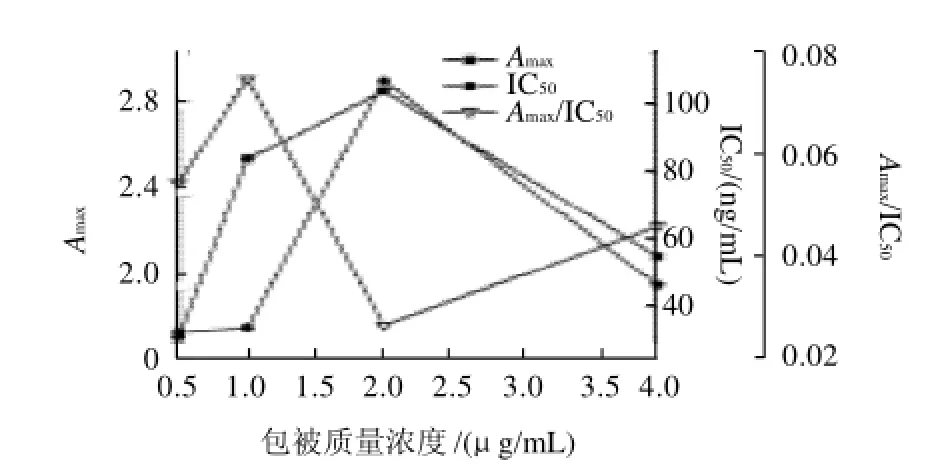
圖1 包被抗原質量濃度對Amax、IC50和Amax/IC50的影響Fig.1 Effect of coating concentration on Amax, IC50and Amax/IC50
包被抗原質量濃度會影響標準曲線的靈敏度,包被的質量濃度越小,與游離抗原的競爭力就會減弱,這樣會使曲線的靈敏度增加,但是包被質量濃度太小,就會影響Amax和曲線的穩定性。由圖1可知,Amax和IC50在包被抗原質量濃度0.5~2μg/mL呈現逐漸增大的趨勢,2 μ g/mL達最大,以后又明顯降低。Amax/IC50在1.0μg/mL達最大值。由于1.0μg/mL包被抗原質量濃度時IC50值較小,且Amax/IC50最大,表明該包被抗原質量濃度下靈敏度最高。因此,在以后的實驗中選擇包被抗原質量濃度1μg/mL。
2.3 Tween-20體積分數對反應的影響

圖2 Tween-20體積分數對Amax、IC50和Amax/IC50的影響Fig.2 Effect of Tween-20 amount on Amax, IC50and Amax/IC50
Tween-20是免疫分析中一種常用的表面活性劑,可以減少非特異性吸附,且可以保護抗體減少失活,尤其是可以提高酶標抗體的滴度[17]。本研究在稀釋緩沖液中添加不同體積的Tween-20,分析其對SAL-dcELISA的影響(圖2)。稀釋液不含Tween-20時抗體的效價很低,靈敏度很低。Tween-20體積分數為0.025%~0.05%時,IC50從2.0ng/mL降低到1.1ng/mL,Amax從1.1升高到1.6,Amax/IC50從1.1大幅度增加到2.0,即Tween-20體積分數為0.05%時達到最大值,說明此時曲線的靈敏度最高。Tween-20體積分數0.1%以上時,Amax大致呈上升趨勢,趨于平穩。IC50變化不大,Amax/IC50開始大幅度降低,即靈敏度開始降低。綜合比較后Tween-20體積分數為0.05%時,靈敏度最高,因此確定稀釋液中Tween-20體積分數為0.05%時為最佳。
2.4 NaCl濃度對dcELISA的影響
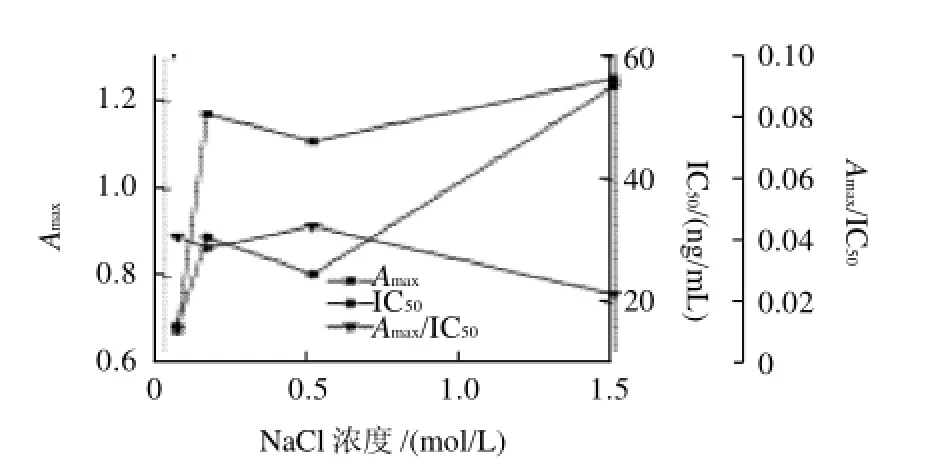
圖3 NaCl濃度對Amax、IC50和Amax/IC50的影響Fig.3 Effect of NaCl concentration on Amax, IC50and Amax/IC50
溶液的離子濃度通常會影響抗體和酶的活性,所以會影響抗原抗體相互作用。為考察離子濃度對沙丁胺醇dcELISA的影響,本研究選用pH7.4的0.01mol/L的PBS配制含0.05、0.15、0.5、1.5mol/L NaCl的反應體系進行反應,結果如圖3所示。在0.05~0.15mol/L NaCl濃度范圍內,隨著NaCl濃度增大,Amax值迅速增大,這說明在低離子濃度范圍內,增大離子濃度有利于抗原抗體結合反應;在0.15~1.5mol/L NaCl濃度范圍內,Amax和IC50隨著NaCl濃度增大而呈現先降低又升高的趨勢,在1.5mol/L時達到最大。Amax/IC50在0.5mol/L時達到最大,此時靈敏度最高,故在以后反應體系中使用0.5mol/L NaCl。
2.5 甲醇體積分數對dcELISA的影響

圖4 甲醇體積分數對Amax、IC50和Amax/IC50的影響Fig.4 Effect of methanol amount on Amax, IC50and Amax/IC50
甲醇經常作為一種促溶劑使用在ELISA中[17]。本研究考察反應體系中甲醇體積分數對沙丁胺醇dcELISA的影響(圖4)。Amax隨著甲醇體積分數的增大逐漸降低,IC50的整體表現為先降低又升高,甲醇體積分數為5%時降到最低點,此時Amax/IC50在5%甲醇溶液時達到最大,Amax在1.8~1.9之間,吸光度比較穩定,靈敏度也較高,故在以后反應體系中甲醇體積分數為5%。
2.6 最適pH值的確定
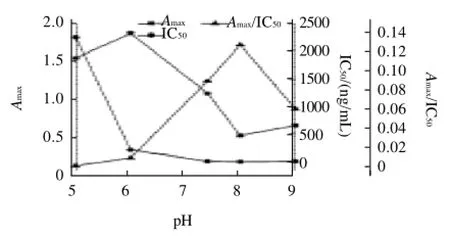
圖5 pH值對Amax、IC50和Amax/IC50的影響Fig.5 Effect of pH on Amax, IC50and Amax/IC50
pH值主要影響抗體和酶的等電點,從而影響抗原抗體的相互作用[17]。本研究發現(圖5)Amax隨著pH值增大出現減小的趨勢,對抗原抗體的結合影響較大。pH值在5.0~6.0時IC50太大,Amax/IC50很小,表明靈敏度較差。pH值大于7.4時,已經明顯影響了抗體和酶的活性,Amax小于0.7,不適合ELISA檢測,綜合考慮,pH7.4時,IC50較低,Amax達到1.1,靈敏度較好,故確定反應最佳的pH值為7.4。
2.7 標準曲線的繪制
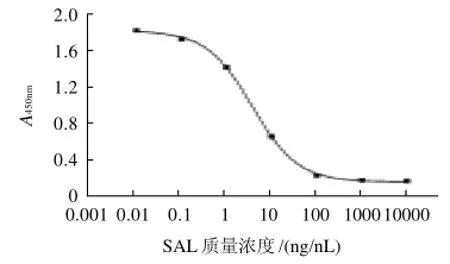
圖6 沙丁胺醇標準曲線Fig.6 Standard curve of salbutamol
根據以上優化的條件建立標準曲線(圖6),該曲線IC50為10.3ng/mL,檢測限(90%結合率時沙丁胺醇質量濃度)為0.049ng/mL,檢測范圍(20%~80%結合率時的沙丁胺醇質量濃度)為0.23~76.30ng/mL,批內變異系數13.8%,批間變異系數為22.38%。
2.8 dcELISA的特異性

表2 沙丁胺醇的交叉反應Table2 Cross-reactivity of the method
在幾種β-興奮劑對SAL酶標記抗體的交叉反應曲線中,發現SAL單克隆抗體與克倫特羅、溴布特羅都有高的交叉反應(表2),其中與克倫特羅交叉反應率為321.18%,與溴布特羅交差反應率為29.09%,與其他結構類似物幾乎沒有明顯交叉反應。
3 討 論
對于農獸藥小分子的ELISA檢測模式一般包括間接競爭ELISA和直接競爭ELISA兩種模式。間接競爭ELISA模式需要孵育2次,洗板2次,一般整個過程需要90~120min,操作時間偏長。本實驗室長期從事農獸藥小分子的免疫快速檢測研究,已經成功建立多個對象的直接競爭ELISA方法[18-19]。該方法只需孵育1次,洗板一次,相對于間接競爭ELISA的操作時間減少一半以上,在實際應用中具有顯著優勢,非常利于開發商業試劑盒。
ELISA反應條件如包被抗原質量濃度、抗體稀釋倍數、離子濃度、p H值對其靈敏度具有重要影響。例如非水介質對免疫反應的影響一直是低水溶性化合物免疫方法建立過程中的一個重要問題[18]。沙丁胺醇微溶于水,較易溶于甲醇,本實驗重點研究樣品稀釋液對ELISA檢測沙丁胺醇的影響,結果表明:甲醇體積分數為5%時可以提高反應的靈敏度。同時,研究發現PBS中含0.5mol/L NaCl可以增強沙丁胺醇免疫分析靈敏度,其主要原因可能是溶液的離子強度增加,其疏水作用增加,而疏水作用是抗原抗體相互反應的一種主要作用力[17]。
此前,已有關于沙丁胺醇抗體制備研究報道。邱陽生等[20]所制備沙丁胺醇單抗對克倫特羅有50%的抑制率,史利軍等[21]得到的單抗對克倫特羅交叉反應率達100%。本實驗制備的沙丁胺醇單抗對克倫特羅交叉反應率為321.18%,這種反應性能尚未在其他沙丁胺醇反應模式中報道過。沙丁胺醇和克倫特羅結構上都具有叔丁氨基團,這個共有結構叔丁氨基可能是與抗體結合的特異性表位。本研究同時發現,沙丁胺醇單克隆抗體與萊克多巴胺和異丙腎上腺素幾乎沒有交叉反應,盡管萊克多巴胺和異丙腎上腺素的異丙胺基與沙丁胺醇的叔丁氨基很相似,這表明抗體的識別能力非常精細。本實驗所建立的酶標抗體直接競爭模式適合同時檢測沙丁胺醇和克倫特羅,用于兩種藥物的同時篩查。
[1]吳日鈞. 關于瘦肉精檢測的幾點思考[J]. 豬業科學, 2009, 26(6): 50-51.
[2]龐蘇納, 于芳. “瘦肉精”及其危害簡介[J]. 新疆畜牧業, 2009(3): 17.
[3]肖新李, 黃飛平, 臧清華. 鹽酸克倫特羅引起食物中毒225例[J]. 廣東醫學, 2002, 23(10): 1004.
[4]劉宣兵, 龐玉芳, 侯玉澤, 等. 沙丁胺醇的毒副作用及其殘留檢測[J].上海畜牧獸醫通訊, 2008(4): 83-85.
[5]GABIOLA C, CALONGE M A G, PORTILLO M P, et al. Validation of a method for the determination of salbutamol in animal urine by gas chromatography-mass spectrometry and its application to treated lamb samples[J]. Microcolumn Separations, 1996, 8: 361-364.
[6]COUPER B R, FIONA J, DRUMMER A D. Gas chromatogra mphicmass spectrometric determination of β2-agonists in post mortem blood: application in forensic medicine[J]. Chromatography Biomedical Scienceand Application, 1996, 685(2): 12-15.
[7]ZHANG Yantu, ZHANG Zhujun, SUN Yonghua, et al. Development of analytical method for the determination of β-agonist residues in animal tissues by high-performance liquid chromatography with on-line electrogenerated [Cu(HIO6)2]5--luminol chemiluminescence detection[J]. Agriculture and Food Chemistry, 2007, 55(13): 4949-4956.
[8]SOMSAK S, PROESPICHAYA K. Rapid analysis of clenbuterol, salbutamol, procaterol,and fenoterol in pharmaceuticals and human urine by capillary electrophoresis[J]. Talanta, 2008, 76(5): 1194-1198.
[9]POU K, ONG H, ADAM A, et al. Combined immunoextraction approach coupled to a chemiluminescence enzyme immunoassay for the determination of trace levels of salbutamol and clenbuterol in tissue samples[J]. Analyst, 1994, 119: 2659-2662.
[10]COLLINS S, O'KEEFFE M, SMYTH M R, et al. Mutli-residue analysis for beta-agonists in urine and liver sample using missed phase cloumns with deterrnination by radioimmunoassay[J]. Analysy, 1994, 119(10): 2671-2674.
[11]LEI Yichih, TSAI Yifen, TAI Yungte, et al. Development and fast screening of salbutamol residues in swine serum by an enzyme-linked immunosorbent assay in Taiwan[J]. Food Chem, 2008, 56(14): 5494-5499.
[12]SHEU Shiyuan, LEI Yichih, TAI Yungte, et al. Screening of salbutamol residues in swine meat and animal feed by an enzyme immunoassay in Taiwan[J]. Analytica Chimica Acta, 2009, 654(2): 148-153.
[13]MALUCELLI A, ELLENDORFF F, MEYER H H. Tissue distribution and residues of clenbuterol, salbutamol, and terbutaline in tissues of treated broiler chickens[J]. Animal Science, 1994, 72(6): 1555-1560.
[14]朱立平, 陳學清. 免疫學常用實驗方法[M]. 北京: 人民軍醫出版社, 2000: 351-357.
[15]GUO Yongen, CHEN Jiahua, WANG Nengdong, et al. Preparation and application of polyclonal antibody to butachlor[J]. Acta Scientiarum Naturalium Universitatis Pekinensis, 2002, 38(4): 447-452.
[16]MERCADER J V, MONTOYA A. A monoclonal antibody-based ELISA for the analysis of azinphos-methyl infruit juices[J]. J Agric Food Chem, 1997, 47(1): 95-101.
[17]楊利國, 胡少昶, 魏平華, 等. 酶免疫測定技術[M]. 南京: 南京大學出版社, 1998: 70-71.
[18]雷紅濤, 馮偉雯, 沈玉棟, 等. 除草劑丁草胺直接競爭ELISA檢測方法研究[J]. 農業環境科學學報, 2006, 25(4): 1018-1023.
[19]董雪, 鐘青萍, 黃安誠, 等. 河豚毒素直接競爭ELISA檢測方法的研究[J]. 現代食品科技, 2009(8): 977-981.
[20]邱陽生, 楊根海, 何方洋. 沙丁胺醇單克隆抗體的制備及鑒定[J]. 中國獸醫科學, 2002, 32(10): 25-26.
[21]史利軍, 楊正濤, 王艷, 等. 沙丁胺醇單克隆抗體的制備及其免疫學檢測方法的建立[J]. 中國獸醫雜志, 2006, 42(6): 12-14.
Direct Competitive Enzyme-linked Immunosorbent Assay for the Rapid Determination of Salbutamol
WANG Bao-ling1,2,YUAN Li-peng2,LEI Hong-tao2,*,XU Zhen-lin2,YANG Jin-yi2,SUN Yuan-ming2,DING Wu1,PANG Jie3
(1. College of Food Science and Engineering, Northwest A & F University, Yangling 712100, China;2. Key Laboratory of Food Quality and Safety of Guangdong Province, College of Food Science, South China Agricultural University, Guangzhou 510642, China;3. College of Food Science, Fujian Agriculture and Forestry University, Fuzhou 350002, China)
A direct competitive enzyme-linked immunosorbent assay (dcELISA) was developed for rapidly determining salbutamol. Horseradish peroxidase-labeled salbutamol monoclonal antibodies were synthesized by sodium periodate method. The optimal coating concentration and antibody dilution were determined by chequerboard titration. The effects of surfactants, ion concentration, methanol content and pH on the sensitivity of dcELISA were investigated by single-factor experiments. The results showed that the optimal molar ratio of enzyme-labeled antibody was 2.1. The optimized assay conditions for both the highest sensitivity and the best stability were as follows: coating antigen concentration, 1μg/mL; and dilution fold of antibodyenzyme conjugate in 0.01 mol/L pH 7.4 PBS dilution containing 0.05 % Tween-20, 0.5 mol/mL NaCl, and 5% methanol, 2560. The developed method presented an IC50of 10.3 ng/mL, a detection limit of 0.049 ng/mL, a linear range of 0.3 to 76.30 ng/mL, with an intra-batch CV of 13.8 % and an inter-batch CV of 22.38%, and 321.18% and 29.09% cross-reactivity rates with clenbuterol and brombuterol, respectively, without notable cross-reactivity with other structural analogues of salbutamol. This study provides valuable experimental data for developing a commercial immunoassay kit for the rapid determination of multiresidues of salbutamol and clenbuterol.
salbutamol;enzyme-labeled antibody;direct competitive ELISA
S859.84
A
1002-6630(2010)20-0270-05
2010-01-06
國家自然科學基金項目(20877029;30700663);“十一五”國家科技支撐計劃項目(2006BAD27B02-05);廣東省科技計劃項目(2009B040500002;zgzhzd0808)
王保玲(1984—),女,碩士研究生,研究方向為食品質量與安全。E-mail:wbl1326@foxmail.com
*通信作者:雷紅濤(1973—),男,副教授,博士,研究方向為食品安全、生物分析化學。E-mail:hongtao@scau.edu.cn

