持久性有機污染物的海洋動物胚胎毒理學研究進展
周海龍,曲 瑩,董 方,蘇 文,韋雙雙,鄭繼平,薛欽昭
(1.中國科學院 煙臺海岸帶可持續發展研究所,山東 煙臺 264003;2.海南大學 農學院,海南 海口570228;3.中國科學院海洋研究所,山東青島266071;4.中國科學院研究生院,北京100049)
持久性有機污染物(persistent organic pollutants,POPs)是指具有高毒性、持久性、生物蓄積性、半揮發性及長距離遷移性等特性的天然或人工合成的有機污染物[1]。它可通過空氣、水、土壤、食物鏈進行廣泛傳播,甚至能經母乳傳遞給嬰兒[2]。無論是在空氣、水體、土壤、生物體中,還是在南極、北極都發現了 POPs的存在[3]。大量研究表明 POPs在食物鏈傳遞過程中具有生物富集和生物放大效應[4],已嚴重威脅人類健康,例如:POPs對人的腦[5]、聽力[6],免疫[7]、生殖[8]、神經[9]等系統均有損害作用,POPs引發的環境污染問題已引起國際社會廣泛關注。
就海洋環境而言,POPs可通過河流、陸源、污染排放、溢油及大氣沉降等途徑進入海洋,導致海洋生態系統日趨惡化。POPs可直接對海洋動物胚胎產生急性或慢性毒理效應,特別是低等海洋動物,早期胚胎以浮游形式直接暴露于海洋環境,易受環境污染的影響。這對海洋動物種群繁衍、群落結構以及海洋生態系統等產生重要影響。胚胎期是海洋動物整個生命周期中對POPs最敏感、最脆弱的一個時期,故研究POPs對海洋動物的胚胎毒理不僅為揭示POPs在海洋動物體中的生物富集和毒理機理具有重要的理論意義,而且在海洋動物保護和繁育以及海洋生態環境恢復等領域具有重要的指導價值。本工作將對 POPs在海洋動物胚胎中的分布、毒理效應和分子毒理響應機制等方面進行綜述和探討,為揭示POPs生態毒理效應和海洋生態系統健康評價提供一定的科學依據。
1 POPs在海洋動物胚胎中的分布
POPs屬于親脂疏水性物質,在生物體內難降解,并呈現出生物富集和沿食物鏈生物放大效應,其含量在機體組織內的分布與脂肪含量呈正相關[10]。中國學者對國內幾種主要的貝類和魚類[10~13]研究表明,貝類體內總多氯聯苯(Polychlorinated biphenyls,PCBs)、六六六(hexachlorocyclohexane,HCH)、滴滴涕(dichlorodiphenyltrichloroethane,DDT)質量(濕質量)比分別為:0.04~11.6 ng/g,5.70~30.2 ng/g,0.70~22.60 ng/g;魚體內 PCBs質量(濕質量)比為:1.25~16.4 ng/g。貝類和魚類POPs含量均低于海產品安全限量,其食用價值尚未受到影響。
POPs在海洋動物胚胎中同樣存在富集作用,且存在時空性。M?enp? ?等[14]利用五氯苯酚(pentachlorophenol,PCP,0.051~0.056μmol/L)對鮭魚受精卵的生物富集試驗表明,PCP在鮭魚胚胎內的分布和代謝與胚胎發育階段具有密切聯系。胚胎發育晚期比早期多富集量多,這可能與胚胎發育晚期呼吸頻率和代謝活動的加強有關。Broyles等[15]利用 2,3,4,5-四氯聯苯醚 (2,5,2′,5′-tetrachlorobiphenyl,TCB,500μg/L)對湖鱒進行暴露實驗。結果表明,當在胚胎期進行暴露時,鮭魚卵黃囊富集TCB的能力最強;但當胚胎發育到卵黃囊仔魚階段才進行暴露時,結果發現70%的 TCB分布在機體組織中,而不在卵黃中,這說明 TCB在組織中的分布還與暴露的時期有關。Broyles等[16]利用2,4,5,2′,4′,5′-六氯聯苯(2,4,5,2′,4′,5′-hexachlorobiphenyl,HCB)對湖鱒卵黃囊仔魚進行暴露試驗,暴露3個月后,一部分 HCB從仔魚體內消失。在第3個月時,大量的HCB分布于消化器官。總之,POPs在海洋動物胚胎中的分布與胚胎發育階段和胚胎暴露的時間,以及各組織器官(可能與脂肪含量有關)等因素有關,其分布規律有待進一步研究。
另外,POPs物質在海洋動物體內的分解代謝是一個非常復雜的過程,受多種因素的影響,包括動物的種類,POPs物質的類型,代謝途徑等。目前,科學家們雖已對 POPs的降解進行了大量的探索,但還沒找到一種理想的POPs降解辦法。值得注意的是海洋多毛類動物(如沙蠶)對多環芳烴(polycyclic aromatic hydrocarbons,PAHs)等 POPs物質具有很強的富集能力,J?rgensen等[17]報道,它們不含有芳香烴受體(aryl hydrocarbon receptor,AHR)同源物,說明它們對POPs物質的代謝存在不同的機制;對這一機制開展深入研究,或許是人類攻克 POPs污染問題的一個新突破口。
2 POPs的胚胎毒性
海洋動物胚胎多數在海水中生長發育,且對POPs物質非常敏感[18]。目前,主要就2,3,7,8-四氯二苯并二惡英(2,3,7,8-Tetrachlorodibenzo-pdioxin,TCDD)、DDT、PCB、苯并[a]芘 (Benzo[a]pyrene,B[a]P)、PAHs等POPs物質對斑馬魚、貽貝等模式動物的胚胎發育毒性進行了大量的研究,主要體現在胚胎形態及其心血管系統毒性作用等方面。雖然這些研究主要是針對少數模式動物,但對海洋動物胚胎毒理的研究仍具有重要的指導意義。
2.1 對胚胎形態的毒性作用
POPs對胚胎形態具有嚴重的損害作用,主要表現為胚胎水腫、出血、局部貧血和生長發育延緩,心血管發育和功能受損,頜畸形、死亡等現象[19];另外,Teraoka等[20]報道,TCDD對斑馬魚(Danio rerio)胚胎下頜軟骨的生長發育也有影響。Antkiewicz等[21]報道將斑馬魚胚胎暴露于 TCDD,通過三維立體測量發現:受精后72 h(hours post-fertilization,hpf)心臟組織體積顯著減小,特別是在受精后48 h時,心臟細胞總數量顯著減少,這說明心臟是 TCDD作用的一個重要靶器官。Kammann[22]和 Helder等[23]進一步研究發現,TCDD的胚胎毒性還存在著明顯的劑量效應關系,低質量濃度(0.1 ng/L)時導致生長延緩,進一步影響早期生長發育;高質量濃度(10 ng/L)時導致水腫甚至死亡。
另外,就胚胎毒性敏感性而言,不同的海洋動物之間也不同,十足類動物對殺蟲劑的毒性比海膽,海鞘更為敏感[24],真鯛(Pagrosomus major)對 TCDD最為敏感[25]。值得注意的是,滴滴伊(DDE)393 mmol/L,苯并[a]芘(B[a]P)13.2 mmol/L對兩棲類動物爪蟾的胚胎毒性不大,此濃度下其死亡率<10%,研究表明,這與它們的溶解度有關[26],而與TCDD被胚胎快速清除沒有關系[27]。導致胚胎毒性敏感性差異的原因,目前尚不清楚。
2.2 對心血管系統的毒性作用
心血管系統是胚胎發育毒性的第一個靶器官[28],心血管毒性除了與POPs的種類、劑量水平等因素有關外,還與海洋動物自身的物種、性別、發育階段等因素密切相關,呈現一種非線性關系[13]。Lema等[29]用多溴二苯醚47(Polybrominated diphenyl ethers,PBDEs 47)對斑馬魚胚胎進行毒性試驗發現:受精后20 h左右,會產生發育毒性;48 h,導致心肌細胞數減少,心臟體積變小,同時還會出現胚胎浮腫、出血等次級效應;96 h,發現心動過速,這由于房室傳導阻滯導致心率失常,說明胚胎不同發育階段其胚胎毒性作用不同。另外,Handley-Goldstone等[30]進一步研究表明,細胞色素氧化酶 P4501A(Cytochrome p450 1A,CYP1A),細胞色素氧化酶P4501B(Cytochrome p450 1B,CYP1B)及其它AHR通道基因也參與了 TCDD的毒理調控過程,通過改變肌鈣蛋白 T2和各種肌球蛋白的表達,從而導致擴張型心肌病。同時,脂肪酸和類固醇類物質代謝酶,核糖體和信號轉導蛋白均參與了 TCDD的胚胎期心血管毒性作用。
3 胚胎毒理機制的探索
胚胎毒理主要是由AHR通道基因及其相關信號通道相互協同作用調控的,其中AHR通道對于POPs的胚胎毒理調控具有重要作用。
3.1 A HR通道
對鮭魚[31]、大西洋鮭[32]、海豹[33]等多種海洋動物A HR基因結構和基本功能的研究表明,TCDD、HAH(halogenated aromatic hydrocarbons)、PAH等POPs毒性效應大都通過 AHR通道進行調節[34~36]。
在AHR調控通路過程中,A HR主要對CYP1和CYP2進行調控;其中CYP1A是一種外源性代謝酶,它往往被POPs所誘導。當 TCDD、PA H等物質進入細胞質后與AHR結合,然后A HR從熱休克蛋白90(heat shock protein 90,Hsp90)[37],X相關蛋白2(X-associated protein 2,XAP2)[38]和 23-ku的共伴侶分子(23-ku co-chaperone protein,p23)[39]組成的復合物解離,從細胞質轉移到細胞核中,與芳香烴受體核轉位蛋白(AHR nuclear translocator protein,ARN T)結合形成AHR/ARNT異二聚體,最后作用于CYP1A等靶基因的異物應答元件(xenobiotic response elements,XREs)序列,從而誘導靶基因的表達。同時,芳香烴受體抑制子(Aryl Hydrocarbon Receptor Repressor,AHRR)具有抑制A HR功能活性的作用,從而二者形成一個調控反饋回路[40](圖1)。雖然 TCDD誘導異物代謝酶(xenobiotic metabolizing enzymes,XMEs)的機理研究已很清楚,但像畸胎發生,免疫抑制等生物學效應A HR是如何參與調控的有待進一步研究。可以肯定 TCDD的毒性作用是通過AHR通道激活靶基因所致[40]。
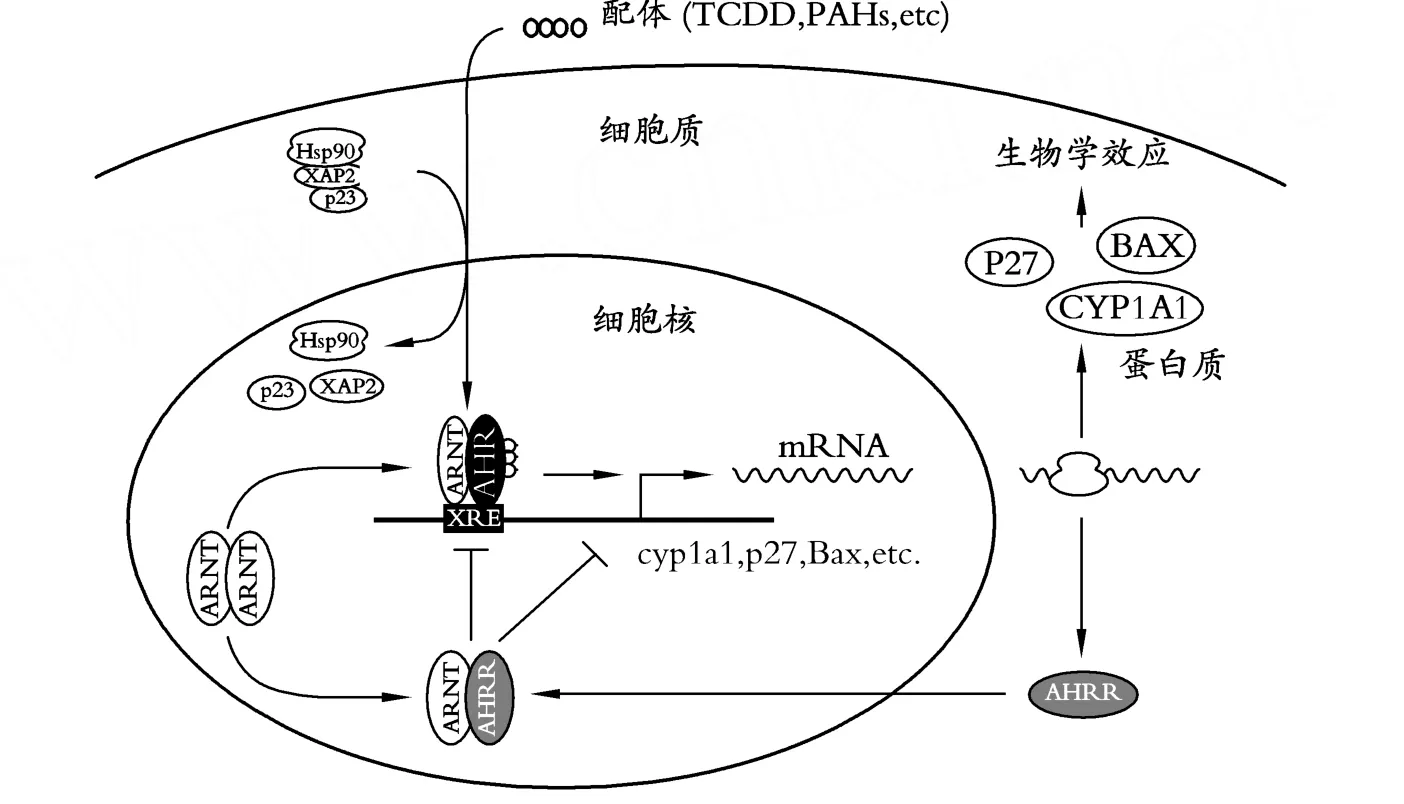
圖1 AHR通道的調控機制[40]
3.2 AHR對胚胎毒性的調控作用
A HR通道是海洋動物胚胎對 POPs物質毒性調控的一個重要通道,且不同基因型其作用大小不同。Carney等[41]對斑馬魚進行研究發現它具有AHR1(zebrafish aryl hydrocarbon receptor 1)和AHR2(zebrafish aryl hydrocarbon receptor 2)兩個基因,其中,zfAHR2具有轉錄活性,在調節 TCDD的胚胎毒性的過程中發揮主要作用,而zfAHR1不具有調節功能。如果被TCDD過度激活表達則會導致心臟形態和功能的改變,甚至死亡。另外,Yamauchi等[25]利用 TCDD對真鯛胚胎毒性試驗發現:rsAHR2(red seabream AHR2)mRNA表達的水平與 TCDD存在劑量效應關系,且rsAHR2和CYP1A mRNA間存在顯著正相關;而 rsAHR1(red seabream A HR1)的表達不受影響,rsAHR1和CYP1A間也沒有這種關系。故可以看出,AHR2在海洋動物胚胎毒性調控過程中發揮重要作用,而AHR1的作用相對較小。Carney等[42]進一步研究發現,斑馬魚胚胎毒性主要由zfARNT1(zebra fish aryl hydrocarbon receptor nuclear translocator 1)和zfA HR2進行調節,而zfAHR1和zfARN T2不具有調節功能,并且胚胎毒性不是通過zfCYP1A基因表達的增加來調節的。
另外,據 Mimura等[40]報道,AHRR基因通過與ARNT形成異二聚體體與XREs作用,從而競爭性抑制AHR基因的活性。但是,最近 Evans等[43]發現,雖然AHRR與靶基因異物應答元件會有助于抑制AHR的功能;但不是通過與ARNT結合或與XREs結合來抑制AHR基因功能,這里可能存在另外一種作用機制來反轉抑制(transrepression)AHR的功能,即通過蛋白與蛋白相互作用的方式來進行抑制AHR基因的功能。究竟是通過何種機理抑制的,這可借助于嗎啉寡聚核苷酸(morpholino oligonucleotides)等基因敲除技術來進一步探索AHRR在胚胎毒理過程中的作用。那么胚胎又是如何應對來自POPs物質的毒害作用呢?Welker等[44]研究表明,細胞色素 P4501A(CYP1A)和血紅素加氧酶1(hmox1)基因產物在胚胎發育過程中對于抵抗這類外源毒性物質的毒性具有重要作用。
綜上可知,A HR通道在海洋動物胚胎毒性調控過程中發揮著重要作用,但不同基因型在胚胎毒理調控過程中具有不同的作用,在海洋動物胚胎中AHR和ARNT分別由AHR2和ARNT1基因型來進行調控,而A HRR哪種基因型的作用更大以及其它動物是否遵循相同的胚胎毒理調控機理目前還不清楚,有待更進一步的研究。
3.3 毒性的協同作用
POPs的毒理調控是一個非常復雜的過程,除了與海洋動物種類,POPs物質種類,作用的時空性有關外,AHR受體還可與雌激素受體、低氧誘導受體、核因子B以及視網膜母細胞瘤蛋白等信號通道相互作用[45];進而改變細胞增殖,細胞周期阻滯或細胞凋亡的方向[46],最后表現特定的胚胎毒理效應。Ramakrishnan等[47]利用雙酚-A對青鳉胚胎暴露24 h,發現胚胎發育,孵化和成熟時間提前,這是由于雙酚-A通過甲狀腺激素通道改變了胚胎全局發育進程。當暴露24~96 h時,發現CYP1A活性的抑制導致代謝的改變或增加A HR激動劑的半衰期,從而增強AHR的活性,揭示出AHR與甲狀腺激素通道間存在協同作用。另外,Timme-Laragy等[48]利用PAHs同系物對斑馬魚胚胎作用,發現 PAHs同系物同時作用增加了胚胎毒性作用。綜上可知,在海洋動物胚胎POPs毒理調控過程中,不僅AHR受體與其它信號通道之間存在相互作用,而且 POPs同系物之間還存在協同作用。
4 展望
目前,POPs對海洋動物胚胎毒理的研究,主要集中在胚胎形態毒性,以及相關酶類的生理生化方面,其胚胎毒理機制研究較少。分子機理研究主要利用受到POPs污染的污水、沉積物和有害氣體這一類復合物作為研究對象;且集中于A HR通道的單個或少數幾個基因。實際上,POPs胚胎毒性作用會影響一系列相關毒理基因的表達,從而產生胚胎毒性作用,最終表現出胚胎畸形或死亡。究竟哪些基因參與這一表達調控過程,以及它們相互之間的時空表達關系又是如何作用的,這一系列問題可望隨著分子生物學和分子生物技術的發展而不斷得到解決。
另外,中國海產品由于 POPs物質含量超標導致出口創匯受阻時有發生,解決這一問題的關鍵在于要對海水水質進行早期的有效監控,這一問題需要從源頭抓起,而海洋動物(如貽貝)胚胎是一種非常靈敏有效的環境污染生物指示物,將其用來監測海水水質具有獨特的優勢(胚胎量大,易獲取,檢測周期短,靈敏有效,且不受倫理觀念約束等)。同時,它還可用于毒性物質的篩選以及藥物的臨床前篩選研究。已有研究表明,用牡蠣胚胎對廢水或海水進行毒性遺傳分析,是一種評價海洋環境風險的有效方法[49]。這些應用都離不開胚胎毒理機制的研究,故持久性有機污染物對海洋動物胚胎毒理的研究具有重要意義。
[1]David O.什么是持久性有機物染物?[A].持久性有機污染物控制研討會論文集 [C].北京:國家環保局,2001.9.
[2]Swain W R.Human health consequences of consumption of fish contaminated with organochlorine compounds[J].Aquatic Toxicology,1988,11(3-4):357-377.
[3]李霜,李朝林,吳維皚.多氯聯苯與人體健康 [J].中華勞動衛生職業病雜志,2005,23(4):316-319.
[4]朱才眾,熊鴻燕.環境持久性毒物研究進展概述 [J].疾病控制雜志,2005,9(4):331-335.
[5]Kimura-Kuroda J,Nagata I,Kuroda Y.Disrupting effects of hydroxy-polychlorinated biphenyl(PCB)congeners on neuronal development of cerebellar Purkinje cells:A possible causal factor for developmental brain disorders?[J].Chemosphere,2007,67(9):412-420.
[6]Herr D W,Goldey S E,Crofton K M.Developmental exposure to aroclor 1254 produces low-frequency alterations in adult rat brainstem auditory evoked responses[J].Fundamental and Applied Toxicology,1996,33(1):120-128.
[7]Davila D R,Davs D P,Campbell K.Role of alterations in Ca2+-associated signaling pathways in the immunotoxicity of polycyclic aromatic-hydrocarbons[J].Journal of Toxicology and Environmental Health,1995,45(2):101-126.
[8]Den Besten P J,Herwig H J,Smaal A C,et al.Interference of polychlorinated biphenyls(Clophen A50)with gametogenesis in the sea star,Asterias rubensL.[J].Aquatic Toxicology,1990,18(4):231-246.
[9]Kodavanti P R S.Neurotoxicity of persistent organic pollutants:possible mode(S)of action and further considerations[J].Dose-Response,2005,3(3):273-305.
[10]甘居利,賈曉平,李純厚,等.南海北部陸架區3種魚類多氯聯苯含量分布特征 [J].熱帶海洋學報,2007,26(2):69-73.
[11]劉仁沿,吳世培,王斌.長江口以北沿海主要經濟貝類中有機氯農藥和多氯聯苯的分布及評價 [J].海洋環境科學,1996,3:29-35.
[12]楊永亮,潘靜,李悅,等.青島近海沉積物PCBs的水平與垂直分布及貝類污染 [J].中國環境科學,2003,23(5):515-520.
[13]Yang R Q,Yao Z W,Jiang G B,et al.HCH and DDT residues in molluscs from Chinese Bohai coastal sites[J].Marine Pollution Bulletin,2004,48(7,8):795-799.
[14]M?enp? ?K A,Penttinen O P,Kukkonen J V K.Pentachlorophenol(PCP)bioaccumulation and effect on heat production on salmon eggs at different stages of development[J].Aquatic T oxicology,2004,68(1):75-85.
[15]Broyles R H,Noveck M I.Uptake and distribution of 2,5,2′,5′-tetrachlorobiphenyl in developing lake trout[J].Toxicology and Applied Pharmacology,1979,50(2):291-298.
[16]Broyles R H,Noveck M I.Uptake and distribution of 2,4,5,2′,4′,5′-hexachlorobiphenyl in fry of lake trout and Chinook salmon and its effects on viability[J].Toxicology and Applied Pharmacology,1979,50(2):299-308.
[17]J?rgensen A,Giessing A M B,Rasmussen L J,et al.Biotransformation of polycyclic aromatic hydrocarbons in marine polychaetes[J].Marine Environmental Research,2008,65(2):171-186.
[18]Lange M,Gebauer W,Markl J,et al.Comparison of testing acute toxicity on embryo of zebrafish,Brachydanio rerio and RTG-2 cytotoxicity as possible alternatives to the acute fish test[J].Chemosphere,1995,30(11):2 087-2 102.
[19]Goldstone H M H,Stegeman J J.Molecular mechanisms of 2,3,7,8-tetrachlorodibenzo-p-dioxin cardiovascular embryotoxicity[J].Drug Metabolism Reviews,2006,38(1,2):261-289.
[20]Teraoka H,Dong W,Ogawa S,et al.2,3,7,8-tetrachlorodibenzo-p-dioxin toxicity in the zebrafish embryo:Altered regional blood flow and impaired lower jaw development[J].Toxicological Sciences,2002,65(2):192-199.
[21]Antkiewicz D S,Burns C G,Carney S A,et al.Heart malformation is an early response to TCDD in embryonic zebrafish[J].Toxicological Sciences,2005,84(2):368-377.
[22]Kammann U,Vobach M,Wosniok W.Toxic effects of brominated indoles and phenols on zebrafish embryos[J].Archives of Environmental Contamination and Toxicology,2006,51(1):97-102.
[23]Helder T.Effects of 2,3,7,8-tetrachlorodibenzodioxin(TCDD)on early life stages of rainbow trout(Salmo gairdneriRichardson)[J].Toxicology,1981,19(2):101-112.
[24]Bellas J,Beiras R,Marińo-Balsa J C,et al.Toxicity of organic compounds to marine invertebrate embryos and larvae:A comparison between the sea urchin embryogenesis bioassay and alternative test species[J].Ecotoxicology,2005,14(3):337-353.
[25]Yamauchi M,Kim E Y,Iwata H,et al.Toxic effects of 2,3,7,8-tetrachlorodibenzo-p-dioxin(TCDD)in developing red seabream(Pagrus major)embryo:An association of morphological deformities with AHR1,AHR2 and CYP1A expressions[J].Aquatic Toxicology,2006,80(2):166-179.
[26]Saka M.Developmental toxicity of p,p′-dichlorodiphenyltrichloroethane,2,4,6-trinitrotoluene,their metabolites,and benzo[a]pyrene in xenopus laevis embryos[J].Environmental Toxicology and Chemistry,2004,23(4):1 065-1 073.
[27]Philips B H,Susman T C,Powell W H.Developmental differences in elimination of 2,3,7,8-tetrachlorodibenzo-p-dioxin(TCDD)during Xenopus laevis development[J].Marine Environmental Research,2006,62:34-37.
[28]Andreasen E A,Spitsbergen J M,Tanguay R L,et al.Tissue-specific expression of AHR2,ARNT2,and CYP1A in zebrafish embryos and larvae:Effects of developmental stage and 2,3,7,8-tetrachlorodibenzo-p-dioxin exposure[J].Soc Toxicology,2002,68(2):403-419.
[29]Lema S C,Schultz I R,Scholz N L,et al.Neural defects and cardiac arrhythmia in fish larvae following embryonic exposure to 2,2′,4,4′-tetrabromodiphenyl ether(PBDE 47)[J].Aquatic Toxicology,2007,82(4):296-307.
[30]Handley-Goldstone H M,Grow M W,Stegeman J J.Cardiovascular gene expression profiles of dioxin exposure in zebrafish embryos[J].Toxicological Sciences,2005,85(1):683-693.
[31]Hansson M C,Wittzell H,Persson K,et al.Characterization of two distinct aryl hydrocarbon receptor(AhR2)genes in Atlantic salmon(Salmo salar)and evidence for multiple AhR2 gene lineages in salmonid fish[J].G ene,2003,303:197-206.
[32]Hansson M C,Wittzell H,Persson K,et al.Unprecedented genomic diversity of AhR1 and AhR2 genes in Atlantic salmon(Salmo salarL.)[J].Aquatic Toxicology,2004,68(3):219-232.
[33]Kim E Y,Hahn M E.cDNA cloning and characterization of an aryl hydrocarbon receptor from the harbor seal(Phoca vitulina):a biomarker of dioxin susceptibility?[J].Aquatic Toxicology,2002,58(1-2):57-73.
[34]Billiard S M,Timme-Laragy A R,Wassenberg D M,et al.The role of the aryl hydrocarbon receptor pathway in mediating synergistic developmental toxicity of polycyclic aromatic hydrocarbons to zebrafish[J].Toxicological Sciences,2006,92(2):526-536.
[35]Hahn M E.The aryl hydrocarbon receptor:A com-parative perspective[J].Comparative Biochemistry and Physiology Part C:Pharmacology,Toxicology and Endocrinology,1998,121(1-3):23-53.
[36]Mandal P K.Dioxin:a review of its environmental effects and its aryl hydrocarbon receptor biology[J].Journal ofComparative Physiology B:Biochemical,Systemic,and Environmental Physiology,2005,175(4):221-230.
[37]Perdew G H.Association of the Ah receptor with the 90-kDa heat shock protein[J].Journal of Biological Chemistry,1988.263(27):13 802-13 805.
[38]Carver L A,Bradfield C A.Ligand-dependent Interaction of the aryl hydrocarbon receptor with a novel immunophilin homolog in Vivo[J].Journal of Biological Chemistry,1997,272(17):11 452-11 456.
[39]Kazlauskas A,Poellinger L,Pongratz I.Evidence that the Co-chaperone p23 regulates ligand responsiveness of the dioxin(aryl hydrocarbon)receptor[J].Journal ofBiological Chemistry,1999,274(19):13 519-13 524.
[40]Mimura J,Fujii-Kuriyama Y.Functional role of AhR in the expression of toxic effects by TCDD[J].Biochimica et Biophysica Acta(BBA)-G eneral Subjects,2003,1 619(3):263-268.
[41]Carney S A,Chen J,Burns C G,et al.Aryl hydrocarbon receptor activation produces heart-specific transcriptional and toxic responses in developing zebrafish[J].Molecular Pharmacology,2006,70(2):549-561.
[42]Carney S A,Prasch A L,Heideman W,et al.Understanding dioxin developmental toxicity using the zebrafish model[J].Birth Defects Research Part a-Clinical and Molecular Teratology,2006,76(1):7-18.
[43]Evans B R,Karchner S I,Allan L L,et al.Repression of aryl hydrocarbon receptor(AHR)signaling by AHR repressor:Role of DNA binding and competition for AHR nuclear translocator[J].Mol Pharmacol,2008,73(2):387-398.
[44]Welker D,Stetefeld N,Schirmer K,et al.The role of cyp1a and heme oxygenase 1 gene expression for the toxicity of 3,4-dichloroaniline in zebrafish(Danio rerio)embryos[J].Aquatic Toxicology,2008,86(1):112-120.
[45]Carlson D B,Perdew G H.A dynamic role for the Ah receptor in cell signaling[J].J Biochem Mol Toxicol,2002,16:317-325.
[46]Marlowe J L,Puga A.Aryl hydrocarbon receptor,cell cycle regulation,toxicity and tumorigenesis[J].J Cell Biochem,2005,96:1 174-1 184.
[47]Ramakrishnan S,Wayne N L.Impact of bisphenol-A on early embryonic development and reproductive maturation[J].Reproductive Toxicology,2008,25(2):177-183.
[48]Timme-Laragy A R,Cockman C J,Matson C W,et al.Synergistic induction of AHR regulated genes in developmental toxicity from co-exposure to two model PAHs in zebrafish[J].Aquatic Toxicology,2007,85(4):241-250.
[49]Wessel N,Rousseau S,Caisey X,et al.Investigating the relationship between embryotoxic and genotoxic effects of benzo[alpha]pyrene,17 alpha-ethinylestradiol and endosulfan onCrassostrea gigasembryos[J].Aquatic Toxicology,2007,85(2):133-142.

