異種關節軟骨與MSCs體外共同培養的實驗研究
(南京醫科大學附屬南京兒童醫院,江蘇南京,210029)
小兒骨科臨床工作中會面臨較多的由于軟骨破壞、軟骨缺損而帶來的一系列問題。關節軟骨是一種無血管的組織,依靠關節液營養,一旦損傷,自我修復能力有限,治療困難。近年來由于骨組織工程學的興起,為臨床軟骨缺損的修復帶來了希望。其主要內容包括種子細胞的選擇、支架材料的應用和培養環境的構造三個方面[1]。其中種子細胞的獲得及培養是整個組織工程學的基礎。因此選擇一種具有多向分化能力、免疫原性低、來源廣的種子細胞顯得尤為重要。但細胞來源問題成了組織工程技術的一個難題。現在可以成功的應用擴增培養的自體軟骨細胞、擴增軟骨細胞形成的類似軟骨組織和生物材料技術通過體內移植的方式修復受損的關節軟骨[2]。然而,研究結果表明這種方法并不是很理想:一是由于供體組織和供體部位病變的限制,二是無法獲得所需要的大量的軟骨細胞,三是在體外培養時軟骨細胞會向成纖維細胞分化[3]。另一方面,來自于骨髓的間充質干細胞已被證實可以在不同的誘導方法下向軟骨細胞、成骨細胞和脂肪細胞方向分化[4]。在體外試驗中,高濃度間充質干細胞在已知成分培養基中可以被誘導向軟骨細胞方向分化[5]。將間充質干細胞和成熟的軟骨細胞共培養不僅解決了誘導信號問題也解決了細胞來源問題。本實驗中,作者將間充質干細胞和成熟軟骨細胞在體外混合培養并分析相關的效應。
1 材料與方法
1.1 細胞培養
1.1.1 人間充質干細胞的培養:髖關節骨盆截骨術中所截取的股骨,采用全骨髓法分離培養BMSCs,用咬骨鉗剪成碎塊然后用吸管反復吹打,使骨塊中的骨髓基質細胞充分溢出,500 r/m in離心6min,棄上清,加入完全培養基(含10%胎牛血清,100 U/m L青霉素及100 g/m L鏈霉素),反復吹打制成單細胞懸液;以每毫升2×104個細胞接種培養瓶,37℃,5%CO2,飽和濕度孵箱內孵育。4 d后首次全量換液,棄去大量的懸浮細胞,以后隔1d換液。待細胞長滿單層后,用0.025%的胰蛋白酶消化以1∶2傳代(圖1)。
1.1.2 兔軟骨細胞的培養:2~3月齡的健康白兔,體質量2~2.5 kg,雌雄不限。無菌條件下取髖關節軟骨,PBS反復洗滌去掉血污,仔細剝離附著的滑膜、纖維組織,剪碎組織至1 mm×1 mm大小,加入4m L 0.0 5%的Ⅱ型膠原酶消化30min,離心去上清,加入0.1%的Ⅱ型膠原酶3m L和0.25%的胰酶3m L 37℃振蕩消化60~100 min,肉眼見消化液渾濁,將消化后的小軟骨塊均勻貼在25 cm2培養瓶下壁,加入少量含體積分數為10%FBS的完全培養基(含青霉素100U/m L,鏈霉素100 mg/L),將培養瓶翻轉放置在培養箱內20~30min,待小軟骨塊貼牢培養瓶下壁后,加入5 m L完全培養基,置于37℃、5%CO2、飽和濕度條件的培養箱內培養,1周后換液,以后每周2次換液。當細胞增殖到鋪滿培養瓶底的80%~90%后傳代。加入1m L 0.25%胰蛋白酶0.02%EDTA消化,為了加快消化速度可以邊消化邊晃動培養瓶,在顯微鏡下觀察,當70%貼壁細胞被消化下來時(約1m in),加入2m L培養基終止消化,用吸管吹打2~3次使細胞完全脫落下來成為單細胞懸液,計數后離心,按1∶2 或 1∶3傳代(圖2)。
1.1.3 間充質干細胞與關節軟骨細胞共培養:將收集到的第3代關節軟骨細胞和第2代間充質干細胞先用含0.15%胰蛋白酶和0.02%EDTA的PBS液沖洗1次,再用無血清培養基沖洗,然后將細胞混懸于含 50 mg/m L ITS+Premix(6.25 μg/m L胰島素,6.25μg/m L轉鐵蛋白,6.25 ng/m L硒酸,1.25 mg/m L苯磺酸和5.35 mg/m L亞油酸)100μg/m L丙酮酸鹽、50μg/m L抗壞血酸鹽-2-磷酸鹽、10 U/L地塞米松和10μg/m L TGF-β3的高糖DMEM 培養液中。以5種不同的比率進行細胞培養(見表1):間充質干細胞單獨培養,間充質干細胞和關節軟骨細胞分別以1∶2、1∶1、2∶1的比例培養,關節軟骨細胞單獨培養細胞混合后放入15 m L聚丙烯試管中37℃,5%CO2培養,每周換液3次,4周后用PBS液沖洗后用福爾馬林固定。

表1 間充質干細胞和兔軟骨細胞的培養比例(105)
1.2 RNA的抽提與real-time PCR
TRIZOL法抽提總RNA,進行濃度和純度測定后M-M LV法逆轉錄為c-DNA。PCR反應體系為:2×PCRMaster Mix 12.5μL,cDNA模板1μL,上下游引物各1μL,加水至終體積2 5μL。cbfa 1的擴增條件為 :9 5℃預變性5 min,94℃變性30 s,55℃退火30 s,72℃延伸30 s,共循環30次,最后72 ℃延伸7 min;βactin的擴增條件為95℃預變性5 m in;94℃變性30 s,55℃退火30 s,72℃延伸30 s,共循環26次;最后72℃延伸7 min。取5μL PCR產物,2.0%瓊脂糖/溴化乙錠凝膠電泳。UVP凝膠密度掃描儀及其分析軟件進行半定量分析。以18 s rRNA為內參,行相對定量比較,引物序列如下:

2 結 果
2.1 間充質干細胞與軟骨細胞形態(圖1、2)
2.2 混合培養中的細胞比例
采用人類特異性β2微球蛋白引物,同時針對人和兔共有序列18 s rRNA設計引物,PCR擴增,以單獨培養的間充質干細胞為對照計算不同混合比例試驗組中β2微球蛋白與18 s rRNA的相對比例。在開始階段,在混合培養的試管中β微球蛋白基本沒有變化,經過4周的培養后這種比例沒有明顯的變化(圖3),這表明兩種細胞的增殖比例接近相同。
圖1 間充質干細胞 40倍
圖2 軟骨細胞 40倍
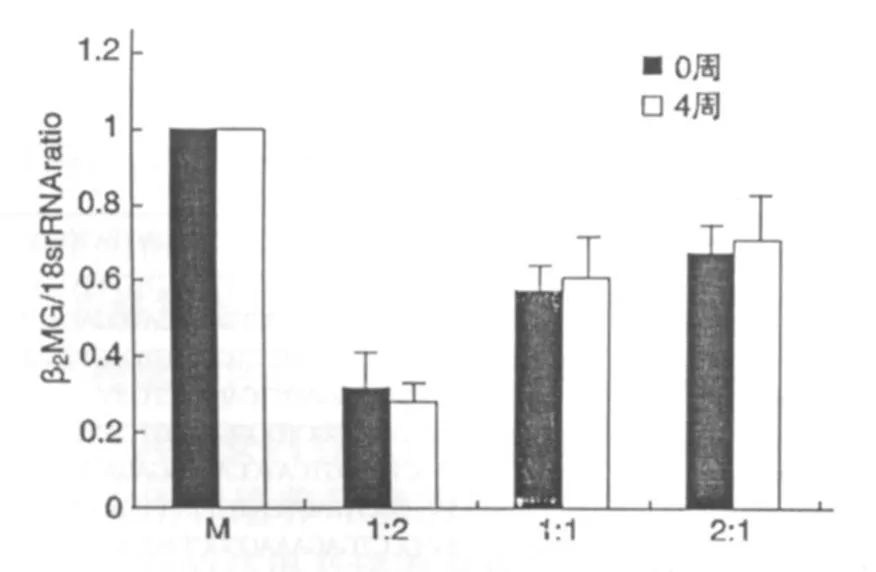
圖3 共培養中細胞比例的變化
2.3 混合培養試管中的軟骨細胞表型
用Ⅱ型膠原與Ⅰ型膠原表達的比例來估計軟骨細胞表型,實驗數據表明在軟骨細胞單獨培養、間充質干細胞和軟骨細胞比例為1∶2、1∶1和2∶1的試管中Ⅱ型膠原與Ⅰ型膠原表達的比例分別為:1.71、0.72、0.63、0.50, 在最初的培養中 Ⅱ型膠原與Ⅰ型膠原表達的比例隨著間充質干細胞百分比的增加而降低。在經過四周的培養后這種比例分別增加至2.39、1.12、1.42、1.81,見圖4。在混合培養中間充質干細胞比例高的樣本其Ⅱ型膠原與Ⅰ型膠原表達的比例增高,高比例的間充質干細胞促進Ⅱ型膠原的表達。

圖4 Ⅱ型膠原與Ⅰ型膠原的比例隨時間變化的規律
2.4 Ⅱ型膠原、β2微球蛋白、總Ⅱ型膠原、SOX9的表達
人特有的Ⅱ型膠原在人間充質干細胞向軟骨細胞轉化時表達增加,人特有的β2微球蛋白是人間充質干細胞的特異標志,在經過四周的培養后,在各個實驗組中幾乎沒有人特有的Ⅱ型膠原表達,而人特有的β2微球蛋白的表達是明顯的(圖5),這表明人間充質干細胞沒有出現明顯的向軟骨細胞方向分化的現象。總Ⅱ型膠原和SOX9基因是軟骨形成的標志,在實驗中總Ⅱ型膠原的表達增加(圖6),SOX9的表達隨著混合比例的增加而增加(圖7),表明了軟骨形成增加。

圖5 β2微球蛋白的表達
3 討 論
組織工程學要求提供獨立的自體細胞,多數用于組織修復的自體細胞使用的是健康調查的活組織檢查提供的或者用動物的關節軟骨進行關節軟骨的修復。這些方法的缺點是很明顯的:可獲得的細胞數量非常有限,有創途徑會造成供體部位的損害而增加了以后發生股關節炎的可能性,而且在體外擴增時會發生去分化的現象,限制了其的臨床應用[6]。現在更多的研究集中在多能干細胞或相關細胞的組織再生。從骨髓分離的間充質干細胞有分化成不同的細胞表型的多向分化能力并且可以在不同的誘導因子的誘導下向不同的表型分化[7]。參與MSCs向軟骨分化過程的生長因子有多種:TGF-β、BMP、IGF。它們的作用不盡相同,有的單獨誘導軟骨形成,有的促進軟骨細胞分泌細胞外基質,有的維持軟骨細胞的表型。
細胞通訊系統賦予一種組織可以有幾種相似的細胞功能,例如細胞新陳代謝的調節。細胞通訊系統不僅對同一組織的同種細胞起作用,而且可以通過細胞間隙對不同的細胞起作用[8]。在成骨細胞生成過程中細胞通訊系統和旁分泌系統共同調節細胞之間的信號傳導,并且協同調節細胞內環境來適應外環境的變化[9]。有研究表明,從成熟軟骨組織獲得的軟骨細胞擁有細胞間隙功能[10]。
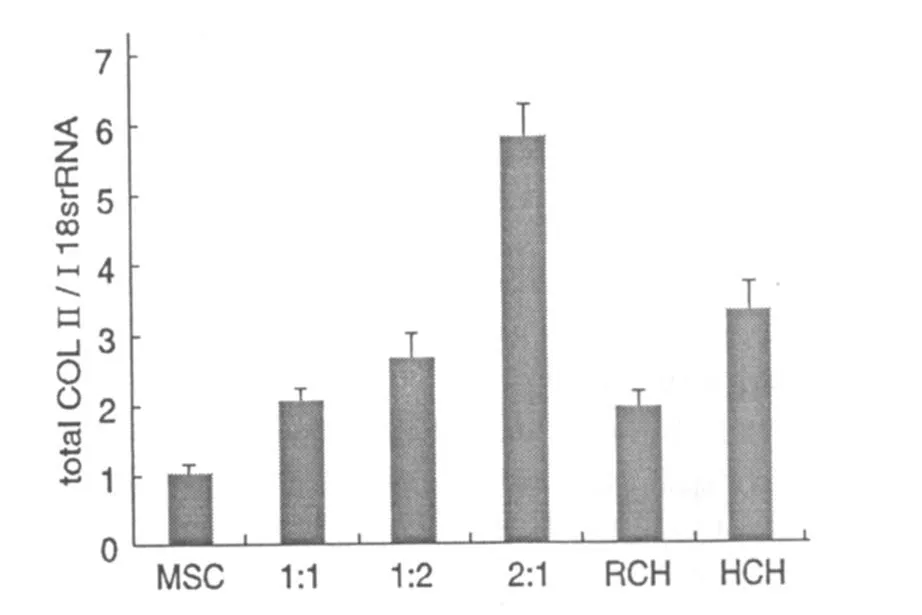
圖6 總Ⅱ型膠原的表達

圖7 SOX 9的表達
所有這些表明離體的軟骨細胞有很大的可能性給予或接收來自間充質干細胞的信號,如果將間充質干細胞和軟骨細胞混合培養在一個能夠相互作用的環境,那么這種培養方法將有可能成為軟骨修復工程中一種非常有用的方法,在我們的實中,我們用β2微球蛋白相對表達量與不同比例人間充質干細胞變化的相關性驗證了人間充質干細胞和兔軟骨細胞能夠共存并在四周的培養期內保持最初的混合比例。因此,試管中軟骨表型的變化不是根據細胞性質變化而變化。如先前描述的那樣所有試管培養中都有明確的軟骨形成介質。單獨培養的間充質干細胞沒有表現出任何明確的向軟骨細胞方向分化的信號。有報告表明,間充質干細胞經過多次傳代后逐漸喪失向軟骨細胞分化的潛力,第3代和第8代細胞向軟骨方向分化能力最強[11]。本組選用的第3代干細胞在實驗中并未表現出明顯的向軟骨細胞分化的現象。RT-PCR分析人類Ⅱ型膠原蛋白在任何一個試管中均未檢測到,而人特有的β2微球蛋白的表達是明顯的,這表明間充質干細胞并不是直接向軟骨方向分化。Ⅱ型膠原蛋白和軟骨基質形成的增加可能是由于間充質干細胞對軟骨細胞的正反饋調節。軟骨細胞再分化和去分化需要一個三維立體的環境和生長因子來增強其分化效率[12]。已有研究報告FGF-2能夠維持軟骨分化能力,同時TGF-β、IGF-1、BMP-2能夠正反饋調節軟骨基質的形成。這些生長因子在間充質干細胞單層培養中能夠持續分沁或者是在軟骨形過程中分沁開始增加。以前的研究證明SOX 9在軟骨細胞形成時表達增高[13]。實驗中SOX9基因和總Ⅱ型膠原的表達隨著間充質干細胞和軟骨細胞比例的增加而增加,這表明在共培養時軟骨形成增多。結合以上的結果,一個可能的機制是在共培養當中間充質干細胞以間接的旁分沁的方式影響軟骨細胞形成和正向調節軟骨細胞的表達。
間充質干細胞和兔軟骨細胞共培養正反饋調節軟骨細胞表型的表達,增加了軟骨細胞形成。這種共培養方法適用于在體外擴增成熟軟骨細胞并且不會降低他們的分化能力。在以前的研究中沒有觀察到間充質干細胞和軟骨細胞之間的這種誘導區別,下一步的研究有必要用原始間充質干細胞或自體細胞系統分析這種效應。
[1] Tuan RS.Stemm ing cartilage degeneration:adultmesenchymalstem cellsasa cell sou rce for articular cartilage tissue engineering[J].Arthritis,2006,54(10):3075.
[2] Peterson L,M inas T,Brittberg M,et al.Tw o-to 9-year outcome after autologous chondrocytetransplantation of the knee[J].C lin Orthop Relat Res,2000,(374):212.
[3] M iljkovic ND,Cooper GM,Marra KG.Chondrogenesis,bonemorphogenetic protein-4 and mesenchymal stem cells[J].Osteoarthritis Cartilage,2008,16(10):1121.
[4] CsakiC,Matis U,MobasheriA,et al.Chondrogenesis,osteogenesisand adipogenesisof caninemesenchymalstem cells:a biochem ical,morphological and ultrastructural study[J].Histochem Cell Biol,2007,128(6):507.
[5] Jungu.Yoo,M.D.T racis,Barthel,et al.The Chondrogenic Potential of Human Bone-Marrow-Derived M esenchymal Progenitor Cells[J].The Journal of Bone and Joint Su rgery,1998,80:1745.
[6] Bulte JW,Kostura L,Mackay A,et al.Feridex-labeled mesenchymal stem cells:cellular differentiation and M R assessment in a canine myocardial infarction model[J].Acad Radiol,2005,12(1):S2.
[7] A lexandros.E.Beris,MariosG.Lykissas,Ch ristos D.Papageorgiou.Advances in articular cartilage repair[J].Perm issions&Reprin ts,2005,36(4):S14.
[8] Baluska F,Volkmann D,Menzel D.Plant synapses:actinbased domains for cell-to-cell communication[J].T rends Plant Sci,2005,10(3):106.
[9] Romanello M,Veronesi V,D′AndreaP.Mechanosensitivity and intercellular communication in HOBIT osteoblastic cells:a possible role for gap junction hemichannels[J].Biorheology,2003,40(1-3):119.
[10] DonahueHJ,Guilak F,Vander Molen MA,et al.Chondrocytes isolated from matu re articular cartilage retain the capacity to form functional gap junctions[J].J Bone M iner Res,1995,10(9):1359.
[11] Frank P.Barry,J.Mary Murphy.Mesenchymalstem cells:clinical applications andbiological characterization The International Journal of Biochem istry&Cell Biology,2004,36(4):568.
[12] Sechriest VF,M iao YJ,Niyibizi C,et al.GAG-augmented polysaccharide hydrogel:a novel biocompatible and biodegradable material to support chondrogenesis[J].J Biomed Mater Res,2000,49(4):534.
[13] Sekiya I,Vuoristo JT,Larson BL,et al.In vitro cartilage formation by human adult stem cells from bonemarrow stroma defines the sequenceof cellular andmolecular events during chondrogenesis[J].Proc Natl Acad Sci U SA,2002,99(7):4397.

