鉤端螺旋體外膜蛋白LipL32單克隆抗體的制備及鑒定
王亞琳,張湘燕,王壓娣,車小燕,郭曉奎
1. 上海交通大學醫學院基礎醫學院病原生物學教研室,上海 200025; 2. 南方醫科大學珠江醫院臨床醫學院基礎研究所,廣州 510282
鉤端螺旋體(簡稱鉤體)屬螺旋體目、鉤端螺旋體科、鉤端螺旋體屬。鉤體呈細長絲狀、圓柱螺旋形。侵入人體以黏膜和皮膚途徑最為常見[1]。致病性鉤體至少可分為16個基因種、25個血清群、260多個血清型,可引起鉤端螺旋體病(簡稱鉤體病)。鉤體病是世界范圍內流行最廣泛的人畜共患病之一,動物宿主達200余種,是潛在的世界性公共衛生問題,我國在1953年已將其列為乙類法定傳染病。2003年,我國完成第1株致病性鉤體的基因組測序工作[2]。到目前為止,完成測序的鉤體株已有6株,為鉤體的各項研究工作奠定了良好的基礎。
鉤體病的臨床癥狀多變,極易與其他疾病混淆[3],故早期實驗室診斷對于有效治療、監控鉤體病具有十分重要的作用。鉤體病血清學診斷方法包括顯微凝集試驗(microscopic agglutination test,MAT)和酶聯免疫吸附試驗(enzyme-linked immunosorbent assay,ELISA)等,用于檢測患者血清中針對鉤體的特異抗體水平,但不能很好區分現癥感染與既往感染。檢測鉤體抗原的方法,如培養法因耗時長且靈敏度低而不宜用于早期快速診斷;核酸檢測法,如聚合酶鏈反應(polymerase chain reaction,PCR)等對實驗儀器要求高,且特異性低,存在較高的假陽性。
LipL32是迄今為止已知的鉤體外膜中含量最豐富的暴露蛋白,是致病性鉤體的保守蛋白,有很好的免疫原性,被認為是最好的診斷抗原之一,靈敏度和特異度均可達到90%以上[4]。本實驗嘗試制備LipL32的單克隆抗體并篩選出其中可用于檢測的,以期能克服現有鉤體抗原檢測中靈敏度和特異度較低等缺點,為快速、準確地檢測鉤體抗原提供可能。
1 材料和方法
1.1 材料
本研究使用在中國流行的15株致病性鉤體株及1株腐生型株(表1),均來源于中國疾病預防控制中心傳染病預防控制研究所。EMJH培養基參照參考文獻[3]配置;RPMI-1640、胎牛血清(fetal bovine surum,FBS)、DMEM培養基、慶大霉素購自Gibco公司,十二烷基硫酸鈉(sodium dodecyl sulfate,SDS)購自TaKaRa公司,福氏完全佐劑、福氏不完全佐劑、50%聚乙二醇1450(polyethylene glycol 1450,PEG1450)、HAT營養選擇培養基〔含次黃嘌呤(hypoxantin)、氨基蝶呤(aminopterin)和胸腺嘧啶脫氧核苷(thymidin)〕、HT營養選擇培養基購自Sigma Aldrich公司,辣根過氧化物酶(horseradish peroxidase,HRP)標記的羊抗人IgG和IgM購自Sigma公司,HRP標記的羊抗鼠IgM、IgG、IgG1、IgG2a、IgG2b和IgG3購自Zymed公司,生物素購自Pierce公司,HRP標記的親和素購自BioLegend公司。異丙基-β-D-硫代半乳糖苷(isopropyl-D-thiogalactopyranoside,IPTG)購自上海生工生物工程技術服務有限公司,NTA樹脂購自上海申能博彩公司,ELISA底物A、B液購自上海晶美公司,酶標板購自康寧公司。SPF級BALB/c小鼠和NS-1細胞株購自第一軍醫大學實驗動物中心。
表1中國流行的15株致病性鉤體及1株非致病性鉤體的血清群、血清型、菌株及菌號
Tab.1Fifteendominantpathogenicstrainsandonenon-pathogenicstrainofLeptospirainChina
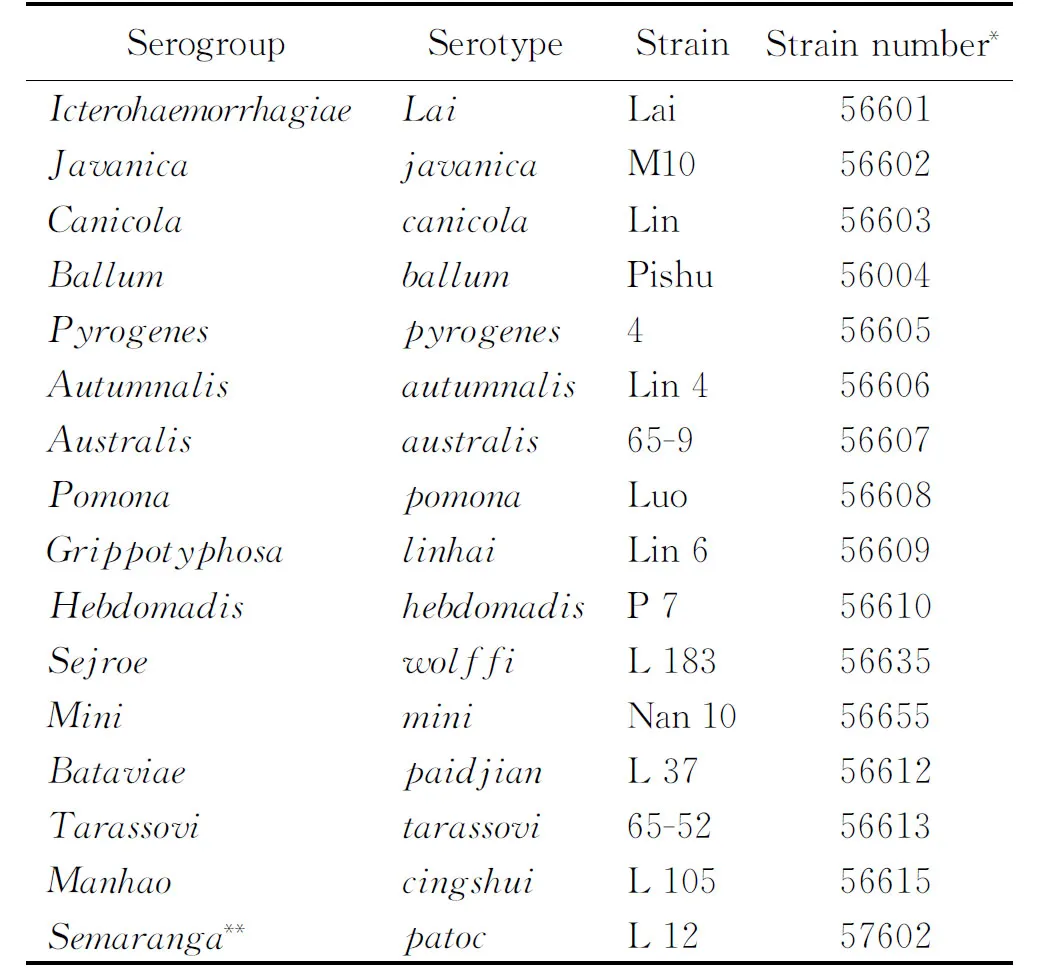
*,the strain number of National Institute for the Control of Pharmaceu-tical and Biological Products;**, non-pathogenicLeptospirastrain.
1.2 方法
1.2.1 免疫原與檢測原的制備
1.2.1.1鉤體外膜蛋白的分離[5]用EMJH培養基培養黃疸出血群賴株鉤體至1×108條/ml后,4 ℃ 8 000g離心30 min;用等培養體積的磷酸緩沖液(phosphate-buffered saline,PBS)(含5 mmol/L MgCl2)4 ℃ 8 000g,洗2次;然后加入1/20培養體積于4 ℃預冷的1% Triton X-114〔含150 mmol/L NaCl、10 mmol/L Tris(pH 8.0)、1 mmol/L EDTA〕冰浴30 min,17 000g離心10 min;取上清液,加入20 mmol/L CaCl2,37 ℃孵育10 min,1 500g室溫離心10 min。有機相用4 ℃預冷的丙酮沉淀過夜,次日8 000g離心10 min,沉淀為外膜成分。
1.2.1.2非變性條件下LipL32重組蛋白的表達LipL32重組蛋白以問號鉤體黃疸出血群賴株的基因組為模板,表達載體為Pet28b,表達菌株為大腸埃希菌(Escherichiacoli,E.coli)BL21。用1 mmol/L IPTG 22 ℃誘導表達16 h,收集菌體。用1/20細菌生長體積的NTA-0〔20 mmol/L Tris-HCl (pH 7.9)、0.5 mol/L NaCl、10% glycerol〕和1 mmol/L苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)懸浮細胞,加0.4 mg/ml溶菌酶裂解,然后加0.05% Triton X-100,充分混勻;冰上放置30 min,間或混勻,冰上超聲破碎。20 000g,4 ℃離心20 min,取上清液與NTA-0平衡好的NTA樹脂混合,4 ℃過夜。次日加入層析柱中,用含0、20、40、60、80、100、200、500 mmol/L咪唑的NTA-0溶液梯度洗脫,收集洗脫液,經蛋白電泳和免疫印跡法鑒定洗脫液中是否含純的LipL32重組蛋白。將該洗脫液用0.01 mol/L PBS透析、濃縮,考馬斯亮藍法檢測蛋白濃度。
1.2.2 單克隆抗體的制備
1.2.2.1動物免疫BALB/c小鼠,雌性,4~6周齡,分2組,每組3只。第1組用LipL32重組蛋白免疫,每次50 μg/只。第2組用LipL32重組蛋白與抽提的外膜蛋白交替免疫,每次50 μg/只。第1次采用福氏完全佐劑,與蛋白液等體積混勻,后3次免疫采用福氏不完全佐劑,每2周免疫1次。測定小鼠血清效價,分別選取2組中免疫效果最佳者于融合前3 d用LipL32重組蛋白腹腔脾內注射加強免疫(100 μg)。
觀察患者的心絞痛發作情況(發病次數及時間),記錄治療前、后24 h動態心電圖情況,結合冠心病心絞痛療效標準進行治療效果評價[3],統計兩組患者不良反應發生率。
1.2.2.2抗體效價測定免疫4次后,經尾靜脈采血測定血清中抗體效價。取LipL32重組蛋白,鉤體56601株全菌超聲裂解上清液包板,1 μg/ml,100 μl/孔,4 ℃包被16 h;封閉液(1% BSA、0.1% Tween-20)300 μl/孔,4 ℃封閉16 h,PBS-T洗板3次;血清稀釋后加樣,37 ℃孵育1 h,PBS-T洗板3次;加1∶1 000稀釋的羊抗鼠HRP-IgG,37 ℃孵育30 min,PBS-T洗板5次;加ELISA底物A、B液,避光37 ℃顯色10 min,2 mol/L硫酸50 μl/孔終止反應;450 nm波長下測定A值。
1.2.2.3細胞融合挑選2組中免疫效果最佳小鼠,分別取出脾臟,用高溫滅菌的銅網研磨,收取細胞,與NS-1細胞按5∶1混合。離心,棄上清液,于37 ℃水浴中緩慢加入1 ml PEG1450,1 min內加完,分別于1、2、3、4、5 min內加1、2、3、4、5 ml無血清RPMI-1640終止融合;最后加入10 ml含15% FBS的RPMI-1640培養基,室溫300g離心5 min;棄上清液,用20 ml上述培養基重懸,平均分配至加有飼養細胞的96孔板中,100 μl/孔,37 ℃培養。9 h后,加2.5×HAT、含15% FBS的RPMI-1640,100 μl/孔,進行選擇性培養。48 h后,更換為1×HAT,100 μl/孔。
1.2.2.4陽性雜交瘤細胞的篩選與克隆化LipL32重組蛋白、鉤體56601株全菌超聲裂解上清液作為包被抗原,用間接ELISA檢測96孔板中克隆細胞分泌上清液。挑選結果為陽性的繼續培養、擴增,以有限稀釋法亞克隆化篩選,共進行2次篩選,篩選方法不變。將篩選出的單克隆抗體細胞株擴大培養,用含有空載Pet28b質粒的(E.coli)BL21菌株超聲裂解上清液作為包被抗原,用間接ELISA對雜交瘤細胞上清液進行復測,篩選出陰性的細胞株擴大培養并凍存。
1.2.2.5腹水的制備與抗體的純化取10~12周齡BALB/c雌性小鼠6只,接種細胞前1周,腹腔注射降植烷0.5 ml;收集篩選出的單克隆抗體雜交瘤細胞,按每只小鼠給予6×105個細胞腹腔注射接種;待小鼠腹部脹大后(接種1~2周),引流腹水,可收集多次。采集的腹水采用辛酸/硫酸銨分步沉淀法提純。提純抗體經10% SDS-聚丙烯酰胺凝膠電泳(SDS-polyacrylamide gel electrophoresis,SDS-PAGE)測定純度。
1.2.3 單克隆抗體生物學特性的鑒定
1.2.3.1亞類包被LipL32重組蛋白于96孔板中,1 μg/ml,100 μl/孔,包被、封閉。加入單克隆抗體細胞株細胞培養上清液,100 μl/孔。一抗為羊血清稀釋的羊抗鼠IgG、IgM、IgG1、IgG2a、IgG2b、IgG3(按1∶1 000稀釋)。ELISA操作步驟同上。
1.2.3.2標記抗體效價采用間接ELISA測定標記生物素的單克隆抗體效價,BSA包被板條作陰性對照。LipL32重組蛋白包被濃度均為1 μg/ml,HRP-親和素稀釋度為1∶1 000,其他操作步驟同上。抗體測定A值/陰性對照A值≥2.1時,抗體最低濃度即為抗體效價。
1.2.4 單克隆抗體的配對
1.2.4.1單克隆抗體標記生物素4.4 mg/ml的生物素溶液30 μl與2 mg單克隆抗體在PBS中作用2 h,再以PBS充分透析,除去游離生物素,將標記好的抗體凍存。
1.2.4.2單克隆抗體之間競爭抑制實驗檢測表位以重組LipL32蛋白1 μg/ml包板封閉,每孔先加入1 mg/ml純化的單克隆抗體50 μl,再分別加入生物素標記的單克隆抗體50 μl,37 ℃孵育1 h,PBS-T洗滌3次;加入HRP-親和素,37 ℃孵育30 min,PBS-T洗滌5次;加入TMB顯色液,37 ℃避光顯色15 min,450 nm波長下測定A值。以單克隆抗體對同一生物素標記單克隆抗體的抑制為陽性對照,以已知無關單克隆抗體對標記單克隆抗體的抑制為陰性對照,計算各單克隆抗體間的抑制率。抑制率計算公式:(1-各孔測定值/陰性對照值)×100。抑制率>75%為相關,50%≤抑制率≤75%為不完全相關,25%≤抑制率<50%為不相關,抑制率<25%為完全不相關。
1.2.4.3配對實驗包被抗體10 μg/ml,封閉后檢測。采用雙抗夾心ELISA兩步法進行29株抗體的相互配對實驗,檢測LipL32蛋白設50、25、12.5、6.25、3.125 ng/μl共5個稀釋度,檢測鉤體56601株全菌超聲裂解上清液設500、250、125、62.5、31.25 ng/μl共5個稀釋度,無關蛋白為陰性對照,稀釋液為空白。所有樣品檢測加樣均為100 μl/孔。選擇檢測結果中A值均較高、空白與陰性對照值低的抗體對15株中國流行的及1株非致病性的鉤體再次檢測。選擇對該流行的15株A值高而對非致病株A值低的抗體保存備用。
1.2.4.4特異性鑒定選取SARS病毒、登革病毒、金黃色葡萄球菌、曲霉的全菌超聲裂解上清液作為包被抗原,用間接ELISA檢測29株單克隆抗體的特異性。ELISA操作步驟同上。
2 結果
2.1 SDS-PAGE和蛋白免疫印跡法鑒定29株單克隆抗體
29株單克隆抗體細胞株是以腹腔接種小鼠制備的腹水型單克隆抗體,用辛酸/硫酸銨分布沉淀法純化,純化后單克隆抗體經SDS-PAGE分析,抗體熱變性后分解為2條相同的重鏈(50×103處)和2條相同的輕鏈(25×103處),IgM的重鏈相對分子質量(Mr)偏大些。SDS-PAGE分析顯示,所得單克隆抗體純度除22號外均較高(圖1)。
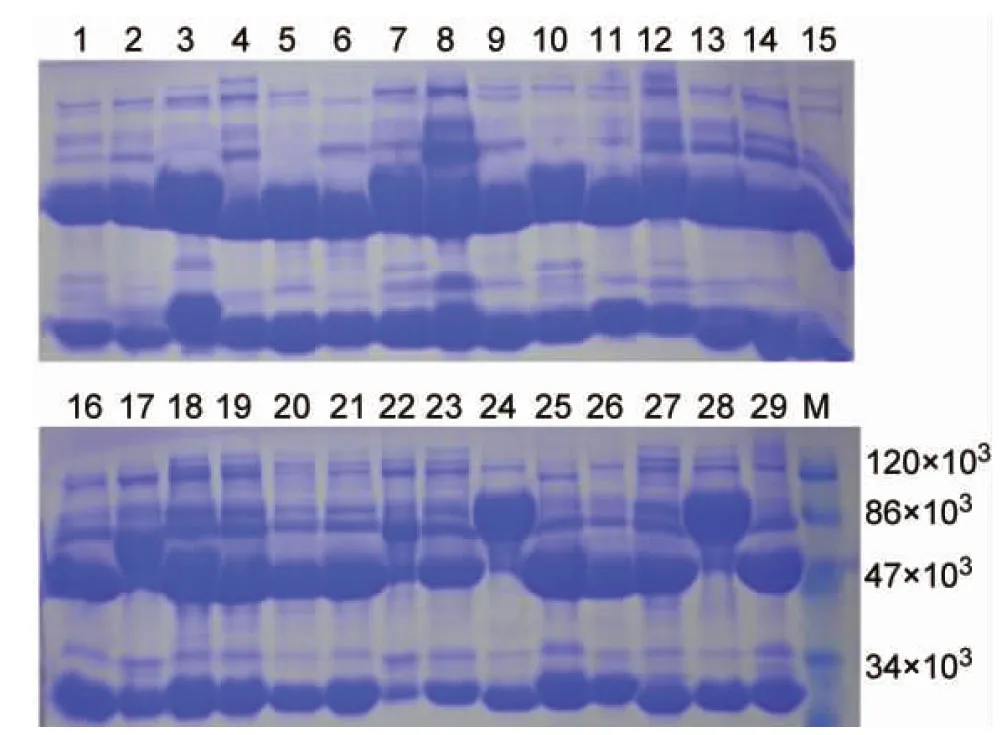
M, protein molecular marker; 1-29, mAbs against LipL32.
圖129株LipL32單克隆抗體SDS-PAGE分析
Fig.1SDS-PAGEanalysisof29monoclonalantibodiesagainstLipL32
蛋白免疫印跡法檢測29株單克隆抗體,結果如圖2所示,29株單克隆抗體在30×103處有一明顯條帶,表明29株單克隆抗體均與LipL32重組蛋白發生反應,且大部分條帶單一、特異性好。陰性對照為單克隆抗體稀釋液。
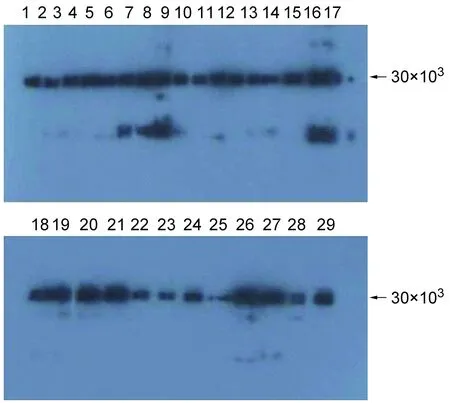
圖2蛋白免疫印跡法檢測29株LipL32單克隆抗體與鉤體抗原的特異性結合
Fig.2Specificreactivityof29monoclonalantibodiesagainstLipL32withLeptospiraantigenbyWesternblotanalysis
2.2 單克隆抗體的生物學特性
29株生物素標記的單克隆抗體經間接ELISA檢測,效價均在200 000以上,都可用來進行配對實驗。其中單克隆抗體1、2、7、10、12、18為IgG2b類,3、4、5、6、9、11、13、14、15、16、19、20、21、26、27為IgG1類,8、23、25、29為IgG2a類,24、28為IgM類,22為IgG3類,17為其他亞類。
2.3 競爭抑制實驗結果
根據公式計算出各單克隆抗體間的抑制率,從而可看出各單克隆抗體間的抗原表位是否相同或存在交叉。結果這29株單克隆抗體的識別表位可分為8個組。第1組:1、7、8、12、17、25;第2組:2、9、10、20;第3組:3、14、23、27、29;第4組:4、5、6、11、13、18、26;第5組:19、21、22;第6組:24、28;第7組:15;第8組:16。這8個組代表8個不同的抗原識別表位。
2.4 配對實驗結果
用LipL32重組蛋白和鉤體56601株全菌超聲裂解上清液作為檢測抗原進行配對實驗,挑選16對檢測效果較好的單克隆抗體為候選做進一步篩選。這些單克隆抗體分別為2/b-17、2/b-26、4/b-10、6/b-10、7/b-2、7/b-10、9/b-7、9/b-26、12/b-2、12/b-10、19/b-7、19/b-10、19/b-12、20/b-7、20/b-12和27/b-10。再用15株中國鉤體流行株和1株非致病性鉤體作為檢測抗原,再次篩選候選單克隆抗體。結果19/b-12可檢測出15株中國鉤體流行株,并與1株非致病性鉤體無交叉反應;檢測LipL32重組蛋白靈敏度達1 ng/ml,與SARS病毒、登革病毒、金黃色葡萄球菌和曲霉的菌體抗原無交叉反應,靈敏度與特異度均非常理想。
3 討論
LipL32是鉤體外膜中含量最豐富的蛋白,且在致病性鉤體中高度保守,在鉤體病的診斷、疫苗研制及致病機制等方面發揮重要作用。MIF Bioinformatics網站生物信息學分析結果表明LipL32有8個抗原表位,本實驗制備的29株單克隆抗體能識別8個不同的抗原表位,已較全面地包含LipL32的抗原表位,且這些單克隆抗體的效價在200 000以上,這既為篩選合適的單克隆抗體提供了很好的候選資源,也為鉤體病的其他研究打下了基礎。國際上也有LipL32單克隆抗體的文獻報道,這些單克隆抗體被應用于診斷和保護性實驗,并取得了一定的效果[6]。而且本實驗中29株單克隆抗體識別的抗原位點有8個之多,且成功配對篩選出很好的抗原檢測單克隆抗體,有著很好的應用前景。
本實驗獲得了單克隆抗體19/b-12,檢測LipL32重組蛋白的靈敏度為1 ng/ml,可與國內流行的15株致病性鉤體相關抗原發生特異性反應,而與非致病性鉤體菌體抗原無反應。此外,它與SARS病毒、登革病毒、金黃色葡萄球菌的菌體抗原無交叉反應。因此,該抗體可能在鉤體抗原的診斷方面具有良好的應用前景。
本實驗表達的LipL32重組蛋白在非變性條件下純化,保證了其免疫原性。由于表達載體是E.coli,為了保證篩選到特異性針對LipL32蛋白天然表位的單克隆抗體,一組小鼠全程用LipL32重組蛋白免疫,另一組小鼠用LipL32重組蛋白與鉤體外膜蛋白交替免疫,融合時選擇了2組中效價最高的各1只小鼠進行實驗。最后篩選到的29株單克隆抗體分別來自這2只小鼠,從抗體數量和抗原識別表位分析,此2組小鼠差異無顯著性,從而證實,非變性條件下純化的LipL32重組蛋白也同樣具有很好的免疫原性。
[1] 嚴杰,戴保民,于恩庶.鉤端螺旋體病學[M].第三版.北京:人民衛生出版社,2006,172-173.
[2] Ren SX, Fu G, Jiang XG, Zeng R, Miao YG, Xu H, Zhang YX, Xiong H, Lu G, Lu LF, Jiang HQ, Jia J, Tu YF, Jiang JX, Gu WY, Zhang YQ, Cai Z, Sheng HH, Yin HF, Zhang Y, Zhu GF, Wan M, Huang HL, Qian Z, Wang SY, Ma W, Yao ZJ, Shen Y, Qiang BQ, Xia QC, Guo XK, Danchin A, Saint Girons I, Somerville RL, Wen YM, Shi MH, Chen Z, Xu JG, Zhao GP. Unique physiological and pathogenic features of Leptospira interrogans revealed by whole-genome sequencing [J]. Nature, 2003, 422(6934): 888-893.
[3] World Health Organization. Human leptospirosis: guidance for diagnosis, surveillance and control. International Leptospirosis Socity (ILS), 2005. [C/OL]. http://whqlibdoc.who.int/hq/2003/WHO_CDS_CSR_EPH_2002.23.pdf.
[4] Flannery B, Costa D, Carvalho FP, Guerreiro H, Matsunaga J, Da Silva ED, Ferreira AG, Riley LW, Reis MG, Haake DA, Ko AI. Evaluation of recombinant Leptospira antigen-based enzyme-linked immunosorbent assays for the serodiagnosis of leptospirosis [J]. J Clin Microbiol, 2001, 39(9): 3303-3310.
[5] Haake DA, Walker EM, Blanco DR, Bolin CA, Miller MN, Lovett MA. Changes in the surface of Leptospira interrogans serovar grippotyphosa during in vitro cultivation [J]. Infect Immun, 1991, 59(3): 1131-1140.
[6] Coutinho ML, Vasconcellos FA, Fernandes CP, Seyffert N, Seixas FK, Ko AI, Dellagostin OA, Aleixo JA. Evaluation of the anti-LipL32 monoclonal antibodies potential for use in leptospirosis immunodiagnostic tests [J]. J Immunoassay Immunochem, 2007, 28(3): 279-288.

